备考2020年高考化学二轮专题 07 化学反应中的能量变化
试卷更新日期:2020-03-31 类型:二轮复习
一、单选题
-
1. 化学反应通常伴随着能量变化,下列说法正确的是( )A、反应热就是反应中放出的能量 B、在任何条件下,化学反应的焓变都等于化学反应的反应热 C、由C(S,石墨)=C(S,金刚石) ΔH=+1.9 kJ·mol-1可知,金刚石比石墨稳定 D、等量的硫蒸气和硫固体分别完全燃烧,前者放出的热量多2. 根据下图所得判断正确的是( )

已知:H2O(g) = H2O(l) △H =﹣44 kJ/mol
A、图 1 反应为吸热反应 B、图 1 反应使用催化剂时,会改变其△H C、图 2 中若 H2O 的状态为液态,则能量变化曲线可能为① D、图 2 中反应为 CO2(g) + H2(g) = CO(g) + H2O(g) △H = + 41 kJ/mol3. 根据下列信息判断氢气燃烧生成水时的热量变化,其中一定正确的是( )
 A、生成1mol H2O时放出热量245 kJ B、H2O分解为H2与O2时放出热量 C、甲、乙、丙中物质所具有的总能量大小关系为甲>乙>丙 D、氢气和氧气的总能量小于水的能量4. 已知一定条件下断裂1 mol化学键生成气态原子需要吸收的能量如下:H—H 436 kJ;Cl—Cl 243 kJ;H—Cl 431 kJ。下列所得热化学方程式或结论正确的是( )A、氢分子中的化学键比氯气分子中的化学键更稳定 B、2HCl(g) = H2(g) + Cl2(g)的反应热ΔH<0 C、H2(g) + Cl2(g) = 2HCl(g) ΔH=−183 kJ D、相同条件下,H2(g)+ Cl2(g) =2HCl(g)反应在光照和点燃条件下的ΔH不相等5. 下列依据热化学方程式得出的结论正确的是( )A、已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH=-57.3 kJ·mol-1 , 则含40.0 g NaOH的稀溶液与稀醋酸完全中和,放出的热量小于57.3 kJ B、已知2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ·mol-1 , 则氢气的燃烧热为241.8 kJ·mol-1 C、已知2C(s)+2O2(g)=2CO2(g) ΔH=a;2C(s)+O2(g)=2CO(g) ΔH=b,则a>b D、已知P4(白磷,s)=4P(红磷,s) ΔH<0,则白磷比红磷稳定6. 向Na2CO3溶液中滴加盐酸,反应过程中能量变化如下图所示,下列说法正确的是( )
A、生成1mol H2O时放出热量245 kJ B、H2O分解为H2与O2时放出热量 C、甲、乙、丙中物质所具有的总能量大小关系为甲>乙>丙 D、氢气和氧气的总能量小于水的能量4. 已知一定条件下断裂1 mol化学键生成气态原子需要吸收的能量如下:H—H 436 kJ;Cl—Cl 243 kJ;H—Cl 431 kJ。下列所得热化学方程式或结论正确的是( )A、氢分子中的化学键比氯气分子中的化学键更稳定 B、2HCl(g) = H2(g) + Cl2(g)的反应热ΔH<0 C、H2(g) + Cl2(g) = 2HCl(g) ΔH=−183 kJ D、相同条件下,H2(g)+ Cl2(g) =2HCl(g)反应在光照和点燃条件下的ΔH不相等5. 下列依据热化学方程式得出的结论正确的是( )A、已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH=-57.3 kJ·mol-1 , 则含40.0 g NaOH的稀溶液与稀醋酸完全中和,放出的热量小于57.3 kJ B、已知2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ·mol-1 , 则氢气的燃烧热为241.8 kJ·mol-1 C、已知2C(s)+2O2(g)=2CO2(g) ΔH=a;2C(s)+O2(g)=2CO(g) ΔH=b,则a>b D、已知P4(白磷,s)=4P(红磷,s) ΔH<0,则白磷比红磷稳定6. 向Na2CO3溶液中滴加盐酸,反应过程中能量变化如下图所示,下列说法正确的是( )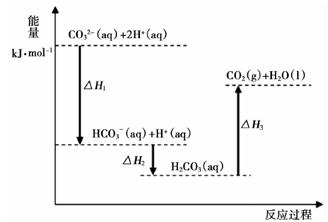 A、反应HCO3-(aq)+H+(aq)=CO2(g)+H2O(l)为放热反应 B、CO32-(aq)+2H+(aq)=CO2(g)+H2O(l) ΔH=(ΔH1+ΔH2+ΔH3) C、ΔH1>ΔH2 , ΔH2<ΔH3 D、H2CO3(aq)=CO2(g)+H2O(l),若使用催化剂,则ΔH3变小7. 已知热化学方程式:①CH4(g)+ 2O2(g) CO2(g)+2H2O(l) ΔH=-890.3 kJ/mol; ②N2(g)+O2(g) 2NO(g) ΔH=+180 kJ/mol。则CH4(g)+4NO(g) CO2(g)+2N2(g)+ 2H2O(l)的 ΔH为( )A、-1 250.3 kJ/mol B、-2 500.6 kJ/mol C、+1 250.3 kJ/mol D、+2 500.6 kJ/mol8. 已知在1×105 Pa、298 K条件下,2 mol氢气燃烧生成水蒸气放出484 kJ热量,下列热化学方程式正确的是( )A、H2O(g)= H2(g)+ O2(g) ΔH=242 kJ·mol-1 B、2H2(g)+O2(g)= 2H2O(l) ΔH=-484 kJ·mol-1 C、H2(g)+ O2(g)= H2O(g) ΔH=242 kJ·mol-1 D、2H2(g)+O2(g)= 2H2O(g) ΔH=484 kJ·mol-19. 已知化学反应①C(s)+ O2(g)=CO(g)△H=-Q1kJmol②2CO(g)+O2(g)=2CO2(g)△H=-Q2kJ/mol据此判断,下列说法正确的是(Q1、Q2均为正数,且其他条件相同)( )A、C的燃烧热为Q1kJ/mol B、2molCO(g)所具有的能量一定高于2molCO2(g)所具有的能量 C、一定质量的C燃烧,生成CO2(g)比生成CO(g)时放出的热量多 D、C燃烧生成CO2气体的热化学方程式为:C(s)+O2(g)=CO2(g)△H=-(Q1+Q2)kJ/mol10. 氧气(O2)和臭氧(O3)是氧元素的两种同素异形体,已知热化学方程式:则△H1、△H2、△H3的关系正确的是( )
A、反应HCO3-(aq)+H+(aq)=CO2(g)+H2O(l)为放热反应 B、CO32-(aq)+2H+(aq)=CO2(g)+H2O(l) ΔH=(ΔH1+ΔH2+ΔH3) C、ΔH1>ΔH2 , ΔH2<ΔH3 D、H2CO3(aq)=CO2(g)+H2O(l),若使用催化剂,则ΔH3变小7. 已知热化学方程式:①CH4(g)+ 2O2(g) CO2(g)+2H2O(l) ΔH=-890.3 kJ/mol; ②N2(g)+O2(g) 2NO(g) ΔH=+180 kJ/mol。则CH4(g)+4NO(g) CO2(g)+2N2(g)+ 2H2O(l)的 ΔH为( )A、-1 250.3 kJ/mol B、-2 500.6 kJ/mol C、+1 250.3 kJ/mol D、+2 500.6 kJ/mol8. 已知在1×105 Pa、298 K条件下,2 mol氢气燃烧生成水蒸气放出484 kJ热量,下列热化学方程式正确的是( )A、H2O(g)= H2(g)+ O2(g) ΔH=242 kJ·mol-1 B、2H2(g)+O2(g)= 2H2O(l) ΔH=-484 kJ·mol-1 C、H2(g)+ O2(g)= H2O(g) ΔH=242 kJ·mol-1 D、2H2(g)+O2(g)= 2H2O(g) ΔH=484 kJ·mol-19. 已知化学反应①C(s)+ O2(g)=CO(g)△H=-Q1kJmol②2CO(g)+O2(g)=2CO2(g)△H=-Q2kJ/mol据此判断,下列说法正确的是(Q1、Q2均为正数,且其他条件相同)( )A、C的燃烧热为Q1kJ/mol B、2molCO(g)所具有的能量一定高于2molCO2(g)所具有的能量 C、一定质量的C燃烧,生成CO2(g)比生成CO(g)时放出的热量多 D、C燃烧生成CO2气体的热化学方程式为:C(s)+O2(g)=CO2(g)△H=-(Q1+Q2)kJ/mol10. 氧气(O2)和臭氧(O3)是氧元素的两种同素异形体,已知热化学方程式:则△H1、△H2、△H3的关系正确的是( )4Al(s)+3O2(g)═2Al2O3(s)△H1①
4Al(s)+2O3(g)═2Al2O3(s)△H2②
3O2(g)═2O3(g)△H3③
A、△H1﹣△H2=△H3 B、△H1+△H2=△H3 C、△H2﹣△H1=△H3 D、△H1+△H2+△H3=011. 2mol金属钠和1mol氯气反应的能量关系如图所示,下列说法不正确的( )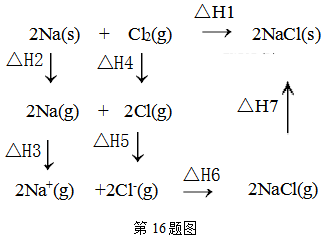 A、△H2+△H3+△H4+△H5+△H6+△H7=△H1 B、△H4的值数值上和Cl-Cl共价键的键能相等 C、△H5<0,在相同条件下,2Br(g)的△H5′<△H5 D、△H7<0,且该过程形成离子键
A、△H2+△H3+△H4+△H5+△H6+△H7=△H1 B、△H4的值数值上和Cl-Cl共价键的键能相等 C、△H5<0,在相同条件下,2Br(g)的△H5′<△H5 D、△H7<0,且该过程形成离子键二、综合题
-
12.(1)、已知:①CO燃烧热为283.0kJ·mol-1 , ②N2(g)+O2(g) =2NO(g) △H=+180.5kJ·mol-1 , 汽车尾气中的NO(g)和CO(g)在一定温度和催化剂条件下可发生反应,能消除污染,写出该反应的热化学方程式。
(2)、某温度下,等物质的量的碘和环戊烯( )在刚性容器内发生反应:
)在刚性容器内发生反应:  (g)+ I2(g)
(g)+ I2(g)  (g)+2HI(g) ΔH=+89.3 kJ·mol −1 , 起始总压为105Pa,平衡时总压增加了20%,环戊烯的转化率为 , 该反应的平衡常数Kp=Pa(用平衡分压代替平衡浓度,分压=总压×物质的量分数)。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有(填标号)。
(g)+2HI(g) ΔH=+89.3 kJ·mol −1 , 起始总压为105Pa,平衡时总压增加了20%,环戊烯的转化率为 , 该反应的平衡常数Kp=Pa(用平衡分压代替平衡浓度,分压=总压×物质的量分数)。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有(填标号)。 A.通入惰性气体 B.提高温度 C.增加环戊烯浓度 D.增加碘浓度
(3)、室温下,烟气中的SO2可用某浓度的NaOH溶液吸收得到pH=7的溶液,试计算所得溶液中
 =(已知:常温下H2SO3的电离平衡常数Ka1=1.0×10-2 , Ka2=6.0×10-8)。
=(已知:常温下H2SO3的电离平衡常数Ka1=1.0×10-2 , Ka2=6.0×10-8)。
(4)、烟气中的SO2也可用Na2SO3溶液吸收,吸收过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:n(SO32-):n(HSO3-)
99:1
1:1
1:99
pH
8.2
7.2
6.2
当吸收液呈中性时,溶液中离子浓度由小到大的顺序为。
13. 根据要求填空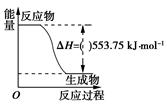 (1)、打火机、运动会中的火炬一般采用丙烷(C3H8)为燃料。丙烷热值较高,污染较小,是一种优良的燃料。已知一定量丙烷完全燃烧生成CO2和1mol H2O(l)过程中的能量变化如右图,请写出表示丙烷燃烧热的热化学方程式:。(2)、CO与H2反应还可制备CH3OH,CH3OH可作为燃料使用,用CH3OH和O2组合形成的质子交换膜燃料电池的结构示意图如下:
(1)、打火机、运动会中的火炬一般采用丙烷(C3H8)为燃料。丙烷热值较高,污染较小,是一种优良的燃料。已知一定量丙烷完全燃烧生成CO2和1mol H2O(l)过程中的能量变化如右图,请写出表示丙烷燃烧热的热化学方程式:。(2)、CO与H2反应还可制备CH3OH,CH3OH可作为燃料使用,用CH3OH和O2组合形成的质子交换膜燃料电池的结构示意图如下: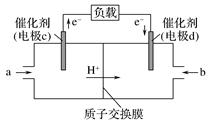
①电池总反应为2CH3OH+3O2=2CO2+4H2O,则c电极是(填“正极”或“负极”),c电极的反应方程式为。
②用该燃料电池电解1L饱和食盐水(足量),当燃料电池消耗0.56L(标准状况下)氧气时,溶液pH=(不考虑溶液体积变化)。
(3)、有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图所示,电池正极的电极反应式是 , 该反应能设计成原电池的原因是。A是(填物质名称)。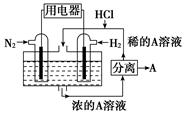 14.(1)、12g碳与适量水蒸气反应生成CO和H2 , 需吸收131.3KJ热量,此反应的热化学方程式为。(2)、已知以下的热化学反应方程式:
14.(1)、12g碳与适量水蒸气反应生成CO和H2 , 需吸收131.3KJ热量,此反应的热化学方程式为。(2)、已知以下的热化学反应方程式:①2CO(g)+O2(g)=2CO2(g) △H=-566kJ/mol
②2H2(g)+O2(g)=2H2O(g) △H=-484kJ/mol
③CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890kJ/mol
则:CH4(g)+CO2(g)=2CO(g)+2H2(g) △H=。
(3)、已知H2(g)+Br2(l)=2HBr(g) △H=-102kJ/mol,其他的相关数据如下表:H2(g)
Br2(l)
HBr(g)
1mol分子中的化学键断裂时需要吸收的能量/kJ
436
a
369
则表中a为。
15. 按要求书写下列热化学方程式。(1)、25℃、101 kPa时,1 g乙烯完全燃烧生成液态水时放出的热量是50 kJ.则表示乙烯燃烧热的热化学方程式是。
(2)、由氢气和氧气反应生成1mol水蒸气的过程中放热241.8kJ,写出该反应的热化学方程式 。若9g水蒸气转化成液态水时放热22kJ,则反应H2(g)+ O2(g)=H2O(1)的△H= kJ·mol-1。(3)、已知稀溶液中, 1 mol H2SO4与NaOH恰好完全反应时,放出114.6kJ热量,写出表示H2SO4与NaOH反应的中和热的热化学方程式: 。(4)、已知:①CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206kJ·mol-1②CO(g)+2H2(g)=CH3OH(g)△H=-129kJ·mol-1
写出由CH4和H2O(g)生成CH3OH和H2的热化学方程式 。
16. 一定条件下,NO与Cl2反应可牛成亚硝酸氯(ClNO),反应热化学方程式为2NO(g)+Cl2(g) 2ClNO(g) △H。回答下列问题:(1)、已知有如下反应:Ⅰ.4NO2(g)+2NaCl(s) 2NaNO3(s)+2NO(g)+Cl2(g) △H1
Ⅱ.2NO2(g)+NaCl(s)NaNO3(s)+ClNO(g) △H2
则△H=(用△H1、△H2表示)。
(2)、在2 L恒容密闭容器中充入4 mol NO(g)和2 mol Cl2(g).在不同温度下测得c(ClNO)与时间的关系如下图所示。
①反应开始到10 min时,Cl2的平均反应速率v(Cl2)=。
②温度为了T2时,该反应的平衡常数K=L·mol-1。
(3)、T℃时,2NO(g)+Cl2(g) 2ClNO(g)的正反应速率表达式为v正=kcn(ClNO),测得速率和浓度的关系如下表:序号
C(ClNO)/mol·L-1
vmol·L-1·s-1
①
0.30
3.6×10-8
②
0.60
1.44×10-7
③
0.90
3.24×10-7
n=;k=(注明单位)。
17. 测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示。 (1)、写出该反应的热化学方程式(中和热为57.3 kJ·mol-1):(2)、取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
(1)、写出该反应的热化学方程式(中和热为57.3 kJ·mol-1):(2)、取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。①请填写下表中的空白:
温度
实验次数
起始温度T1/℃
终止温度
T2/℃
温度差平
均值(T2
-T1)/℃
H2SO4
溶液
NaOH
溶液
平均值
1
26.2
26.0
26.1
30.1
2
27.0
27.4
27.2
33.3
3
25.9
25.9
25.9
29.8
4
26.4
26.2
26.3
30.4
②近似认为0.50 mol·L-1NaOH溶液和0.50 mol·L-1硫酸溶液的密度都是1 g·cm-3 , 中和后生成溶液的比热容c=4.18 J·g-1·℃-1。则中和热ΔH=(取小数点后一位)。
③上述实验数值结果与57.3 kJ·mol-1有偏差,产生偏差的原因可能是(填字母)。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
18. 甲醇是一种用途非常广泛的基础化工原料,可通过下列反应合成:Ⅰ.CO(g)+2H2(g) CH3OH(g)△H1
Ⅱ.CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H2
Ⅲ.CO(g)+H2O(g) CO2(g)+H2(g)△H3
回答下列问题
(1)、反应(Ⅰ)的△S(填“>”或“<”)0,△H1=(用△H2、△H3表示)。(2)、上述反应的平衡常数的自然对数值lnKP(KP为以分压表示的平衡常数)与温度的关系如图甲所示
①反应(Ⅱ)的△H(填“>”或“<”)0。
②480K时,lnKP(Ⅰ)+lnKp(Ⅱ)+lnKp(Ⅲ)=。
③某温度下,向某恒容密闭容器中充入0.1 molCO和0.2molH2发生反应(Ⅰ),达到平衡时,CO的转化率为90%,若平衡时总压强5MPa,则KP=(KP为以分压表示的平衡常数,分压=总压×物质的量分数)。
(3)、若用CO和CO2混合气体合成甲醇,起始时均控制 =2.60,CO的平衡转化率X(CO)与温度及压强的关系如图乙所示。下列说法正确的是 (填字母)。A、p1<p2<p3 B、升高温度,反应速率和X(CO)均减小 C、起始时若p2=7.2MPa,则H2的分压为5.2MPa D、其他条件不变,增大 ,X(CO)增大