备考2020年高考化学二轮专题 03 化学中的常用计量
试卷更新日期:2020-03-31 类型:二轮复习
一、单选题
-
1. 设NA为阿伏加德罗常数的数值,下列说法正确的是( )A、标准状况下,2.24L CCl4中含有的氯原子数目为0.4mol B、1mol甲基(-CH3)所含的电子数为9NA C、16.25g FeCl3水解形成的Fe(OH)3胶体粒子数为0.1NA D、2L 0.5mol·L-1碳酸钠溶液中CO32-数目为NA2. 2V L Fe2(SO4)3溶液中含有a g SO42- , 取此溶液V L,用水稀释至2V L,则稀释后溶液中Fe3+的物质的量浓度为( )
A、 mol·L-1 B、 mol·L-1 C、 mol·L-1 D、 mol·L-13. 下列各项比较中,一定相等的是( )A、相同物质的量浓度的 CH3COOH 和 CH3COONa 溶液中的 c(CH3COO-) B、相同质量的钠分别完全转化为 Na2O 和 Na2O2 时转移的电子数 C、相同物质的量的丙烷和 2-甲基丙烷中所含 C—H键的数目 D、标准状况下,相同体积的乙炔和苯中所含的H原子数4. 下列两种气体的分子数一定相等的是( )A、质量相等、密度不等的N2和C2H4 B、等压等体积的N2和CO2 C、等温等体积的O2和N2 D、不同体积等密度的CO和C2H45. 设NA为阿伏加德罗常数的值,下列说法不正确的是( )A、60g乙酸和丙醇混合物中含有的分子数目为NA B、0.1molCl2与足量NaOH反应,转移电子数为0.1NA C、4.8gMg在足量空气中充分燃烧,此过程中所转移的电子数为0.4NA D、0.1molCH4和0.1molCl2充分反应,生成C-Cl和H-Cl键数目和为0.1NA6. 在标准状况下,将VL气体A(摩尔质量为Mg/mol),溶于0.1L水中,所得溶液密度为dg/cm3 , 则该溶液的物质的量浓度为( )A、 mol/L B、 mol/L C、 mol/L D、 mol/L7. 下列溶液中c(Cl-)与50 mL 1 mol·L-1AlCl3溶液中c(Cl-)相等的是( )A、150 mL 1 mol·L-1的NaCl溶液 B、75 mL 2 mol·L-1的NH4Cl溶液 C、150 mL 2 mol·L-1的KCl溶液 D、75 mL mol·L-1的FeCl3溶液8. 下列叙述中正确的是( )①标准状况下,1LHCl和1LH2O的物质的量相同
②标准状况下,11.2LH2和14gN2所含原子数相同
③28gCO的体积约为22.4L
④两种物质的物质的量相同,则它们在标准状况下的体积相同
⑤同温同体积时,气体的物质的量越大,则压强越大
⑥同温同压下,气体的密度与气体的相对分子质量成正比
⑦标准状况下,1molH2O的质量为18g
A、仅⑤⑥⑦ B、仅②⑤⑥⑦ C、仅②③⑤⑥ D、仅①②④⑤⑥9. 某溶液经分析,其中只含有Na+、K+、Ca2+、Cl-、NO3- , 已知其中Na+、K+、Ca2+、NO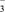 的浓度均为0.1 mol·L-1 , 则Cl-的物质的量浓度为( ) A、0.1mol·L-1 B、0.3mol·L-1 C、0.2mol·L-1 D、0.4mol·L-110. 用等体积的0.1mol/L的BaCl2 溶液,恰好可使相同体积的Fe2 (SO4 )3、 Na2SO4、 KAl(SO4)2 三种溶液中的SO42-完全沉淀,则三种硫酸盐的物质的量浓度之比为( )A、3:2:3 B、3:1:2 C、2:6:3 D、1:1:111. 标准状况下有①6.72L甲烷②3.01×1023个氯化氢分子③13.6 g硫化氢④0.2 mol NH3。下列对这四种气体的关系从小到大表示错误的是( )A、体积:④<①<②<③ B、密度:①<④<③<② C、质量:④<①<③<② D、氢原子数:②<④<③<①12. 已知:将Cl2通入适量KOH溶液,产物中可能有KCl、KClO、KClO3 , 且 的值与温度高低有关。当n (KOH)=a mol时,下列有关说法错误的是( )A、若某温度下,反应后 =11,则溶液中 = B、参加反应的氯气的物质的量等于 a mol C、改变温度,反应中转移电子的物质的量n的范围: a mol ≤ n(e -)≤ a mol D、改变温度,产物中KClO3的最大理论产量为 a mol13. 现有Ag某结晶水合物(R·xH2O)受热后失去全部结晶水,质量变为ag,则R相对原子质量是( )A、 B、 C、 D、14. 设NA为阿伏加德罗常数的值,下列说法错误的是( )A、常温常压下,1mol氦气含有的原子数为NA B、常温常压下,8g甲烷中含有的电子数为5NA C、46gNO2和N2O4混合气体中含有的原子数为3NA D、标准状况下,11.2L四氯化碳所含分子数 0.5NA
的浓度均为0.1 mol·L-1 , 则Cl-的物质的量浓度为( ) A、0.1mol·L-1 B、0.3mol·L-1 C、0.2mol·L-1 D、0.4mol·L-110. 用等体积的0.1mol/L的BaCl2 溶液,恰好可使相同体积的Fe2 (SO4 )3、 Na2SO4、 KAl(SO4)2 三种溶液中的SO42-完全沉淀,则三种硫酸盐的物质的量浓度之比为( )A、3:2:3 B、3:1:2 C、2:6:3 D、1:1:111. 标准状况下有①6.72L甲烷②3.01×1023个氯化氢分子③13.6 g硫化氢④0.2 mol NH3。下列对这四种气体的关系从小到大表示错误的是( )A、体积:④<①<②<③ B、密度:①<④<③<② C、质量:④<①<③<② D、氢原子数:②<④<③<①12. 已知:将Cl2通入适量KOH溶液,产物中可能有KCl、KClO、KClO3 , 且 的值与温度高低有关。当n (KOH)=a mol时,下列有关说法错误的是( )A、若某温度下,反应后 =11,则溶液中 = B、参加反应的氯气的物质的量等于 a mol C、改变温度,反应中转移电子的物质的量n的范围: a mol ≤ n(e -)≤ a mol D、改变温度,产物中KClO3的最大理论产量为 a mol13. 现有Ag某结晶水合物(R·xH2O)受热后失去全部结晶水,质量变为ag,则R相对原子质量是( )A、 B、 C、 D、14. 设NA为阿伏加德罗常数的值,下列说法错误的是( )A、常温常压下,1mol氦气含有的原子数为NA B、常温常压下,8g甲烷中含有的电子数为5NA C、46gNO2和N2O4混合气体中含有的原子数为3NA D、标准状况下,11.2L四氯化碳所含分子数 0.5NA二、填空题
-
15. 3.01×1023个OH﹣的物质的量为mol,含有电子的物质的量为mol,这些OH﹣和g Na+含有的电子数相同。16.(1)、一个铁原子的质量为m g, 设NA表示阿伏加德罗常数的值,则铁的摩尔质量为。(2)、标准状况下4.48LCO和CO2混合气,质量为7.2g。其中CO的体积分数为。
(3)、将饱和FeCl3溶液滴入沸水中,继续加热至液体变为色,得到的是Fe(OH)3胶体,区别Fe(OH)3胶体和饱和FeCl3溶液的方法是 , 将Fe(OH)3胶体装入U型管中,用石墨电极接通直流电,通电一段时间后,发现阴极区域附近的颜色加深,这说明 , 这种现象称为电泳。(4)、实验室将氯酸钾和二氧化锰固体混合物充分加热至不再产生气体,从所剩固体混合物中提取纯净的二氧化锰的操作依次为、、、。三、综合题
-
17. 请根据物质的量的相关公式,完成下列问题。(注意书写单位)(1)、3.01×1023个NH3分子的物质的量。
(2)、0.5molH2SO4含有的氧原子的物质的量。
(3)、2.3gNO2的物质的量。
(4)、标况下,33.6LN2的物质的量。(5)、0.5mol /LK2SO4溶液中,c(K+)=。
18.(1)、标准状况下,与5.6L的CH4气体含相同H原子数的硫化氢的质量为g。(2)、将2mol·L-1Al2(SO4)3和0.2mol·L-1H2SO4溶液等体积混合(设混合溶液体积等于两溶液体积之和),计算混合液中c(SO42-)= mol·L-1。若用容量瓶以质量分数为98%、密度为1.84g/cm3的浓硫酸,配制480mL浓度成0.2mol·L-1 稀硫酸,计算需要量取mL的浓硫酸。(3)、配平以下方程式K2Cr2O7+HCl=KCl+CrCl3+Cl2↑+H2O上述反应中物质氧化性:> , 每生成1molCl2时有个电子发生转移,氧化剂与还原剂的物质的量之比为 。
19.(1)、6.02×1023个NH3 分子的质量为g,标准状况下的体积为L,与gCH4中含有的氢原子数相等。(2)、将标准状况下2.24LHCl气体溶于水,得到100mL溶液,则:该溶液的浓度为。取出20mL该溶液,所取出该溶液中溶质的质量是g。20.(1)、常温常压下,用等质量的CH4、CO2、O2、SO2四种气体分别吹出四个气球,其中气体为SO2的是(填选项序号)。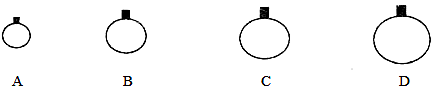 (2)、在标准状况下,2.24L由N2、N2O组成的混合气体中含有的氮元素的质量约为。(3)、在0.1L由KCl、K2SO4、ZnSO4形成的某植物营养液中,c(K+)=0.7mol•L﹣1 , c(Zn2+)=0.1mol•L﹣1 , c(Cl﹣)=0.3mol•L﹣1 , 向混合溶液中滴加足量的BaCl2溶液后产生沉淀的物质的量为。(4)、0.3mol的甲烷与g氨气中所含氢原子数相等。(5)、在同温同压下,2g二氧化碳的体积为120mL,而2gA气体的体积为165mL,则气体A的摩尔质量;(6)、标准状况下,11.2L二氧化碳和一氧化碳混合气体的质量为18g,则其中二氧化碳的质量为 , 一氧化碳的体积为。(7)、氯气(Cl2)、重铬酸钾(K2Cr2O7)是常用的氧化剂。
(2)、在标准状况下,2.24L由N2、N2O组成的混合气体中含有的氮元素的质量约为。(3)、在0.1L由KCl、K2SO4、ZnSO4形成的某植物营养液中,c(K+)=0.7mol•L﹣1 , c(Zn2+)=0.1mol•L﹣1 , c(Cl﹣)=0.3mol•L﹣1 , 向混合溶液中滴加足量的BaCl2溶液后产生沉淀的物质的量为。(4)、0.3mol的甲烷与g氨气中所含氢原子数相等。(5)、在同温同压下,2g二氧化碳的体积为120mL,而2gA气体的体积为165mL,则气体A的摩尔质量;(6)、标准状况下,11.2L二氧化碳和一氧化碳混合气体的质量为18g,则其中二氧化碳的质量为 , 一氧化碳的体积为。(7)、氯气(Cl2)、重铬酸钾(K2Cr2O7)是常用的氧化剂。①硫代硫酸钠(Na2S2O3)被称为“养鱼宝”,可降低水中的氯气对鱼的危害。已知25.0mL0.100mol•L﹣1 Na2S2O3溶液恰好把标准状况下224mL的Cl2完全转化为Cl﹣ , 则S2O32﹣将转化成。
A.S2﹣
B.S
C.SO32﹣
D.SO42﹣
②实验室可用K2Cr2O7固体与浓盐酸反应制备氯气,发生反应的化学方程式为K2Cr2O7+14HCl(浓)=3Cl2↑+2CrCl3+2KCl+7H2O,若反应中转移0.6mole﹣ , 则被氧化的HCl的物质的量为。