备考2020年高考化学二轮专题 02 氧化还原反应
试卷更新日期:2020-03-31 类型:二轮复习
一、单选题
-
1. 下列颜色变化与氧化还原反应无关的是 ( )A、湿润的红色布条遇氯气褪色 B、棕黄色 FeCl3 饱和溶液滴入沸水中变红褐色 C、紫色酸性 KMnO4 溶液通入乙烯气体后褪色 D、浅黄色 Na2O2 固体露置于空气中逐渐变为白色2. 下列反应中,硝酸只表现氧化性的是( )A、3FeO+10HNO3=3Fe(NO3)3+NO↑+5H2O B、C+4HNO3(浓) CO2↑+4NO2↑+2H2O C、Al(OH)3+3HNO3=Al(NO3)3+3H2O D、3Zn+8HNO3=3Zn(NO3)2+2NO↑+4H2O3. 根据下列反应判断有关物质还原性由强到弱的顺序是( )
① H2SO3+I2+H2O=2HI+H2SO4 ② 2FeCl3+2HI=2FeCl2+2HCl+I2
A、FeCl2 >HI >H2SO3 B、HI >FeCl2 >H2SO3 C、H2SO3> HI >FeCl2 D、FeCl2 >H2SO3>HI4. 从氧化还原角度分析,下列反应中水的作用相同的是( )①铁和水蒸气反应 ②过氧化钠和水反应 ③氯气和水反应 ④二氧化氮和水反应
A、①②③ B、①②④ C、②③④ D、①③④5. 常温下,发生下列反应:①16H++10Z﹣+2XO4﹣=2X2++5Z2+8H2O
②2A2++B2=2A3++2B﹣
③2B﹣+Z2=B2+2Z﹣根据上述反应,下列结论判断不正确的是( )
A、A3+是A2+的氧化产物 B、氧化性强弱的顺序为XO4﹣>B2 C、反应Z2+2A2+=2A3++2Z﹣在溶液中可发生 D、Z2在①③反应中均为还原剂6. 向Fe2+、I-、Br-的溶液中通入适量Cl2 , 溶液中各种离子的物质的量变化如图所示。下列有关说法正确的是( ) A、线段BC代表Cl-物质的量的变化情况 B、原混合溶液中c(FeBr2)=6mol·L-1 C、当通入2mol Cl2时,溶液中已发生的离子反应可表示为2Fe2++2I-+2Cl2=2Fe3++I2+4Cl- D、原溶液中n(Fe2+):n(I-):n(Br-)=2:2:37. 将足量Cl2通入FeBr2和NaBr的混合溶液中,反应总的离子方程式为:Fe2+ +3Br-+2Cl2 = Fe3+ +Br2 + 4Cl- , 则混合溶液中FeBr2和NaBr的物质的量的比为( )
A、线段BC代表Cl-物质的量的变化情况 B、原混合溶液中c(FeBr2)=6mol·L-1 C、当通入2mol Cl2时,溶液中已发生的离子反应可表示为2Fe2++2I-+2Cl2=2Fe3++I2+4Cl- D、原溶液中n(Fe2+):n(I-):n(Br-)=2:2:37. 将足量Cl2通入FeBr2和NaBr的混合溶液中,反应总的离子方程式为:Fe2+ +3Br-+2Cl2 = Fe3+ +Br2 + 4Cl- , 则混合溶液中FeBr2和NaBr的物质的量的比为( )
A、1:1 B、1:2 C、2:1 D、1:38. 下列变化必需加入还原剂才能实现的是( )A、KMnO4→MnO2 B、Cl2→NaCl C、FeCl3→FeCl2 D、CO→CO29. 氧化还原反应与基本反应类型的关系如图所示,则下列化学反应属于氧化还原反应但不包含在1,2,4范围内的是( ) A、Cl2+2KI=I2 +2KCl B、NH4HCO3=NH3↑+CO2↑+H2O↓ C、2FeCl2+Cl2=2FeCl3 D、3NO2+H2O=2HNO3 +NO10. 已知在酸性条件下有以下反应关系:①KBrO3能将KI氧化成I2或KIO3 , 本身被还原为Br2;②Br2能将I-氧化为I2;③KIO3能将I-氧化为I2 , 也能将Br-氧化为Br2 , 本身被还原为I2。向KI的硫酸溶液中滴加少量KBrO3溶液后,所得产物除水外还有( )A、Br2、Br-、I2 B、Br-、I2、IO3- C、Br-、IO3- D、Br-、I2
A、Cl2+2KI=I2 +2KCl B、NH4HCO3=NH3↑+CO2↑+H2O↓ C、2FeCl2+Cl2=2FeCl3 D、3NO2+H2O=2HNO3 +NO10. 已知在酸性条件下有以下反应关系:①KBrO3能将KI氧化成I2或KIO3 , 本身被还原为Br2;②Br2能将I-氧化为I2;③KIO3能将I-氧化为I2 , 也能将Br-氧化为Br2 , 本身被还原为I2。向KI的硫酸溶液中滴加少量KBrO3溶液后,所得产物除水外还有( )A、Br2、Br-、I2 B、Br-、I2、IO3- C、Br-、IO3- D、Br-、I2二、实验探究题
-
11.(1)、Ⅰ.我国的青海省有许多盐湖盛产食盐,人类与食盐关系密切,食盐在老百姓生活和现代社会的工农业生产中均有重要作用。粗盐中含Ca2+、Mg2+、SO42-以及泥沙等杂质,为了除去可溶性杂质,有以下实验步骤进行提纯:
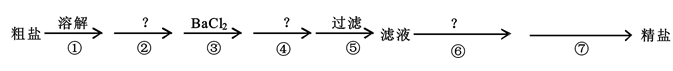
④步所加试剂是。
(2)、第⑥步发生反应的离子方程式为、。(3)、第⑦步的操作名称 , 需要的玻璃仪器有、。(4)、通过步骤⑤中过滤后的滤液,检验SO42-已除尽的操作方法是。(5)、Ⅱ.设阿伏加德罗常数为NA , 标准状况下,某O2和N2的混合气体m g含有b个分子,则n g该混合气体在相同状况下所占的体积是L。(6)、在xR2++yH++O2═mR3++nH2O的离子方程式中,对化学计量数m和R2+、R3+判断正确的是____。A、m=y,R3+是氧化产物 B、m=2y,R2+被氧化 C、m=2,R3+是氧化剂 D、m=4,R2+是还原剂(7)、用双线桥法标出下列反应的电子转移方向和数目。2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O三、综合题
-
12.(1)、请将5种物质:N2O、FeSO4、Fe(NO3)3、HNO3和Fe2(SO4)3分别填入下面对应的横线上,组成一个未配平的化学方程式。
+→+++H2O
(2)、反应物中发生氧化反应的物质 , 被还原的元素是。(3)、反应中1mol氧化剂(填“得到”或“失去”)mol电子。13.(1)、已知2P4+9KOH+3H2O═3K3PO4+5PH3反应中氧化剂是; 氧化剂与还原剂物质的量之比是;氧化产物是。(2)、请用双线桥法标出下列反应电子转移的方向和数目10Al+6NaNO3 +4NaOH═10NaAlO2 +3N2↑+2H2O(3)、Mn2+、Bi3+、BiO3﹣、MnO4﹣、H+、H2O组成的一个氧化还原系统中,发生BiO3﹣→Bi3+的反应过程,据此回答下列问题 ①该氧化还原反应中,被还原的元素是。②请将氧化剂、还原剂的化学式及配平后的方程式填入下列相应的位置中,并用单线桥法标出电子转移的方向和数目。
14. 市场销售的某种食用精制盐包装袋上有如下说明:产品标准
GB5461
产品等级
一级
配料
食盐、碘酸钾、抗结剂
碘含量(以1计)
20~50mg/kg
分装时期
分装企业
(1)、碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式(将化学计量数填于空白处)KlO3+KI+H2SO4=K2SO4+I2+H2O
(2)、上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。①Na2SO3稀溶液与I2反应的离子方程式是 。
②某学生设计回收四氯化碳的操作步骤为:
a.将碘的四氯化碳溶液置于分液漏斗中;
b.加入适量Na2SO3稀溶液;
c.分离出下层液体。
以上设计中遗漏的操作及在上述步骤中的位置是。
(3)、已知:I2+2S2O32-=2I-+S4O62-。某学生测定食用精制盐的碘含量,其步骤为:a.准确称取wg食盐,加适量蒸馏水使其完全溶解
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol·L-1的Na2S2O3溶液10.0mL,恰好反应完全。
①判断c中反应恰好完全依据的现象是。
②b中反应所产生的I2的物质的量是mol。
③根据以上实验和包装袋说明,所测精制盐的碘含量是(以含w的代数式表示)mg/kg。
15. 储氢纳米碳管的成功研制体现了科技的进步。用电弧法合成的碳纳米管常伴有大量的杂质—碳纳米颗粒。这种碳纳米颗粒可用氧化气化法提纯。其反应中的反应物和生成物有C、CO2、H2SO4、K2Cr2O7、K2SO4、Cr2(SO4)3和H2O七种。(1)、请用上述物质填空,并配平化学方程式:C++ H2SO4——++Cr2(SO4)3+H2O
(2)、上述反应中氧化剂是(填化学式),被氧化的元素是(填元素符号)。(3)、H2SO4在上述反应中表现出来的性质是(填选项序号) 。A、氧化性 B、氧化性和酸性 C、酸性 D、还原性和酸性(4)、若反应中电子转移了0.8mol,则产生的气体在标准状况下的体积为。16. 居民饮用水的质量必须符合国家标准,以下是源水处理成自来水的工艺流程示意图。看图后回答下列问题。 (1)、源水中含Ca2+、Mg2+、HCO3-、Cl- 等,加入过量石灰后生成Ca(OH)2 , 进而发生若干复分解反应,例如:HCO3-+OH-=CO32-+H2O 请写出另一个属于复分解反应的离子方程式。(2)、凝聚剂除去悬浮固体颗粒的过程
(1)、源水中含Ca2+、Mg2+、HCO3-、Cl- 等,加入过量石灰后生成Ca(OH)2 , 进而发生若干复分解反应,例如:HCO3-+OH-=CO32-+H2O 请写出另一个属于复分解反应的离子方程式。(2)、凝聚剂除去悬浮固体颗粒的过程①只是物理过程 ②只是化学过程 ③是物理和化学过程
FeSO4·7H2O是常用的凝聚剂,其在水中电离出的Fe2+离子被溶解在水中的O2所氧化为Fe3+ , 最终生成胶状沉淀,这种胶状沉淀是(写化学式)。
(3)、配平下列反应方程式,并标出电子转移方向和数目。Fe2++ O2 + H+= Fe3++ H2O
上述反应中,每转移8mol电子,标准状况下消耗O2的体积为L。
(4)、通入二氧化碳的目的是和。(5)、Cl2的作用是。(6)、Cl2是常用的强氧化剂,请你尝试写出一个合理的Cl2作为氧化剂的化学方程式。。
-