黑龙江省大庆市杜尔伯特县2019年中考化学二模考试试卷
试卷更新日期:2020-03-30 类型:中考模拟
一、单选题
-
1. 下列变化属于物理变化的是( )A、白磷自然 B、胆矾研碎 C、面包发霉 D、钢铁生锈2. 在一密闭容器中加入a、b、c、d四种物质,测得反应前后各物质的质量如下表。
物质
a
b
c
d
反应前的质量/g
40
40
10
32
反应后的质量/g
12
x
10
0
下列说法正确的是( )
A、x等于90 B、b可能是单质 C、c一定是催化剂 D、参加反应的a与d的质量比为7:83. 下列常见的生活物品中,所含的主要原料属于天然纤维的是( )A、纯棉衣服 B、不锈钢刀 C、橡胶轮胎 D、塑料花盆4. α-丙氨酸是合成蛋白质的基础物质之一,其分子结构如右图所示。下列有关该物质的说法不正确的是( ) A、从分类角度看:α-丙氨酸属于有机物 B、从量的角度看:在α-丙氨酸中碳、氢、氧、氮各元素的原子个数比为3:7:2:1 C、从变化角度看:α-丙氨酸全燃烧后的产物是二氧化碳和水 D、从微观角度看:α-丙氨酸是由分子构成5. 下列实验操作正确的是( )A、
A、从分类角度看:α-丙氨酸属于有机物 B、从量的角度看:在α-丙氨酸中碳、氢、氧、氮各元素的原子个数比为3:7:2:1 C、从变化角度看:α-丙氨酸全燃烧后的产物是二氧化碳和水 D、从微观角度看:α-丙氨酸是由分子构成5. 下列实验操作正确的是( )A、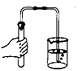 检查装置气密性
B、
检查装置气密性
B、 熄灭酒精灯
C、
熄灭酒精灯
C、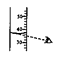 量取液体
D、
量取液体
D、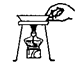 移走蒸发皿
6. 向AgNO3、Cu(NO3)2、Mg(NO3)2的混合溶液中,加入一定量的铁粉,充分反应后过滤,滤液呈蓝色。下列判断正确的是( )A、滤液中可能有Fe(NO3)2、Mg(NO3)2和Cu(NO3)2 B、向滤渣中加入稀盐酸,可能有气泡产生 C、与原溶液相比,滤液的质量可能增大 D、向滤液中滴入稀盐酸,可能会有白色沉淀出现7. 下列实验现象描述正确的是( )A、硫在氧气中燃烧发出淡蓝色火焰 B、磷在空气中燃烧产生大量白烟 C、木炭在空气中燃烧发出白光 D、铁丝在氧气中燃烧,火星四射,生成四氧化三铁8. 下列关于资源利用的说法或做法不正确的是( )A、大量开采地下水,以缓解淡水危机 B、氢能源没有污染,应大力推广使用 C、开发利用太阳能、风能等新能源 D、综合利用煤和石油等化石燃料9. 在FeO、Fe2O3和CaCO3的混合物中,已知铁元素的质量分数为56%,则CaCO3的质量分数可能是:( )A、10% B、30% C、25% D、35%10. 用实际参加化学反应的离子符号来表示化学反应的式子叫离子方程式,在离子方程式中,反应前后的电荷是守恒的,原子个数也是守恒的。现有如下离子方程式:RO3n﹣+F2+2OH﹣=RO4﹣+2F﹣+H2O,由此可知在RO3n﹣中,元素R的化合价是( )A、+4 B、+5 C、+6 D、+7
移走蒸发皿
6. 向AgNO3、Cu(NO3)2、Mg(NO3)2的混合溶液中,加入一定量的铁粉,充分反应后过滤,滤液呈蓝色。下列判断正确的是( )A、滤液中可能有Fe(NO3)2、Mg(NO3)2和Cu(NO3)2 B、向滤渣中加入稀盐酸,可能有气泡产生 C、与原溶液相比,滤液的质量可能增大 D、向滤液中滴入稀盐酸,可能会有白色沉淀出现7. 下列实验现象描述正确的是( )A、硫在氧气中燃烧发出淡蓝色火焰 B、磷在空气中燃烧产生大量白烟 C、木炭在空气中燃烧发出白光 D、铁丝在氧气中燃烧,火星四射,生成四氧化三铁8. 下列关于资源利用的说法或做法不正确的是( )A、大量开采地下水,以缓解淡水危机 B、氢能源没有污染,应大力推广使用 C、开发利用太阳能、风能等新能源 D、综合利用煤和石油等化石燃料9. 在FeO、Fe2O3和CaCO3的混合物中,已知铁元素的质量分数为56%,则CaCO3的质量分数可能是:( )A、10% B、30% C、25% D、35%10. 用实际参加化学反应的离子符号来表示化学反应的式子叫离子方程式,在离子方程式中,反应前后的电荷是守恒的,原子个数也是守恒的。现有如下离子方程式:RO3n﹣+F2+2OH﹣=RO4﹣+2F﹣+H2O,由此可知在RO3n﹣中,元素R的化合价是( )A、+4 B、+5 C、+6 D、+7二、填空题
-
11. 用相应的化学用语表示:沼气的主要成分:;5核10电子的阳离子:。12. 溴原子结构示意图如图所示。请回答下列问题:
 (1)、图中x的值为。(2)、溴元素的化学性质与下图中(填字母标号)的化学性质相似。A,B,C,D属于种元素。
(1)、图中x的值为。(2)、溴元素的化学性质与下图中(填字母标号)的化学性质相似。A,B,C,D属于种元素。 (3)、第117号元素在元素周期表中的部分信息如图所示,它与溴元素属同族元素,化学性质与溴元素相似,则第117号元素原子最外层有个电子,原子中有个质子。
(3)、第117号元素在元素周期表中的部分信息如图所示,它与溴元素属同族元素,化学性质与溴元素相似,则第117号元素原子最外层有个电子,原子中有个质子。 (4)、依据Fe+CuSO4=FeSO4+Cu,推断出Fe的金属活动性比Cu强,非金属也有类似规律,据此推断,在2KI+Cl2=2KCl+I2反应中,Cl2的“非金属活动性”比I2的(填“强”或“弱”)。
(4)、依据Fe+CuSO4=FeSO4+Cu,推断出Fe的金属活动性比Cu强,非金属也有类似规律,据此推断,在2KI+Cl2=2KCl+I2反应中,Cl2的“非金属活动性”比I2的(填“强”或“弱”)。三、简答题
-
13. 用化学方程式表示:常用稀盐酸除去铁制品表面的锈的原因是:;胃酸过多的病人可以服用小苏打缓解的原因是:。14. 化学兴趣小组的同学在探究分子的特征时设计了如图所示的实验,请你参与他们的探究活动,回答有关问题:烧杯A中盛有10mL浓氨水;在烧杯B、C中分别盛有20mL蒸馏水,并分别滴加3滴酚酞试液于蒸馏水中,得到无色溶液。用只大烧杯把A、B两烧杯罩在一起,几分钟后,观察现象。
 (1)、实验中观察到的现象是。请你用分子的知识解释出现该现象的原因。(2)、由该实验可知氨水具有的性质是:。(3)、实验中烧杯C的作用是。(4)、该装置有一个明显的不足之处是 , 你的改进建议是。15. 硫酸锂(Li2SO4)和硝酸钾在不同温度时的溶解度如下表:
(1)、实验中观察到的现象是。请你用分子的知识解释出现该现象的原因。(2)、由该实验可知氨水具有的性质是:。(3)、实验中烧杯C的作用是。(4)、该装置有一个明显的不足之处是 , 你的改进建议是。15. 硫酸锂(Li2SO4)和硝酸钾在不同温度时的溶解度如下表:温度/℃
0
10
20
30
40
溶解
度/g
Li2SO4
36.1
35.4
34.8
34.3
33.9
KNO3
13.3
20.9
31.6
45.8
63.9
请回答下列问题:
 (1)、依据溶解度表,绘制溶解度曲线如图所示,其中能表示Li2SO4溶解度曲线的是(填“甲”或“乙”)。(2)、Li2SO4和KNO3在某一温度时具有相同的溶解度x , 则x的范围是。(3)、40℃时,有含少量Li2SO4的KNO3饱和溶液,欲从中提纯KNO3晶体,方法是。(4)、将10℃时两种物质的饱和溶液分别升温至30℃,所得Li2SO4溶液中溶质的质量分数(填“>”、“<”或“=”)KNO3溶液中溶质的质量分数。(5)、如图所示,20℃时,将盛有饱和Li2SO4溶液的试管放入盛水的烧杯中,向烧杯的水中加入某物质后,试管内有晶体析出。则加入的物质可以是(填字母序号)。
(1)、依据溶解度表,绘制溶解度曲线如图所示,其中能表示Li2SO4溶解度曲线的是(填“甲”或“乙”)。(2)、Li2SO4和KNO3在某一温度时具有相同的溶解度x , 则x的范围是。(3)、40℃时,有含少量Li2SO4的KNO3饱和溶液,欲从中提纯KNO3晶体,方法是。(4)、将10℃时两种物质的饱和溶液分别升温至30℃,所得Li2SO4溶液中溶质的质量分数(填“>”、“<”或“=”)KNO3溶液中溶质的质量分数。(5)、如图所示,20℃时,将盛有饱和Li2SO4溶液的试管放入盛水的烧杯中,向烧杯的水中加入某物质后,试管内有晶体析出。则加入的物质可以是(填字母序号)。
①浓硫酸 ②冰块 ③生石灰固体 ④硝酸铵固体 ⑤氢氧化钠固体
A②④ B①③⑤ C③④ D①②⑤
四、流程题
-
16. 氢氧化镁是一种重要的化工原料,某矿石由MgO、Fe2O3、CuO和SiO2组成。用它制备氢氧化镁的流程示意图如下:

部分金属阳离子以氢氧化物形成沉淀时溶液的pH见下表:
沉淀物
Fe(OH)3
Cu(OH)2
Mg(OH)2
开始沉淀
1.9
4.2
9.1
完全沉淀
3.2
6.7
11.1
(1)、熟石灰主要成分的化学式是;(2)、溶液A中的阳离子是 (填离子符号);(3)、沉淀C的成分是;(4)、溶液B与熟石灰反应的化学方程式是 。五、科学探究题
-
17. 超市出现了一种含“污渍爆炸盐”的新产品(如图),能清除衣服上难以清洗的汗渍、果汁渍。它的特殊的名称让小明对它产生了探究的兴趣。
 (1)、小明在超市的区域购买了此产品。(2)、阅读产品标签:“污渍爆炸盐”是一种衣物助洗剂,主要成分是过碳酸钠,能在瞬间去除洗衣液难以除去的多种顽固污渍,本产品不伤衣物,无磷是它的一大优点。含磷洗涤剂对环境的危害是。(3)、查阅资料:过碳酸钠(Na2CO4)是白色结晶颗粒,溶于水会产生碳酸盐和其它化合物。
(1)、小明在超市的区域购买了此产品。(2)、阅读产品标签:“污渍爆炸盐”是一种衣物助洗剂,主要成分是过碳酸钠,能在瞬间去除洗衣液难以除去的多种顽固污渍,本产品不伤衣物,无磷是它的一大优点。含磷洗涤剂对环境的危害是。(3)、查阅资料:过碳酸钠(Na2CO4)是白色结晶颗粒,溶于水会产生碳酸盐和其它化合物。合理猜想其它化合物为:i.NaOH;ii.H2O2;iii.NaOH和H2O2;小明做出以上猜想的理论依据是
(4)、实验设计:探究“污渍爆炸盐”水溶液的成分,完成下列表格。实验步骤
实验现象
实验结论
步骤 1:取少量“污渍爆炸盐”于烧杯中,加入足量蒸馏水,充分搅拌。
固体完全溶解,形成无色溶液
/
步骤 2:取少量步骤1 形成的溶液于试管中,再加入 , 振荡,静置。
白色沉淀
含有 Na2CO3
步骤 3:取少量步骤 2 试管中的上层清液于另一支试管中,再滴加少量MgCl2 溶液,振荡。
无明显现象
步骤 4:另取一支试管,加入少量步骤 1 形成的溶液,再加入 , 将带火星木条伸入试管中。
含有 H2O2
(5)、实验结论:猜想正确。写出过碳酸钠与水反应的化学方程式:。六、综合题
-
18. 过氧化钙(CaO2)为白色或淡黄色结晶粉末,是一种用途广泛的优良供氧剂,可用于鱼类养殖、农作物载培、污水处理等多方面。工业上可用大理石作原料制备过氧化钙,某校课外活动小组同学模拟工业过程制备过氧化钙样品并测量其纯度。
[查阅资料]①过氧化钙固体难溶于水,加热至315℃时开始分解,完全分解的温度为400~425℃。
②常温下过氧化钙干燥且很稳定。过氧化钙能溶于稀酸生成过氧化氢,过氧化钙在湿空气或水中会逐渐缓慢地分解,长时间放出氧气。
[实验一]提纯碳酸钙

已知:“转化”步骤中的反应方程式为:CaCl2+NH3+CO2+H2O=CaCO3↓+2NH4Cl
(1)、酸溶过程中发生反应的化学方程式是。(2)、过程中的生成物可直接应用于流程的是。(3)、[实验二]过氧化钙的制备:已知:①CaCl2+H2O2+2NH3•H2O+6H2O=CaO2•8H2O+2NH4Cl;
②CaO2•8H2O不溶于水,在0℃时稳定,加热至130℃时逐渐变为无水CaO2。

为控制沉淀的温度为0℃左右,在实验室宜采取的方法为。
(4)、操作A在实验室常用的步骤有、降温结晶、过滤、洗涤、干燥,此操作中洗涤晶体时不可选用的洗涤剂为(用序号填空)。a 冰水 b 40℃热水 c 饱和NH4Cl溶液
(5)、最后烘干得到过氧化钙时,适宜的温度范围为。(6)、已知产品的产率= ×100%,则此制备流程中CaO2的产率为。(写出计算过程,结果保留一位小数)。(7)、实验室现有溶质质量分数为37%、密度是1.18g•mL﹣1的浓盐酸,则配制12%的稀盐酸100g,需要水mL(水的密度是1g•mL﹣1 , 计算结果保留一位小数)。(8)、[实验三]过氧化钙含量的测定该活动小组设计下列装置,通过测定生成O2的体积,计算样品中CaO2的质量分数。

已知:a.CaO2+2HCl=CaCl2+H2O2 b.杂质不与盐酸反应生成气体
实验中MnO2的作用是。
(9)、相同条件下,能使测定结果更准确(填“装置A”或“装置B”),检查该装置气密性的操作是。另一套装置测定结果不准确的主要原因是。(10)、[观察生活]为防止过氧化钙在空气中变质,应保存。
七、计算题
-
19. 将硫酸钠和氯化钠的固体混合物35克放入烧杯中,加入161.6克水后,固体混合物完全溶解,取此溶液一半,加入75克氯化钡溶液恰好完全反应,生成沉淀23.3克.计算:(1)、原固体混合物中硫酸钠的质量分数(精确到0.1%).(2)、反应后所得溶液中溶质的质量分数.(3)、往上述反应后所得溶液中再加50克水后,溶液中溶质质量分数是多少?
-
-
-