安徽省合肥市2020年高三化学一模试卷
试卷更新日期:2020-03-27 类型:高考模拟
一、(每小题3分,共42分。每小题只有一个选项符合题意)
-
1. 化学与人类社会生产、生活有着密切联系。下列叙述中正确的是( )A、“青蒿一握,以水二升渍,绞取汁”,该过程属于化学变化 B、高温或日常用的消毒剂可使禽流感病毒蛋白质变性 C、苹果放在空气中久置变黄和纸张久置变黄原理相似 D、燃煤中加入CaO主要是为了减少温室气体的排放2. 设NA为阿伏加德罗常数的值,下列说法不正确的是( )A、标准状况下,11.2L三氯甲烷中含有分子数为0.5NA B、常温常压下,2gD2O中含有电子数为NA C、46gNO2和N2O4混合气体中含有原子数为3NA D、1 mol Na完全与O2反应生成Na2O和Na2O2 , 转移电子数为NA3. 香叶醇是合成玫瑰香油的主要原料,其结构简式如下。下列有关香叶醇的叙述正确的是( )
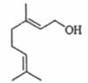 A、分子式为C10H18O B、分子中所有碳原子不可能共平面 C、既属于醇类又属于烯烃 D、能发生加成反应,不能发生氧化反应4. 在指定条件下,下列各组离子一定能大量共存的是( )A、滴加甲基橙试剂显红色的溶液中:Na+、Fe2+、Cl-、NO3- B、滴入KSCN显血红色的溶液中:NH4+、Al3+、NO3-、SO42- C、c(OH-)/c(H+)=1012的溶液中:NH4+、K+、Cl-、HCO3- D、由水电离的c(H+)=1.0×10-13 mol·L-1溶液中:K+、Al3+、SO42-、CH3COO-5. 下列离子方程式表达正确的是( )A、向FeCl3溶液中滴加HI溶液:2Fe3++ 2HI = 2Fe2++ 2H++ I2 B、向(NH4)2SO4溶液中滴加Ba(OH)2溶液:NH4++SO42-+Ba2++OH-=NH3·H2O+BaSO4↓ C、Ca(OH)2溶液与少量NaHCO3溶液混合:Ca2++2OH-+2HCO3-=CaCO3↓+2H2O+CO32- D、3 mol·L-1 Na2CO3溶液和1 mol·L-1 Al2(SO4)3溶液等体积混合: 2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑6. 利用下列实验装置及药品,能实现相应实验目的的是( )
A、分子式为C10H18O B、分子中所有碳原子不可能共平面 C、既属于醇类又属于烯烃 D、能发生加成反应,不能发生氧化反应4. 在指定条件下,下列各组离子一定能大量共存的是( )A、滴加甲基橙试剂显红色的溶液中:Na+、Fe2+、Cl-、NO3- B、滴入KSCN显血红色的溶液中:NH4+、Al3+、NO3-、SO42- C、c(OH-)/c(H+)=1012的溶液中:NH4+、K+、Cl-、HCO3- D、由水电离的c(H+)=1.0×10-13 mol·L-1溶液中:K+、Al3+、SO42-、CH3COO-5. 下列离子方程式表达正确的是( )A、向FeCl3溶液中滴加HI溶液:2Fe3++ 2HI = 2Fe2++ 2H++ I2 B、向(NH4)2SO4溶液中滴加Ba(OH)2溶液:NH4++SO42-+Ba2++OH-=NH3·H2O+BaSO4↓ C、Ca(OH)2溶液与少量NaHCO3溶液混合:Ca2++2OH-+2HCO3-=CaCO3↓+2H2O+CO32- D、3 mol·L-1 Na2CO3溶液和1 mol·L-1 Al2(SO4)3溶液等体积混合: 2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑6. 利用下列实验装置及药品,能实现相应实验目的的是( ) A、用图1所示装置除去HCl中含有的少量Cl2 B、用图2所示装置制备胆矾 C、用图3所示装置可以完成“喷泉”实验 D、用图4所示装置制取纯净的NH37. 混合物M中可能含有Al2O3、Fe2O3、Al、Cu,为确定其组成,某同学设计如图所示分析方案。下列分析正确的是( )
A、用图1所示装置除去HCl中含有的少量Cl2 B、用图2所示装置制备胆矾 C、用图3所示装置可以完成“喷泉”实验 D、用图4所示装置制取纯净的NH37. 混合物M中可能含有Al2O3、Fe2O3、Al、Cu,为确定其组成,某同学设计如图所示分析方案。下列分析正确的是( ) A、已知m1>m2 , 则混合物M中一定含有Al2O3 B、生成蓝绿色溶液的离子方程式为Cu+Fe3+=Cu2++Fe2+ C、固体P既可能是纯净物,又可能是混合物 D、要确定混合物M中是否含有Al,可取M加入过量NaOH溶液8. X、Y、Z三种元素的常见单质在适当条件下可发生如下图所示的变化,其中a为双原子分子,b和c均为10电子分子,b在常温下为液体。下列说法不正确的是( )
A、已知m1>m2 , 则混合物M中一定含有Al2O3 B、生成蓝绿色溶液的离子方程式为Cu+Fe3+=Cu2++Fe2+ C、固体P既可能是纯净物,又可能是混合物 D、要确定混合物M中是否含有Al,可取M加入过量NaOH溶液8. X、Y、Z三种元素的常见单质在适当条件下可发生如下图所示的变化,其中a为双原子分子,b和c均为10电子分子,b在常温下为液体。下列说法不正确的是( )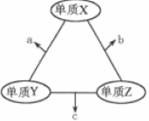 A、单质Y为N2 B、a不能溶于b中 C、a和c不可能反应 D、b比c稳定9. 下列实验中,对应的现象以及结论都正确且两者具有因果关系的是( )
A、单质Y为N2 B、a不能溶于b中 C、a和c不可能反应 D、b比c稳定9. 下列实验中,对应的现象以及结论都正确且两者具有因果关系的是( )选项 实验 现象 结论 A 将稀硝酸加入过量铁粉中,充分反应后滴加KSCN溶液 有气体生成,溶液呈血红色 硝酸将Fe2+氧化为Fe3+ B 将铜粉加入1.0mol/LFe2(SO4)3溶液中 溶液变蓝,有黑色固体出现 金属铁比铜活泼 C 用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热 熔化后的液态铝滴落下来 金属铝的熔点较低 D 将0.1mol/LMgSO4溶液滴入NaOH溶液至不再有沉淀产生,再滴加0.1mol/LCuSO4溶液 先有白色沉淀生成,后变为浅蓝色沉淀 Cu(OH)2的溶度积比Mg(OH)2的小 A、A B、B C、C D、D10. 反应X+Y→Z(△H>0)分两步进行:①X+Y→W(△H<0),②W→Z(△H>0)。下列示意图中,能正确表示总反应过程中能量变化的是( )A、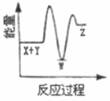 B、
B、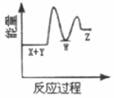 C、
C、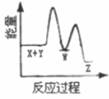 D、
D、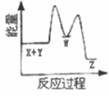 11. LiAlH4和LiH既是金属储氢材料又是有机合成中的常用试剂。它们遇水均能剧烈反应释放出H2 , LiAlH4在125℃时分解为LiH、H2和Al。下列说法不正确的是( )A、LiAlH4中AlH4-的结构式可表示为:
11. LiAlH4和LiH既是金属储氢材料又是有机合成中的常用试剂。它们遇水均能剧烈反应释放出H2 , LiAlH4在125℃时分解为LiH、H2和Al。下列说法不正确的是( )A、LiAlH4中AlH4-的结构式可表示为: B、1 mol LiAlH4在125℃完全分解,转移3 mol电子
C、LiAlH4与乙醛作用生成乙醇,LiAlH4作氧化剂
D、LiAlH4溶于适量水得到无色溶液,其反应可表示为:LiAlH4+2H2O=LiAlO2+4H2↑
12. 含氯苯的废水可通过加入适量乙酸钠,设计成微生物电池将氯苯转化为苯而除去,其原理如图所示。下列叙述正确的是( )
B、1 mol LiAlH4在125℃完全分解,转移3 mol电子
C、LiAlH4与乙醛作用生成乙醇,LiAlH4作氧化剂
D、LiAlH4溶于适量水得到无色溶液,其反应可表示为:LiAlH4+2H2O=LiAlO2+4H2↑
12. 含氯苯的废水可通过加入适量乙酸钠,设计成微生物电池将氯苯转化为苯而除去,其原理如图所示。下列叙述正确的是( )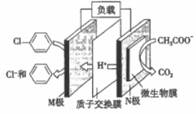 A、电子流向:N极→导线→M极→溶液→N极 B、M极的电极反应式为C6H5Cl+e-=C6H6+Cl- C、每生成1mol CO2 , 有3 mol e-发生转移 D、处理后的废水酸性增强13. 已知:25℃时,Ka(HA)>Ka(HB)。该温度下,用0.100 mol·L-1盐酸分别滴定浓度均为0.100 mol·L-1的NaA溶液和NaB溶液,混合溶液的pH与所加盐酸体积(V)的关系如图所示。下列说法正确的是( )
A、电子流向:N极→导线→M极→溶液→N极 B、M极的电极反应式为C6H5Cl+e-=C6H6+Cl- C、每生成1mol CO2 , 有3 mol e-发生转移 D、处理后的废水酸性增强13. 已知:25℃时,Ka(HA)>Ka(HB)。该温度下,用0.100 mol·L-1盐酸分别滴定浓度均为0.100 mol·L-1的NaA溶液和NaB溶液,混合溶液的pH与所加盐酸体积(V)的关系如图所示。下列说法正确的是( ) A、滴定前NaA溶液与NaB溶液的体积相同 B、25℃时,Ka(HA)的数量级为10-11 C、当pH均为6时,两溶液中水的电离程度相同 D、P点对应的两溶液中c(A-)+c(HA)<c(B-)+c(HB)14. 某磁黄铁矿的主要成分是FexS(S为-2价),既含有Fe2+又含有Fe3+。将一定量的该磁黄铁矿与100 mL的盐酸恰好完全反应(注:矿石中其他成分不与盐酸反应),生成2.4g硫单质、0.425 mol FeCl2和一定量H2S气体,且溶液中无Fe3+。则下列说法不正确的是( )A、该盐酸的物质的量浓度为8.5 mol·L-1 B、生成的H2S气体在标准状况下的体积为9.52L C、该磁黄铁矿FexS中,x=0.85 D、该磁黄铁矿FexS中,Fe2+的物质的量为0.15 mol
A、滴定前NaA溶液与NaB溶液的体积相同 B、25℃时,Ka(HA)的数量级为10-11 C、当pH均为6时,两溶液中水的电离程度相同 D、P点对应的两溶液中c(A-)+c(HA)<c(B-)+c(HB)14. 某磁黄铁矿的主要成分是FexS(S为-2价),既含有Fe2+又含有Fe3+。将一定量的该磁黄铁矿与100 mL的盐酸恰好完全反应(注:矿石中其他成分不与盐酸反应),生成2.4g硫单质、0.425 mol FeCl2和一定量H2S气体,且溶液中无Fe3+。则下列说法不正确的是( )A、该盐酸的物质的量浓度为8.5 mol·L-1 B、生成的H2S气体在标准状况下的体积为9.52L C、该磁黄铁矿FexS中,x=0.85 D、该磁黄铁矿FexS中,Fe2+的物质的量为0.15 mol二、(包括5小题,共58分)
-
15. W、X、Y、Z四种元素均为短周期元素,原子序数依次增大,其它相关信息见下表。

根据上述信息,回答下列问题:
(1)、元素Y在元素周期表中的位置是;Y和Z的简单离子半径比较,较大的是(用离子符号表示)。(2)、XY2由固态变为气态所需克服的微粒间作用力是;由元素W和Y组成的一种绿色氧化剂的电子式为。(3)、由W、X、Y、Z四种元素组成的一种无机盐,水溶液呈碱性的原因是 (用离子方程式表示)。16. 丙烯是重要的有机化工原料,它与各有机物之间的转化关系如下:
回答下列问题:
(1)、E中官能团的名称为;C的结构简式为。(2)、由A生成D的反应类型为;B的同分异构体数目有种(不考虑立体异构)。(3)、写出D与F反应的化学方程式:。17. PCl3是磷的常见氯化物,可用于半导体生产的外延、扩散工序。有关物质的部分性质如下:熔点/℃ 沸点/℃ 密度/g·mL-1 化学性质 黄磷 44.1 280.5 1.82 2P+3Cl2 (少量)2PCl3
2P+5Cl2 (过量)2PCl5PCl3 -112 75.5 1.574 遇水生成H3PO4和HCl,遇氧气生成POCl3 (1)、I.PCl3的制备如图是实验室制备PCl3的装置(部分仪器已省略)。

回答下列问题:
仪器乙的名称是;与自来水进水管连接的接口编号是 (填“a”或“b”)。
(2)、实验前需先向仪器甲中通入一段时间CO2 , 然后加热,再通入干燥Cl2。干燥管中碱石灰的作用主要是:①;②。(3)、实验室制备Cl2的离子方程式为;实验过程中,通入氯气的速率不宜过快的原因是。(4)、II.测定PCl3的纯度测定产品中PCl3纯度的方法如下:迅速称取4.100g产品,水解完全后配成500 mL溶液,取出25.00 mL加入过量0.1000 mol·L-1 20.00 mL碘溶液,充分反应后再用0.1000 mol·L-1 Na2S2O3溶液滴定过量的碘,终点时消耗12.00 mL Na2S2O3溶液。
已知:H3PO3+H2O+I2=H3PO4+2HI,I2+2Na2S2O3=2NAI+Na2S4O6 , 假设测定过程中没有其它反应。
根据上述数据,该产品中PCl3的质量分数为;若滴定终点时仰视读数,则PCl3的质量分数(填“偏大”、“偏小”或“无影响”)。
(5)、III.PCl3水解生成的H3PO3性质探究请你设计一个实验方案,证明H3PO3为二元酸:。
18. 某科研小组采用如下方案对废旧光盘金属层中的少量Ag进行回收(金属层中其它金属含量过低,对实验的影响可忽略)。
已知:①NaClO溶液在受热或酸性条件下易分解;
②常温时N2H4·H2O(水合肼)能还原Ag(NH3)2+:
4Ag(NH3)2++N2H4·H2O=4Ag↓+N2↑+4NH4++4NH3↑+H2O
回答下列问题:
(1)、“氧化”阶段需在80℃条件下进行,控制在该温度下反应的原因是。(2)、NaClO溶液与Ag反应生成白色沉淀和无色气体,该反应的化学方程式为;从反应产物的角度分析,以HNO3代替NaClO的缺点是。(3)、“滤液”中可循环的物质是;为提高Ag的回收率,需对“过滤II”的滤渣进行洗涤,并。(4)、已知溶液中银离子易与氨水中氨分子结合生成Ag(NH3)2+ , 请写出“溶解”过程中反应的离子方程式:;常温下,其反应的平衡常数K=。已知:常温下,
AgCl(s) Ag+(aq)+Cl-(aq) Ksp=1.8×10-10
Ag(NH3)2+(aq) Ag+(aq)+2NH3(aq) Kd=6.0×10-8
(5)、从“过滤II”后的滤液中获取单质Ag的过程中,在加入2 mol·L-1水合肼溶液后,后续还需选用下列试剂有(填序号);反应完全后获取纯净的单质银,还需再进行的实验操作方法主要有。①1 mol·L-1 H2SO4 ②10%氨水 ③1 mol·L-1 NaOH溶液
19. 氮的化合物是重要的工业原料,也是主要的大气污染来源,研究氮的化合物的反应具有重要意义。回答下列问题:(1)、肼(N2H4)与四氧化二氮分别是火箭发射器中最常用的燃料与氧化剂。已知3.2g液态肼与足量液态四氧化二氮完全反应,生成氮气和液态水放出热量61.25kJ,则该反应的热化学方程式为。(2)、尾气中的NO2可以用烧碱溶液吸收的方法来处理,其中能生成NaNO2等物质,该反应的离子方程式为。(3)、在773K时,分别将2.00 mol N2和6.00 mol H2充入一个固定容积为1 L的密闭容器中发生反应生成NH3 , 气体混合物中c(N2)、c(H2)、c(NH3)与反应时间(t)的关系如下图所示。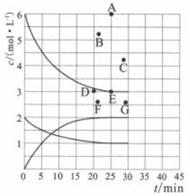
①下列能说明反应达到平衡状态的是(选填字母)。
a.v正(N2)=3v逆(H2) b.体系压强不变
c.气体平均相对分子质量不变 d.气体密度不变
②在此温度下,若起始充入4.00 mol N2和12.00 mol H2 , 则反应刚达到平衡时,表示c(H2)~t的曲线上相应的点为(选填字母)。
(4)、在373K时,向体积为2L的恒容真空容器中充入0.40 mol NO2 , 发生如下反应:2NO2 N2O4(g) △H=-56.9 kJ·mol-1
测得NO2的体积分数[φ(NO2)]与反应时间(t)的关系如下表:

①计算0~20min时,v(N2O4)=。
②已知该反应v正(NO2)=k1·c2(NO2),v逆(N2O4)=k2·c(N2O4),其中k1、k2为速率常数,则373K时, ;改变温度至T1时,k1=k2 , 则T1373K(填“>”“<”或“=”)。