天津市五校联考2016-2017学年高二上学期化学期末考试试卷
试卷更新日期:2017-08-28 类型:期末考试
一、选择题
-
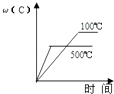
1. 化学与生活、社会密切相关,下列说法不正确的是( )A、煤、石油、天然气属于化石能源,太阳能、氢能、风能、地热能、海洋能属于新能源 B、白铁(镀锌铁板)比马口铁(镀锡铁板)更耐腐蚀 C、为防止电池中的重金属等污染土壤和水体,应采取深度填埋法 D、测试和调控溶液的pH对工农业生产、科学研究及日常生活和医疗保健都有重要意义2. 将浓度为0.1mol•L﹣1HF溶液加水不断稀释,下列各量始终保持增大的是( )A、c(H+) B、Ka(HF) C、 D、3. 某温度下,相同pH的硫酸和硫酸铝溶液中由水电离出的c(H+)分别是1.0×10﹣10mol/L和1.0×10﹣3 mol/L,则此温度下水的离子积Kw为( )A、1.0×10﹣15 B、1.0×10﹣14 C、1.0×10﹣13 D、1.0×10﹣74. 对于可逆反应:2A(g)+B(g)⇌2C(g)△H<0,下列各图中正确的是( )A、
 B、
B、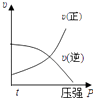 C、
C、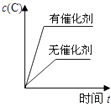 D、
D、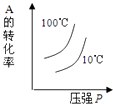 5. 恒温、恒压下,1molA和1molB在一个容积可变的容器中发生如下反应:A(g)+2B(g)⇌2C(g).一段时间后达到平衡,生成amolC,下列说法不正确的是( )A、物质A,B的转化率之比一定是1:2 B、当气体的密度不再变化时,可断定反应达到平衡 C、若起始放入3molA和3molB,则达平衡时生成3amolC D、当v正(A)=v逆(C)时,可断定反应达到平衡6. 今有室温下四种溶液,有关叙述不正确的是( )
5. 恒温、恒压下,1molA和1molB在一个容积可变的容器中发生如下反应:A(g)+2B(g)⇌2C(g).一段时间后达到平衡,生成amolC,下列说法不正确的是( )A、物质A,B的转化率之比一定是1:2 B、当气体的密度不再变化时,可断定反应达到平衡 C、若起始放入3molA和3molB,则达平衡时生成3amolC D、当v正(A)=v逆(C)时,可断定反应达到平衡6. 今有室温下四种溶液,有关叙述不正确的是( )序号
①
②
③
④
pH
11
11
3
3
溶液
氨水
氢氧化钠溶液
醋酸
盐酸
A、③④中分别加入适量的醋酸钠晶体后,两溶液的pH均增大 B、②③两溶液等体积混合,所得溶液中c(H+)>c(OH﹣) C、分别加水稀释10倍,四种溶液的pH①>②>④>③ D、V1L④与V2L①溶液混合后,若混合后溶液pH=7,则V1<V27. 下列有关描述中正确的是( )A、牺牲阳极的阴极保护法是应用电解原理防止金属的腐蚀 B、AlCl3溶液和Al2(SO4)3溶液分别加热蒸发,所得固体的成分相同 C、室温时将Na2CO3溶液加水稀释后,再恢复至室温,pH和KW均减小 D、CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g)反应的△H=+2×283.0kJ/mol8. 工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g)⇌Si(s)+4HCl(g)△H=+QkJ/mol(Q>0)某温度、压强下,将一定量反应物通入密闭容器进行上述反应,下列叙述正确的是( )A、反应过程中,若增大压强能提高SiCl4的转化率 B、若反应开始时SiCl4为1 mol,则达平衡时,吸收热量为Q kJ C、反应至4 min时,若HCl浓度为0.12 mol/L,则H2的反应速率为0.03 mol/(L•min) D、反应吸收0.025Q kJ热量时,生成的HCl通入100 mL 1 mol/L的NaOH溶液中恰好完全反应9. 有关如图原电池的说法正确的是( ) A、盐桥的作用是让电子通过,以构成闭合回路 B、总反应为:2H++Zn═H2+Zn2+且△H<0 C、随着反应进行,右烧杯中溶液pH变小 D、随着反应进行,左烧杯溶液中的SO42﹣向右烧杯迁移10. 在一定条件下,Na2CO3溶液中存在如下反应:CO +H2O═HCO +OH﹣下列说法中正确的是( )A、溶液中加水, 增大 B、加入Na2CO3固体, 减小 C、升高温度,平衡常数减小 D、通入CO2 , 溶液pH增大11. 25℃时,0.1mol/L下列溶液的pH如表,有关比较正确的是( )
A、盐桥的作用是让电子通过,以构成闭合回路 B、总反应为:2H++Zn═H2+Zn2+且△H<0 C、随着反应进行,右烧杯中溶液pH变小 D、随着反应进行,左烧杯溶液中的SO42﹣向右烧杯迁移10. 在一定条件下,Na2CO3溶液中存在如下反应:CO +H2O═HCO +OH﹣下列说法中正确的是( )A、溶液中加水, 增大 B、加入Na2CO3固体, 减小 C、升高温度,平衡常数减小 D、通入CO2 , 溶液pH增大11. 25℃时,0.1mol/L下列溶液的pH如表,有关比较正确的是( )序号
①
②
③
④
⑤
溶液
NaCl
CH3COONH4
NaClO
NaHCO3
Na2CO3
pH
7.0
7.0
10.3
8.3
11.6
A、酸性的相对强弱:HClO<HCO3﹣ B、由水电离产生的c(H+):①=② C、溶液③④中酸根离子浓度:c(ClO﹣)>c(HCO3﹣) D、在④⑤溶液等体积混合后的溶液中:c(HCO3﹣)+c(CO32﹣)+c(H2CO3)=0.1 mol/L12. 向密闭容器中,按n(CO):n(H2)=1:2充入反应物,发生反应:CO(g)+2H2(g)⇌CH3OH(g)△H<0.L(L1、L2)、X可分别代表压强或温度,如图表示L一定时,平衡混合物中CH3OH的体积分数随X的变化关系.下列说法中,正确的是( ) A、X代表压强 B、L1<L2 C、平衡常数:K(A)=K(B) D、在C点时,CO转化率为75%13. 等物质的量浓度、等体积的下列溶液中:①H2CO3 ②Na2CO3 ③NaHCO3 ④NH4HCO3 ⑤(NH4)2CO3 . 下列关系或者说法正确的是( )A、c(CO32﹣)的大小关系为:②>⑤>③>④>① B、c(HCO3﹣)的大小关系为:④>③>⑤>②>① C、将溶液蒸干后灼烧后只有①不能得到对应的固体物质 D、②③④⑤既能与盐酸反应,又能与NaOH溶液反应14. 铝阳极氧化处理后形成的氧化膜比铝的天然氧化膜耐磨性、耐腐蚀性及装饰性有明显的提高,工业中以铝为阳极,置于硫酸溶液中电解,装置如图,下列说法正确的是( )
A、X代表压强 B、L1<L2 C、平衡常数:K(A)=K(B) D、在C点时,CO转化率为75%13. 等物质的量浓度、等体积的下列溶液中:①H2CO3 ②Na2CO3 ③NaHCO3 ④NH4HCO3 ⑤(NH4)2CO3 . 下列关系或者说法正确的是( )A、c(CO32﹣)的大小关系为:②>⑤>③>④>① B、c(HCO3﹣)的大小关系为:④>③>⑤>②>① C、将溶液蒸干后灼烧后只有①不能得到对应的固体物质 D、②③④⑤既能与盐酸反应,又能与NaOH溶液反应14. 铝阳极氧化处理后形成的氧化膜比铝的天然氧化膜耐磨性、耐腐蚀性及装饰性有明显的提高,工业中以铝为阳极,置于硫酸溶液中电解,装置如图,下列说法正确的是( ) A、阳极电极方程式为Al﹣3e+6OH﹣=Al2O3+3H2O B、随着电解的进行,溶液的pH逐渐增大 C、当阴极生成气体3.36L(标况)时,阳极增重2.4g D、电解过程中H+移向Al电极15. 如图,a、b是两根碳棒.以下叙述正确的是( )
A、阳极电极方程式为Al﹣3e+6OH﹣=Al2O3+3H2O B、随着电解的进行,溶液的pH逐渐增大 C、当阴极生成气体3.36L(标况)时,阳极增重2.4g D、电解过程中H+移向Al电极15. 如图,a、b是两根碳棒.以下叙述正确的是( ) A、a是阴极,发生还原反应 B、b是负极,发生氧化反应 C、滴加酚酞试液,b极附近溶液颜色变红 D、铜片上的电极反应式是:Cu2++2e→Cu
A、a是阴极,发生还原反应 B、b是负极,发生氧化反应 C、滴加酚酞试液,b极附近溶液颜色变红 D、铜片上的电极反应式是:Cu2++2e→Cu二、选择题
-
16. 室温下,将1mol的CuSO4•5H2O(s)溶于水会使溶液温度降低,热效应为△H1 , 将1mol的CuSO4溶于水会使溶液温度升高,热效应为△H2;CuSO4•5H2O(s)受热分解的化学方程式为CuSO4•5H2O(s) CuSO4(s)+5H2O(l),热效应为△H3 . 则下列判断正确的是( )A、△H2>△H3 B、△H1<△H3 C、△H1+△H3=△H2 D、△H1+△H2>△H317. 下列溶液中各微粒的浓度关系正确的是( )A、物质的量浓度相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液中c(NH4+):(NH4)2SO4>NH4HSO4>NH4Cl B、向醋酸钠中加适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO﹣)>c(H+)>c(OH﹣) C、1.0mol/L Na2CO3溶液:c(OH﹣)=2c(HCO3﹣)+c(H+)+c(H2CO3) D、某二元弱酸的酸式盐NaHA溶液中:c(H+)+c(Na+)=c(OH﹣)+c(HA﹣)+c(A2﹣)18. 已知25℃时,Mg(OH)2的溶度积常数Ksp=5.6×10﹣12 , MgF2的溶度积常数Ksp=7.4×10﹣11 . 下列说法正确的是( )A、25℃时,向饱和MgF2溶液中加入饱和NaOH溶液后,不可能有Mg(OH)2生成 B、25℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者c(Mg2+)大 C、25℃时,Mg(OH)2固体在同体积同浓度的氨水和NH4Cl溶液中的Ksp相比较,前者小 D、25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大19. 全钒液流电池是一种新型的绿色环保储能电池,其电池总反应为:V3++VO2++H2O VO2++2H++V2+ . 下列说法正确的是( )A、放电时正极反应为:VO2++2H++e﹣=VO2++H2O B、放电时每转移2mol电子时,消耗1mol氧化剂 C、充电过程中电子由阳极经导线移向阴极,再由阴极经电解质溶液移向阳极 D、放电过程中,H+由正极移向负极20. 某原电池装置如图所示,电池总反应为2Ag+Cl2=2AgCl.下列说法正确的是( )
 A、正极反应为AgCl+e﹣=Ag+Cl﹣ B、放电时,交换膜左侧溶液中有大量白色沉淀生成 C、若用NaCl溶液代替盐酸,则电池总反应随之改变 D、当电路中转移0.01mole﹣时,交换膜左侧溶液中约减少0.01mol离子
A、正极反应为AgCl+e﹣=Ag+Cl﹣ B、放电时,交换膜左侧溶液中有大量白色沉淀生成 C、若用NaCl溶液代替盐酸,则电池总反应随之改变 D、当电路中转移0.01mole﹣时,交换膜左侧溶液中约减少0.01mol离子三、非选择题
-
21. 根据要求回答问题:(1)、已知在常温常压下:
①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=﹣1275.6kJ•mol﹣1
②H2O(l)═H2O(g)△H=+44.0kJ•mol﹣1
写出表示甲醇燃烧热的热化学方程式 .
(2)、肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如图所示.已知断裂1mol化学键所需的能量(kJ):N≡N为942、O=O为500、N﹣N为154,则断裂1mol N﹣H键所需的能量(kJ)是 . 22. 合成气的主要成分是一氧化碳和氢气,可用于合成二甲醚等清洁燃料.从天然气获得合成气过程中可能发生的反应有:
22. 合成气的主要成分是一氧化碳和氢气,可用于合成二甲醚等清洁燃料.从天然气获得合成气过程中可能发生的反应有:①CH4(g)+H2O(g)⇌CO(g)+3H2(g)△H1=206.1kJ•mol﹣1
②CH4(g)+CO2(g)⇌2CO(g)+2H2(g)△H2=247.3kJ•mol﹣1
③CO(g)+H2O(g)⇌CO2(g)+H2(g)△H3
请回答下列问题:
(1)、在一密闭容器中进行反应①,测得CH4的物质的量浓度随反应时间的变化如图1所示.反应进行的前5min内,v(H2)=;10min时,改变的外界条件可能是 . (2)、如图2所示,在甲、乙两容器中分别充入等物质的量的CH4和CO2 , 使甲、乙两容器初始容积相等.在相同温度下发生反应②,并维持反应过程中温度不变.
(2)、如图2所示,在甲、乙两容器中分别充入等物质的量的CH4和CO2 , 使甲、乙两容器初始容积相等.在相同温度下发生反应②,并维持反应过程中温度不变.①可以判断甲容器中反应已达平衡状态的是 .
a.生成CH4的速率是生成CO的速率的2倍
b.容器内压强保持不变
c.容器内气体的密度保持不变
d.容器内各气体的浓度保持不变
②甲乙两容器中反应达到平衡时,下列说法正确的是 .
a.化学反应速率:v (甲)>v (乙)
b.甲烷的转化率:α(甲)<α(乙)
c.压强:P(甲)=P (乙)
(3)、反应③中△H3= kJ•mol﹣1.800℃时,反应③的化学平衡常数K=1.0,某时刻测得该温度下的密闭容器中各物质的物质的量见如表:CO
H2O
CO2
H2
0.5mol
8.5mol
2.0mol
2.0mol
此时反应③中正、逆反应速率的关系是(填代号).
a.v(正)>v (逆) b.v(正)<v(逆) c.v(正)=v(逆) d.无法判断.
23. 电解原理和原电池原理是电化学的两个重要内容.某兴趣小组做如下探究实验: (1)、如图1为某实验小组依据氧化还原反应设计的原电池装置,该反应的离子方程式为 . 反应前,电极质量相等,一段时间后,两电极质量相差12g,导线中通过mol电子.(2)、其他条件不变,若将CuCl2溶液换为NH4Cl溶液,石墨电极反应式 , 这是由于NH4Cl溶液显(填“酸性”“碱性”或“中性”),用离子方程式表示溶液显此性的原因 .(3)、如图2,其他条件不变,若将盐桥换成弯铜导线与石墨相连成n型,则乙装置中石墨为极(填正、负、阴、阳),乙装置中与铜线相连的石墨(2)电极上发生的反应式为 .(4)、在图2乙装置中改为加入400mL CuSO4溶液,一段时间后,若电极质量增重 1.28g,则此时溶液的pH为 .24. 实验室利用废弃旧电池的铜帽(Zn、Cu总含量约为99%)回收铜并制备ZnO的部分实验过程如图:
(1)、如图1为某实验小组依据氧化还原反应设计的原电池装置,该反应的离子方程式为 . 反应前,电极质量相等,一段时间后,两电极质量相差12g,导线中通过mol电子.(2)、其他条件不变,若将CuCl2溶液换为NH4Cl溶液,石墨电极反应式 , 这是由于NH4Cl溶液显(填“酸性”“碱性”或“中性”),用离子方程式表示溶液显此性的原因 .(3)、如图2,其他条件不变,若将盐桥换成弯铜导线与石墨相连成n型,则乙装置中石墨为极(填正、负、阴、阳),乙装置中与铜线相连的石墨(2)电极上发生的反应式为 .(4)、在图2乙装置中改为加入400mL CuSO4溶液,一段时间后,若电极质量增重 1.28g,则此时溶液的pH为 .24. 实验室利用废弃旧电池的铜帽(Zn、Cu总含量约为99%)回收铜并制备ZnO的部分实验过程如图: (1)、①写出铜帽溶解过程中铜发生反应的化学方程式 .
(1)、①写出铜帽溶解过程中铜发生反应的化学方程式 .②铜帽溶解后需将溶液中过量H2O2除去.除去H2O2的简便方法是 .
(2)、为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)的量,实验中需测定除去H2O2后溶液中Cu2+的含量.实验操作为:准确量取一定体积的含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节pH至3~4,加入过量KI,用Na2S2O3标准溶液滴定至终点.上述过程中的离子方程式如下:2Cu2++4I﹣=2CuI(白色)↓+I2 I2+2S2O32﹣=2I﹣+S4O62﹣
①滴定选用的指示剂为 , 滴定终点观察到的现象为 .
②若滴定前溶液中H2O2没有除尽,所测得的Cu2+的含量将会(填“偏高”、“偏低”、“不变”).
(3)、已知pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2﹣ . 下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L﹣1计算)Fe3+
Fe2+
Zn2+
开始沉淀的pH
1.1
5.8
5.9
完全沉淀的pH
3.2
8.8
8.9
实验中可选用的试剂:30% H2O2、1.0mol•L﹣1HNO3、1.0mol•L﹣1 NaOH.
由回收铜后的滤液制备ZnO的实验步骤依次为:
①向滤液中加入略过量 , 使其充分反应
②向反应后的溶液中滴加1.0moL•L﹣1的NaOH溶液,调节溶液的pH范围为;
③过滤;
④向滤液中滴加1.0moL•L﹣1的氢氧化钠,调节pH范围为;
⑤过滤、洗涤、干燥
⑥900℃煅烧.
25. 将0.2mol•L﹣1HA溶液与0.1mol•L﹣1NaOH溶液等体积混合,测得混合溶液中c(Na+)>c(A﹣),则(用“>”、“<”或“=”填写下列空白):(1)、混合溶液中c(A﹣)c(HA).(2)、混合溶液中c(HA)+c(A﹣)0.1mol•L﹣1 .(3)、混合溶液中由水电离出的c(OH﹣)0.2mol•L﹣1HA溶液中由水电离出的c(H+).(4)、25℃时,如果取0.2mol•L﹣1HA溶液与0.1mol•L﹣1NaOH溶液等体积混合,测得混合溶液的pH<7,则HA的电离程度NaA的水解程度.(5)、浓度均为0.1mol•L﹣1的①H2S、②NaHS、③Na2S、④H2S和NaHS混合液,溶液pH从大到小的顺序是 . (用序号表示)26. 二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂.目前已开发出用电解法制取ClO2的新工艺. (1)、①如图装置用石墨作电极,在一定条件下电解饱和食盐水制取ClO2 . 写出阳极产生ClO2的电极反应式: .
(1)、①如图装置用石墨作电极,在一定条件下电解饱和食盐水制取ClO2 . 写出阳极产生ClO2的电极反应式: .②电解一段时间,当阴极产生的气体体积为112mL(标准状况)时,停止电解.通过阳离子交换膜的阳离子的物质的量为mol.
(2)、为提高甲醇燃料的利用率,科学家发明了一种燃料电池,电池的一个电极通入空气,另一个电极通入甲醇气体,电解质是掺入了Y2O3的ZrO2晶体,在高温下它能传导O2﹣离子.电池工作时正极反应为 .(3)、若以该电池为电源,用石墨做电极电解100mL含有如下离子的溶液.离子
Cu2+
H+
Cl﹣
SO42﹣
c/mol•L﹣1
1
4
4
1
电解一段时间后,当两极收集到相同体积(相同条件)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象)阳极上收集到氧气的物质的量为mol.