天津市和平区2016-2017学年高二上学期化学期末考试试卷
试卷更新日期:2017-08-28 类型:期末考试
一、选择题
-
1. 已知醋酸达到电离平衡后,改变某条件电离平衡向正反应方向移动,则下列说法正确的是( )A、实现该变化的只能是升高温度 B、溶液的导电能力一定变强 C、溶液的pH一定减小 D、发生电离的分子总数增多2. 关于原电池和电解池的叙述正确的是( )A、原电池中失去电子的电极为阴极 B、原电池的负极、电解池的阳极都发生氧化反应 C、原电池的两极一定是由活动性不同的两种金属组成 D、电解时电解池的阴极一定是阴离子放电3. 下列金属防腐的措施中,使用外加电流的阴极保护法的是( )A、水中的钢闸门连接电源的负极 B、金属护拦表面涂漆 C、汽车底盘喷涂高分子膜 D、地下钢管连接镁块4. 下列有关沉淀溶解平衡的说法中,正确的是( )A、在AgCl的沉淀溶解平衡体系中,加入蒸馏水,Ksp(AgCl)增大 B、在CaCO3的沉淀溶解平衡体系中,加入稀盐酸,平衡不移动 C、可直接根据Ksp的数值大小比较难溶物在水中的溶解度大小 D、25℃时,KSP(AgCl)>KSP(AgI),向AgCl的悬浊液中加入KI固体,有黄色沉淀生成5. 下列叙述正确的是( )A、用湿润的pH试纸测溶液的pH一定会有误差 B、用标准盐酸溶液滴定未知浓度的NaOH溶液时,用待测溶液润洗锥形瓶 C、用酸式滴定管量取酸性高锰酸钾溶液5.10mL D、用标准盐酸溶液滴定未知浓度NaOH溶液的过程中不慎将锥形瓶中的溶液溅出,会使测得的NaOH溶液的浓度偏大6. 25℃时,水的电离达到平衡:H2O⇌H++OH﹣△H>0,下列叙述正确的是( )A、向水中加入氨水,平衡逆向移动,c(OH﹣)降低 B、向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变 C、向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低 D、将水加热,KW增大,pH不变7. 铜锌原电池(如图)工作时,以下说法正确的是( )
①电子流动方向从Zn﹣灯泡﹣Cu﹣盐桥;②Zn电极的质量减轻Cu电极的质量增重;③盐桥中的K+移向CuSO4溶液;④将锌片浸入硫酸铜溶液发生的化学反应与该电池反应相同为:Zn+Cu2+═Zn2++Cu;⑤Zn电极失电子发生还原反应.
 A、①②③ B、②④⑤ C、②③④ D、③④⑤8. 将CO2转化为甲醇的原理为 CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H<0.500℃时,在体积为1L 的固定容积的密闭容器中充入1mol CO2、3mol H2 , 测得CO2浓度与CH3OH 浓度随时间的变化如图所示,从中得出的结论错误的是( )
A、①②③ B、②④⑤ C、②③④ D、③④⑤8. 将CO2转化为甲醇的原理为 CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H<0.500℃时,在体积为1L 的固定容积的密闭容器中充入1mol CO2、3mol H2 , 测得CO2浓度与CH3OH 浓度随时间的变化如图所示,从中得出的结论错误的是( ) A、曲线X可以表示CH3OH(g) 或H2O(g) 的浓度变化 B、从反应开始到10min时,H2的反应速率v(H2)=0.225mol/(L﹒min) C、平衡时H2 的转化率为75% D、500℃时该反应的平衡常数K=39. 常温下有体积相同的四种溶液:①pH=3的CH3COOH溶液 ②pH=3的盐酸 ③pH=11的氨水 ④pH=11的NaOH溶液.下列说法正确的是( )A、若将四种溶液稀释100倍,溶液pH大小顺序:③>④>①>② B、③和④分别用等浓度的硫酸溶液中和,消耗硫酸溶液的体积:③=④ C、①与②分别与足量镁粉反应,生成H2的量:①<② D、②和③混合,所得混合溶液的pH大于710. 已知:100℃的温度下,水的离子积Kw=1×10﹣12 . 下列说法正确的是( )A、0.05mol/L 的 H2SO4溶液 pH=1 B、0.001mol/L 的 NaOH溶液 pH=11 C、0.005mol/L的H2SO4溶液与0.01mol/LNaOH溶液等体积浪合,混合液pH=6,溶液呈酸性 D、完全中和pH=3的H2SO4溶液50mL,需要pH=11的NaOH溶液50mL11. 在一定条件下,Na2CO3溶液存在水解平衡:CO32﹣+H2O⇌HCO3﹣+OH﹣ . 下列说法正确的是( )A、稀释溶液,水解平衡常数增大 B、通入CO2 , 平衡朝正反应方向移动 C、升高温度, 减小 D、加入NaOH固体,溶液pH减小12. 用惰性电极电解下列溶液,其中随着电解的进行,溶液pH值逐渐减小的是( )
A、曲线X可以表示CH3OH(g) 或H2O(g) 的浓度变化 B、从反应开始到10min时,H2的反应速率v(H2)=0.225mol/(L﹒min) C、平衡时H2 的转化率为75% D、500℃时该反应的平衡常数K=39. 常温下有体积相同的四种溶液:①pH=3的CH3COOH溶液 ②pH=3的盐酸 ③pH=11的氨水 ④pH=11的NaOH溶液.下列说法正确的是( )A、若将四种溶液稀释100倍,溶液pH大小顺序:③>④>①>② B、③和④分别用等浓度的硫酸溶液中和,消耗硫酸溶液的体积:③=④ C、①与②分别与足量镁粉反应,生成H2的量:①<② D、②和③混合,所得混合溶液的pH大于710. 已知:100℃的温度下,水的离子积Kw=1×10﹣12 . 下列说法正确的是( )A、0.05mol/L 的 H2SO4溶液 pH=1 B、0.001mol/L 的 NaOH溶液 pH=11 C、0.005mol/L的H2SO4溶液与0.01mol/LNaOH溶液等体积浪合,混合液pH=6,溶液呈酸性 D、完全中和pH=3的H2SO4溶液50mL,需要pH=11的NaOH溶液50mL11. 在一定条件下,Na2CO3溶液存在水解平衡:CO32﹣+H2O⇌HCO3﹣+OH﹣ . 下列说法正确的是( )A、稀释溶液,水解平衡常数增大 B、通入CO2 , 平衡朝正反应方向移动 C、升高温度, 减小 D、加入NaOH固体,溶液pH减小12. 用惰性电极电解下列溶液,其中随着电解的进行,溶液pH值逐渐减小的是( )①氯化钠溶液 ②硫酸铜溶液 ③氢氧化钠溶液 ④稀硫酸 ⑤稀盐酸 ⑥硫酸钠溶液.
A、①③⑤ B、②④⑤ C、②④ D、②④⑥13. 常温下,0.1mol•L﹣1CH3COONa溶液pH=11,下列表述正确的是( )A、c(Na+)=c(CH3COO﹣) B、c(CH3COO﹣)+c(CH3COOH)=0.1 mol•L﹣1 C、由水电离出来的c(OH﹣)=1.0×10﹣11 mol•L﹣1 D、往该溶液中加入0.05 mol•L﹣1的CH3COONa,pH值变大14. 关于电解精炼铜(粗铜中含有Fe、Zn、Ni、Ag、Au少量杂质),下列说法中正确的是( )A、用纯铜作阳极、粗铜作阴极 B、电解液的成分保持不变 C、屯解过程中,阳极质量的减少与阴明极质量的增加相等 D、阴极电极反应为:Cu2++2e﹣=Cu15. 下列叙述正确的是( )A、稀醋酸中加入少量醋酸钠能增大醋酸的电离程度 B、25℃时,等体积等浓度的硝酸与氨水混合后,溶液pH=7 C、0.1molAgCl和0.1molAgl混合后加入1 L水中,所得溶液中c(Cl﹣)>c(I﹣) D、25℃时,0.1mol/L的硫化氢溶液比等浓度的硫化钠溶液的导电能力弱16. 室温下向10mL0.1mol/L NaOH溶液中加入0.1mol/L的一元酸HA,溶液pH的变化曲线如闬所示.下列说法正确的是( ) A、a 点所示溶液中 c(Na+)>c(A﹣)>c(H+)>c(HA) B、a、b 两点所示溶液中水的电离程度相问 C、b点所示溶液中c(A﹣)>c(HA) D、pH=7时,c(Na+)﹣=c(A﹣)+c(HA)17. 下列有关实验现象或结论的描述不正确的是( )A、FeCl2溶液与K3[Fe(CN)6]混合后得到特征蓝色沉淀,利用此反应可检验Fe2+ B、向饱和食盐水中加入少量浓盐酸,看到溶液振荡,溶液变浑浊 C、某温度下,向AgCl饱和溶液中加入蒸馏水,AgCl的溶解度、Ksp均增大 D、处理含有Hg2+离子的废水可加入硫化钠,使Hg2+离子转化为HgS沉淀18. 一定温度下,水溶液中H+和OH﹣的浓度变化曲线如图,下列说法正确的是( )
A、a 点所示溶液中 c(Na+)>c(A﹣)>c(H+)>c(HA) B、a、b 两点所示溶液中水的电离程度相问 C、b点所示溶液中c(A﹣)>c(HA) D、pH=7时,c(Na+)﹣=c(A﹣)+c(HA)17. 下列有关实验现象或结论的描述不正确的是( )A、FeCl2溶液与K3[Fe(CN)6]混合后得到特征蓝色沉淀,利用此反应可检验Fe2+ B、向饱和食盐水中加入少量浓盐酸,看到溶液振荡,溶液变浑浊 C、某温度下,向AgCl饱和溶液中加入蒸馏水,AgCl的溶解度、Ksp均增大 D、处理含有Hg2+离子的废水可加入硫化钠,使Hg2+离子转化为HgS沉淀18. 一定温度下,水溶液中H+和OH﹣的浓度变化曲线如图,下列说法正确的是( )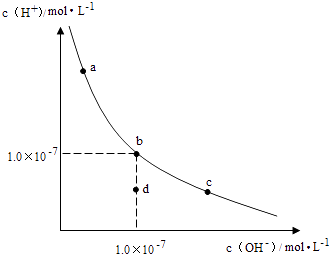 A、升高温度,可能引起由c向b的变化 B、该温度下,水的离子积常数为1.0×10﹣13 C、该温度下,加入FeCl3可能引起由b向a的变化 D、该温度下,稀释溶液可能引起由c向d的变化19. 等体积,浓度均为0.1mol/L的三种溶液:①CH3COOH溶液、②HSCN溶液、③NaHCO3溶液,已知将①、②分别与③混合,实验测得产生的CO2气体体积(v)随时间(t)变化的示意图所示,下列说法正确的是( )
A、升高温度,可能引起由c向b的变化 B、该温度下,水的离子积常数为1.0×10﹣13 C、该温度下,加入FeCl3可能引起由b向a的变化 D、该温度下,稀释溶液可能引起由c向d的变化19. 等体积,浓度均为0.1mol/L的三种溶液:①CH3COOH溶液、②HSCN溶液、③NaHCO3溶液,已知将①、②分别与③混合,实验测得产生的CO2气体体积(v)随时间(t)变化的示意图所示,下列说法正确的是( ) A、物质酸性的比较:CH3COOH>HSCN>H2CO3 B、反应结束后所得两溶液中,c(CH3COO﹣)>c(SCN﹣) C、上述三种溶液中由水电离的c(OH﹣)大小:NaHCO3>CH3COOH>HSCN D、CH3COOH溶液和NaHCO3溶液反应所得溶液中:c(CH3COO﹣)+c(CH3COOH)=0.10mol•L﹣120. 25℃时,下列有关溶液中粒子的物质的量浓度关系正确的是( )A、0.1mol/LCH3COONa与0.1mol/LHCl溶液等体积混合:c(Na+)=c(Cl﹣)>c(OH﹣)>cCH3COO﹣) B、0.1mol/LNH4Cl与0.1mol/L氨水等体积混合(pH>7):c(NH3•H2O)>c(NH4+)>c(Cl﹣)>c(OH﹣) C、0.1mol/LNa2CO3与0.1mol/L NaHCO3溶液等体积混合: c(Na+)=c(CO32﹣)+c(HCO3﹣)+c(H2CO3) D、0.1mol/LNa2C2O4与0.1mol/LHCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O42﹣)+c(HC2O4﹣)+c(OH﹣)=c(Na+)+c(H+)
A、物质酸性的比较:CH3COOH>HSCN>H2CO3 B、反应结束后所得两溶液中,c(CH3COO﹣)>c(SCN﹣) C、上述三种溶液中由水电离的c(OH﹣)大小:NaHCO3>CH3COOH>HSCN D、CH3COOH溶液和NaHCO3溶液反应所得溶液中:c(CH3COO﹣)+c(CH3COOH)=0.10mol•L﹣120. 25℃时,下列有关溶液中粒子的物质的量浓度关系正确的是( )A、0.1mol/LCH3COONa与0.1mol/LHCl溶液等体积混合:c(Na+)=c(Cl﹣)>c(OH﹣)>cCH3COO﹣) B、0.1mol/LNH4Cl与0.1mol/L氨水等体积混合(pH>7):c(NH3•H2O)>c(NH4+)>c(Cl﹣)>c(OH﹣) C、0.1mol/LNa2CO3与0.1mol/L NaHCO3溶液等体积混合: c(Na+)=c(CO32﹣)+c(HCO3﹣)+c(H2CO3) D、0.1mol/LNa2C2O4与0.1mol/LHCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O42﹣)+c(HC2O4﹣)+c(OH﹣)=c(Na+)+c(H+)二、非选择题本卷为综合题
-
21. 根据问题填空:(1)、2SO2(g)+O2(g)⇌2SO3(g)反应过程的能虽变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=﹣99kJ/mol.

请回答下列问题:
①E的大小对该反应的反应热(填“有”或“无”)影构.
②图中△H=kJ/mol.
(2)、由氢气和氧气反应生成1mol水蒸气,放出241.8kJ热量(25℃、101kPa下测得)①写出该反应的热化学方程式: .
②若1mol水蒸气转化为液态水放热45kJ,则反应H2(g)+ O2(g)=H2O(l)的△H=kJ/mol.
22. 现有反应:mA(g)+nB(g)⇌pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:(1)、该反应的逆反应为热反应,且m+np (填“>”、“=”或“<”).(2)、减压时,A的质量分数 . (填“增大”、“减小”或“不变”,下同)(3)、若容积不变加入B,则B的转化率 .(4)、若升高温度,则平衡时B、C的浓度之比将 .(5)、若加入催化剂,平衡时气体混合物的总物质的量 .(6)、若B是有色物质,A、C均无色,则加入C(体积不变)时混合物颜色;而维持容器内压强不变,充入氖气时,混合物颜色 . (填“变深”、“变浅”或“不变”)23. 根据要求回答问题:(1)、相同温度下等物浓度的下列溶液中.A.NH4Cl B.NH4HCO3 C.NH4HSO4 D.(NH4)2SO4
①pH值由大到小的顺序是(用对应的字母填写).
②NH4+离子浓度由大到小的顺序是(用对应的字母填写).
③若上述溶液的pH值相同,则其物成的量浓度关系是(用对应的字母填写).
(2)、25℃.向50mL 0.018mol•L﹣1 的 AgNO3溶液中加入50mL 0.020mol•L﹣1的盐酸,生成沉淀.已知该温度下AgCl的Ksp=1.0×10﹣10 , 忽略溶液的体积变化,请计算:①完全沉淀后,溶液中c(Ag+)= .
②完全沉淀后,溶液的pH= .
(3)、弱酸及其盐在水中存在多种平衡关系.已知NaA水溶液呈碱性,常温下将0.1molNaA和0.05molHCl溶于水,得到1L溶液.①已知该混合溶液为弱酸性,则溶液中离子浓度由大到小的顺序为 .
②向该混合物中再加0.03molNaOH,溶液中n(A﹣)+n(OH﹣)﹣n(H+)= .
24. 如图是一个化学过程的示意图. (1)、通入O2的电极名称、C(Pt)电极的名称是 .(2)、写出通入O2的电极上的电极反应式是 .(3)、写出通入CH3OH的电极上的电极反应式是 .(4)、若丙池是电解饱和食盐水溶液,则阳极的电极反应为 , 阴极的电极反应为 . 在(阳极或阴极)附近滴入酚酞溶液变红.(5)、乙池中反应的化学方程式为 .(6)、当乙池中B(Ag)极的质里增加5.40g时,甲池中理论上消耗O2mL(标准状况下);若丙池中饱和食盐水溶液的体枳为500mL,电解后,溶液的pH= .
(1)、通入O2的电极名称、C(Pt)电极的名称是 .(2)、写出通入O2的电极上的电极反应式是 .(3)、写出通入CH3OH的电极上的电极反应式是 .(4)、若丙池是电解饱和食盐水溶液,则阳极的电极反应为 , 阴极的电极反应为 . 在(阳极或阴极)附近滴入酚酞溶液变红.(5)、乙池中反应的化学方程式为 .(6)、当乙池中B(Ag)极的质里增加5.40g时,甲池中理论上消耗O2mL(标准状况下);若丙池中饱和食盐水溶液的体枳为500mL,电解后,溶液的pH= .(25℃,假设电解前后溶液的体积无变化).
25. 根据要求填空:(1)、①常温下,.某溶液中由水电离出的c(OH﹣)=1.0×10﹣10mol/L,该溶液可以是 . (填选项)A、pH=4的CH3COOH B、pH=10的NaOH C、pH=9的 Na2CO3 D、pH=2的 H2SO4 E、pH=4的 NH4Cl(2)、在100℃时,将 100mL 0.1mol/L 的稀H2SO4溶液与 100mL 0.4mol/L的NaOH 溶液混合后,溶液的pH= . (混合时溶液体积变化忽略不计,已知Kw=10﹣12).(3)、常温下,amL0.1mol/L盐酸与bmL0.1mol/L氨水混合,充分反应,若混合后溶液呈中性,则ab (填“<”、“>”或“=”).(4)、常温下,amLpH=3的盐酸与bmLpH=11的氨水混合,充分反应,若a=b,则反应后溶液中离子浓度从大到小的顺序是 .(5)、氯化铝水溶液呈酸性,原因是(用离子方程式表示>: .把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是 .
(6)、25℃,在0.10mol/LH2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2﹣)关系如下图(忽略溶液体积的变化、H2S的挥发).①pH=13时,溶液中的 c(H2S)+c(HS﹣)=mol/L.
②某溶液含 0.020mol/LMn2+、0.10mol/LH2S,当溶液pH=时,Mn2+开始沉淀.
 26. 测血钙的含量时,进行如下实验:
26. 测血钙的含量时,进行如下实验:①可将2mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成 CaC2O4沉淀,将沉徙用稀硫酸处理得H2C2O4溶液.
②将①得到的H2C2O4溶液,再用酸性KMnO4溶液滴定,氧化产物为CO2 , 还原产物为Mn2+ .
③终点时用去20mL 1.0×10﹣4 mol/L的KMnO4溶液.
(1)、写出用KMnO4滴定H2C2O4的离子方程式 .(2)、判断滴定终点的方法是 .(3)、③步骤中取酸性KMnO4溶液时,酸式滴定管用蒸馏水洗过后没有润洗,则测得的血钙质量分数(填“偏大”、“偏小”或“无影响”).(4)、计算:血液中含钙离子的浓度为mol/L.