山东省潍坊市临朐县2019-2020学年高三下学期化学模拟考试试卷(一)
试卷更新日期:2020-03-23 类型:高考模拟
一、选择题:
-
1. 化学与生活、社会发展息息相关,下列有关说法不正确的是( )A、“时气错逆,霾雾蔽日”,雾所形成的气溶胶能产生丁达尔效应 B、“青蒿一握,以水二升渍,绞取汁”;屠呦呦改进提取青蒿素的方法,提取过程中发生了化学变化 C、刘禹锡的“千淘万漉虽辛苦,吹尽狂沙始到金”可以看出金性质稳定,可通过物理方法得到 D、“外观如雪,强烧之,紫青烟起”。对硝酸钾的鉴定过程中利用了焰色反应2. 查阅资料可知,苯可被臭氧氧化,发生化学反应为:
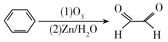
则邻甲基乙苯通过上述反应得到的有机产物最多有( )
A、5种 B、4种 C、3种 D、2种3. 下列各组中的X和Y两种原子,化学性质一定相似的是( )A、X原子和Y原子最外层都只有一个电子 B、X原子的核外电子排布为1s2 , Y原子的核外电子排布为1s22s2 C、X原子2p能级上有三个电子,Y原子的3p能级上有三个电子 D、X原子核外M层上仅有两个电子,Y原子核外N层上仅有两个电子4. 关于下列各实验装置的叙述,不正确的是( ) A、装置①可用于实验室制取少量NH3或O2 B、可用从a处加水的方法检验装置②的气密性 C、实验室可用装置③收集H2、NH3 D、利用装置④制硫酸和氢氧化钠,其中b为阳离子交换膜、c为阴离子交换膜5. 人体尿液中可以分离出具有生长素效应的化学物质——吲哚乙酸,吲哚乙酸的结构简式如图所示。下列有关说法正确的是( )
A、装置①可用于实验室制取少量NH3或O2 B、可用从a处加水的方法检验装置②的气密性 C、实验室可用装置③收集H2、NH3 D、利用装置④制硫酸和氢氧化钠,其中b为阳离子交换膜、c为阴离子交换膜5. 人体尿液中可以分离出具有生长素效应的化学物质——吲哚乙酸,吲哚乙酸的结构简式如图所示。下列有关说法正确的是( ) A、分子中含有2种官能团 B、吲哚乙酸苯环上的二氯代物共有四种 C、1 mol吲哚乙酸与足量氢气发生反应,最多消耗5 mol H2 D、分子中不含手性碳原子6. 短周期主族元素a、b、c、d、e的原子序数依次增大,A、B、C、D、E、F均是由上述元素组成的中学化学常见物质,其中A是四元化合物,C是能使湿润红色石蕊试纸变蓝的气体,D是淡黄色固体化合物,E是单质。各物质之间存在如下图转化关系(部分产物未标出)。下列说法不正确的是( )
A、分子中含有2种官能团 B、吲哚乙酸苯环上的二氯代物共有四种 C、1 mol吲哚乙酸与足量氢气发生反应,最多消耗5 mol H2 D、分子中不含手性碳原子6. 短周期主族元素a、b、c、d、e的原子序数依次增大,A、B、C、D、E、F均是由上述元素组成的中学化学常见物质,其中A是四元化合物,C是能使湿润红色石蕊试纸变蓝的气体,D是淡黄色固体化合物,E是单质。各物质之间存在如下图转化关系(部分产物未标出)。下列说法不正确的是( )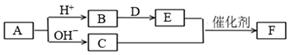 A、简单离子半径大小关系:c>d>e B、简单阴离子的还原性:a>c>d C、氢化物的沸点:c>d D、C和E反应生成F是工业制硝酸的重要反应之一7. 最近科学家发现都由磷原子构成的黑磷(黑磷的磷原子二维结构如图)是比石墨烯更好的新型二维半导体材料.下列说法正确的是( )
A、简单离子半径大小关系:c>d>e B、简单阴离子的还原性:a>c>d C、氢化物的沸点:c>d D、C和E反应生成F是工业制硝酸的重要反应之一7. 最近科学家发现都由磷原子构成的黑磷(黑磷的磷原子二维结构如图)是比石墨烯更好的新型二维半导体材料.下列说法正确的是( ) A、石墨烯属于烯烃 B、石墨烯中碳原子采用sp3杂化 C、黑磷与白磷互为同素异形体 D、黑磷高温下在空气中可以稳定存在8. SBP电解法能大幅度提高电解槽的生产能力,如图为SBP电解法制备MoO3的示意图,下列说法错误的是( )
A、石墨烯属于烯烃 B、石墨烯中碳原子采用sp3杂化 C、黑磷与白磷互为同素异形体 D、黑磷高温下在空气中可以稳定存在8. SBP电解法能大幅度提高电解槽的生产能力,如图为SBP电解法制备MoO3的示意图,下列说法错误的是( ) A、a极为电源的负极,发生氧化反应 B、电路中转移4mol电子,则石墨电极上产生标准状况下22.4LO2 C、钛基钛锰合金电极发生的电极反应为:3H2O+Mo4+-2e-=MoO3+6H+ D、电路中电子流向为:a极 石墨,钛基钛锰电极 b极9. 下列有关实验操作、现象、解释和结论都正确的是( )
A、a极为电源的负极,发生氧化反应 B、电路中转移4mol电子,则石墨电极上产生标准状况下22.4LO2 C、钛基钛锰合金电极发生的电极反应为:3H2O+Mo4+-2e-=MoO3+6H+ D、电路中电子流向为:a极 石墨,钛基钛锰电极 b极9. 下列有关实验操作、现象、解释和结论都正确的是( )选项
操作
现象
解释、结论
A
用玻璃棒蘸取浓氨水点到干燥红色石蕊试纸上
试纸变蓝色
浓氨水呈碱性
B
向饱和Na2CO3溶液中通入足量CO2
溶液变浑浊
析出了Na2CO3晶体
C
向蔗糖中加入浓硫酸并搅拌
蔗糖变黑,体积膨胀
反应中浓硫酸只体现脱水性
D
过量的Fe粉与氯气充分反应后,向反应后的混合物中加水,取上层清液滴入KSCN溶液
溶液不变红色
氯气将Fe氧化为Fe2+
A、A B、B C、C D、D10. 某金属有机多孔材料(MOFA)在常温常压下对CO2有超强的吸附能力,并能高效催化CO2与环氧乙烷衍生物的反应,其工作原理如图。下列说法不正确的是( ) A、该材料的吸附作用具有选择性 B、该方法的广泛使用有助于减少CO2的排放 C、在生成化合物b的过程中,有极性共价键形成 D、其工作原理只涉及化学变化
A、该材料的吸附作用具有选择性 B、该方法的广泛使用有助于减少CO2的排放 C、在生成化合物b的过程中,有极性共价键形成 D、其工作原理只涉及化学变化二、不定项选择题:
-
11. 金属(M)-空气电池(如图)具有原料易得、能量密度高等优点,有望成为新能源汽车和移动设备的电源。该类电池放电的总反应为:4M + nO2 + 2nH2O = 4M(OH)n。已知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能。
下列说法不正确的是( )
 A、多孔电极有利于氧气扩散至电极表面,可提高反应速率 B、电池放电过程的正极反应式: O2 + 2H2O + 4e- = 4OH- C、比较Mg、Al二种金属-空气电池,“理论比能量”之比是8∶9 D、为防止负极区沉积Mg(OH)2 , 宜采用中性电解质及阳离子交换膜12. 铋(Bi)位于元素周期表中第VA族,其价态为+3时较稳定,铋酸钠(NaBiO3)溶液呈无色。现取一定量的硫酸锰MnSO4溶液,向其中依次滴加下列溶液,对应现象如表所示:
A、多孔电极有利于氧气扩散至电极表面,可提高反应速率 B、电池放电过程的正极反应式: O2 + 2H2O + 4e- = 4OH- C、比较Mg、Al二种金属-空气电池,“理论比能量”之比是8∶9 D、为防止负极区沉积Mg(OH)2 , 宜采用中性电解质及阳离子交换膜12. 铋(Bi)位于元素周期表中第VA族,其价态为+3时较稳定,铋酸钠(NaBiO3)溶液呈无色。现取一定量的硫酸锰MnSO4溶液,向其中依次滴加下列溶液,对应现象如表所示:加入溶液
①适量铋酸钠溶液
②过量双氧水
③适量KI-淀粉溶液
实验现象
溶液呈紫红色
溶液紫红色消失,产生气泡
溶液缓慢变成蓝色
在上述实验条件下,下列结论正确的是( )
A、氧化性强弱顺序为:BiO3-> MnO4- > H2O2 > I2 B、H2O2被高锰酸根离子还原成O2 C、H2O2具有氧化性,把KI氧化成I2 D、KI-淀粉溶液中滴加铋酸钠溶液,溶液不一定变蓝色13. 室温下,将0.100 0 mol·L-1盐酸滴入20.00 mL 未知浓度的某一元碱MOH溶液中,溶液pH随加入盐酸体积变化曲线如图所示。下列有关说法不正确的是( )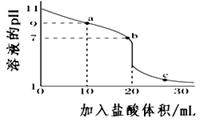 A、该一元碱溶液浓度为0.100 0 mol·L-1 B、a点:c(M+) >c(Cl-)> c(OH-)> c(H+) C、b点:c(M+)+c(MOH)=c(Cl-) D、室温下,MOH的电离常数Kb=1×10-514. 某黄色溶液中可能含有Na+、NH4+、Fe2+、Fe3+、Cl﹣、SO42﹣、CO32﹣等离子(不考虑水的电离和离子的水解)。某同学为了确定其组分,设计并完成了如下实验:
A、该一元碱溶液浓度为0.100 0 mol·L-1 B、a点:c(M+) >c(Cl-)> c(OH-)> c(H+) C、b点:c(M+)+c(MOH)=c(Cl-) D、室温下,MOH的电离常数Kb=1×10-514. 某黄色溶液中可能含有Na+、NH4+、Fe2+、Fe3+、Cl﹣、SO42﹣、CO32﹣等离子(不考虑水的电离和离子的水解)。某同学为了确定其组分,设计并完成了如下实验:下列说法正确的是( )
 A、c(Fe3+)一定为0.2 mol•L﹣1 B、Cl﹣一定存在 C、Na+、SO42﹣一定存在,NH4+一定不存在 D、Na+、Fe2+可能存在, CO32﹣一定不存在15. PbCl2是一种重要的化工材料,常用作助溶剂、制备铅黄等染料。工业生产中利用方铅矿精矿(主要成分为PbS,含有FeS2等杂质)和软锰矿(主要成分为MnO2)制备PbCl2的工艺流程如下图所示。
A、c(Fe3+)一定为0.2 mol•L﹣1 B、Cl﹣一定存在 C、Na+、SO42﹣一定存在,NH4+一定不存在 D、Na+、Fe2+可能存在, CO32﹣一定不存在15. PbCl2是一种重要的化工材料,常用作助溶剂、制备铅黄等染料。工业生产中利用方铅矿精矿(主要成分为PbS,含有FeS2等杂质)和软锰矿(主要成分为MnO2)制备PbCl2的工艺流程如下图所示。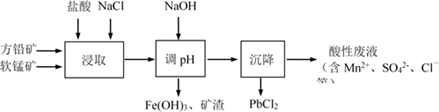
已知:i. PbCl2微溶于水
ii. PbCl2 (s) + 2Cl-(aq) PbCl42-(aq) ΔH > 0
下列说法不正确的是( )
A、浸取过程中MnO2与PbS发生反应的离子方程式为:8H++2Cl-+PbS + 4MnO2 = PbCl2 +4Mn2++SO42-+4H2O B、PbCl2微溶于水,浸取剂中加入饱和NaCl溶液会增大其溶解性 C、调pH的目的是除去Fe3+ , 因此pH越大越好 D、沉降池中获得PbCl2采取的措施有加水稀释、降温三、非选择题:本题共5小题,共60分。
-
16. 资源化利用CO2 , 可以减少温室气体排放,还可以获得燃料或重要的化工产品。回答下列问题:(1)、CO2的捕集
①用饱和Na2CO3溶液做吸收剂可“捕集”CO2。写出“捕集”CO2反应的离子方式。
②聚合离子液体是目前广泛研究的CO2 吸附剂。结合下图分析聚合离子液体吸附CO2 的有利条件是。
 (2)、生产尿素:
(2)、生产尿素:工业上以CO2、NH3为原料生产尿素[CO(NH2)2],该反应分为二步进行:
第一步:2NH3(g)+CO2(g) H2NCOONH4(s) △H = - 159.5 kJ·mol-1
第二步:H2NCOONH4(s) CO(NH2)2(s)+ H2O(g) △H = +116.5 kJ·mol-1
① 写出上述合成尿素的热化学方程式。该反应化学平衡常数K的表达式:。
② 某实验小组模拟工业上合成尿素,在一定体积的密闭容器中投入4mol NH3和1mol CO2 , 实验测得反应中各组分物质的量随时间的变化如图所示:

已知总反应的快慢由慢的一步反应决定,则合成尿素总反应的快慢由第步反应决定,总反应进行到min时到达平衡.
(3)、合成乙酸:中国科学家首次以CH3OH、CO2和H2为原料高效合成乙酸,其反应路径如下图所示:

① 原料中的CH3OH可通过电解法由CO2制取,用稀硫酸作电解质溶液,写出生成CH3OH的电极反应式。
② 根据图示,写出总反应的化学方程。
17. 有A,B,C,D四种元素,其中A元素和B元素的原子都有1个未成对电子,A+比B-少一个电子层,B原子得一个电子填入3p轨道后,3p轨道已充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为 40%,且其核内质子数等于中子数。R是由A、D两元素形成的离子化合物,其中A+与D2-离子数之比为2∶1。回答下列问题:
 (1)、A元素形成的晶体属于A2密堆积型式,则其晶体内晶胞类型应属于(填写“六方”、“面心立方”或“体心立方”)。(2)、B-的电子排布式为 , 在CB3分子中C元素原子的原子轨道发生的是杂化。(3)、C的氢化物的空间构型为 , 其氢化物在同族元素所形成的氢化物中沸点最高的原因是。(4)、B元素的电负性D元素的电负性(填“>”、“<”或“=”);用一个化学方程式说明。(5)、如图所示是R形成的晶体的晶胞,设晶胞的棱长为a cm。试计算R晶体的密度为。(阿伏加德罗常数用NA表示)18. 硫酸四氨合铜晶体([Cu(NH3)4]SO4·H2O)常用作杀虫剂,媒染剂,在碱性镀铜中也常用作电镀液的主要成分,在工业上用途广泛。常温下该物质溶于水,不溶于乙醇、乙醚,在空气中不稳定,受热时易发生分解。某化学兴趣小组以Cu粉、3mol/L的硫酸、浓氨水、10% NaOH溶液、95%的乙醇溶液、0.500 mol/L稀盐酸、0.500 mol/L的NaOH溶液来合成硫酸四氨合铜晶体并测定其纯度。(1)、I.CuSO4溶液的制备
(1)、A元素形成的晶体属于A2密堆积型式,则其晶体内晶胞类型应属于(填写“六方”、“面心立方”或“体心立方”)。(2)、B-的电子排布式为 , 在CB3分子中C元素原子的原子轨道发生的是杂化。(3)、C的氢化物的空间构型为 , 其氢化物在同族元素所形成的氢化物中沸点最高的原因是。(4)、B元素的电负性D元素的电负性(填“>”、“<”或“=”);用一个化学方程式说明。(5)、如图所示是R形成的晶体的晶胞,设晶胞的棱长为a cm。试计算R晶体的密度为。(阿伏加德罗常数用NA表示)18. 硫酸四氨合铜晶体([Cu(NH3)4]SO4·H2O)常用作杀虫剂,媒染剂,在碱性镀铜中也常用作电镀液的主要成分,在工业上用途广泛。常温下该物质溶于水,不溶于乙醇、乙醚,在空气中不稳定,受热时易发生分解。某化学兴趣小组以Cu粉、3mol/L的硫酸、浓氨水、10% NaOH溶液、95%的乙醇溶液、0.500 mol/L稀盐酸、0.500 mol/L的NaOH溶液来合成硫酸四氨合铜晶体并测定其纯度。(1)、I.CuSO4溶液的制备①称取4g铜粉,在A仪器中灼烧10分钟并不断搅拌,放置冷却。
②在蒸发皿中加入30mL 3mol/L的硫酸,将A中固体慢慢放入其中,加热并不断搅拌。
③趁热过滤得蓝色溶液。
A仪器的名称为。
(2)、某同学在实验中有1.5g的铜粉剩余,该同学将制得的CuSO4溶液倒入另一蒸发皿中加热浓缩至有晶膜出现,冷却析出的晶体中含有白色粉末,试解释其原因。(3)、II.晶体的制备将上述制备的CuSO4溶液按如图所示进行操作

已知浅蓝色沉淀的成分为Cu2(OH)2SO4 , 试写出生成此沉淀的离子反应方程式。
(4)、析出晶体时采用加入乙醇的方法,而不是浓缩结晶的原因是。(5)、III.氨含量的测定精确称取mg晶体,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入VmL10%NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,并用蒸馏水冲洗导管内壁,用V1mLClmol/L的盐酸标准溶液完全吸收。取下接收瓶,用C2mol/L NaOH标准溶液滴定过剩的HCl(选用甲基橙作指示剂),到终点时消耗V2mLNaOH溶液。

玻璃管2的作用 , 样品中氨的质量分数的表达式。
(6)、下列实验操作可能使氨含量测定结果偏低的原因是____________________。A、滴定时未用NaOH标准溶液润洗滴定管 B、读数时,滴定前平视,滴定后俯视 C、滴定过程中选用酚酞作指示剂 D、取下接收瓶前,未用蒸馏水冲洗插入接收瓶中的导管外壁19. 以废旧锌锰电池中的黑锰粉(MnO2、MnO(OH)、NH4Cl、少量ZnCl2及炭黑、氧化铁等)为原料制备MnCl2 , 实现锰的再利用。其工作流程如下: (1)、过程Ⅰ,在空气中加热黑锰粉的目的是除炭、氧化MnO(OH)等。
(1)、过程Ⅰ,在空气中加热黑锰粉的目的是除炭、氧化MnO(OH)等。O2氧化MnO(OH)的化学方程式是。
(2)、溶液a的主要成分为NH4Cl,另外还含有少量ZnCl2等。① 溶液a呈酸性,原因是。
② 根据下图所示的溶解度曲线,将溶液a (填操作名称),可得NH4Cl粗品。
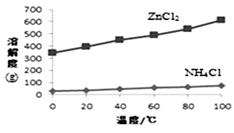
③ 提纯NH4Cl粗品,有关性质数据如下:
化合物
ZnCl2
NH4Cl
熔点
365℃
337.8℃分解
沸点
732℃
根据上表,设计方案提纯NH4Cl:
(3)、检验MnSO4溶液中是否含有Fe3+:取少量溶液,加入(填试剂和现象),证明溶液中Fe3+沉淀完全。(4)、探究过程Ⅱ中MnO2溶解的适宜条件。ⅰ.向MnO2中加入H2O2溶液,产生大量气泡;再加入稀H2SO4 , 固体未明显溶解。
ⅱ.向MnO2中加入稀H2SO4 , 固体未溶解;再加入H2O2溶液,产生大量气泡,固体完全溶解。
① 用化学方程式表示ⅱ中MnO2溶解的原因:。
② 解释试剂加入顺序不同,MnO2作用不同的原因:
上述实验说明,试剂加入顺序不同,物质体现的性质可能不同,产物也可能不同。
20. 某抗结肠炎药物有效成分的合成路线如下(部分反应略去试剂和条件):
根据以上信息回答下列问题:
(1)、烃A的结构简式是。(2)、①的反应条件是;②的反应类型是。(3)、下列对抗结肠炎药物有效成分可能具有的性质推测正确的是__________。A、水溶性比苯酚好,密度比苯酚的大 B、能发生消去反应 C、能发生聚合反应 D、既有酸性又有碱性(4)、E与足量NaOH溶液反应的化学方程式是.(5)、符合下列条件的E的同分异构体有种,其中核磁共振氢谱有四组峰,峰面积之比3∶2∶2∶1的异构体的结构简式为。a.与E具有相同的官能团
b.苯环上的一硝基取代产物有两种
(6)、已知 易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,而当苯环上连有羧基时则取代在间位。据此设计以A为原料制备高分子化合物
易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,而当苯环上连有羧基时则取代在间位。据此设计以A为原料制备高分子化合物  的合成路线。(无机试剂任选)
的合成路线。(无机试剂任选)