山东省潍坊市临朐县2019-2020学年高三下学期化学模拟考试试卷(二)
试卷更新日期:2020-03-23 类型:高考模拟
一、选择题:本题共10小题,每小题2分,共20分。
-
1. 世界第一条大面积碲化镉薄膜“发电玻璃”生产线最近在成都投产,该材料是在玻璃表面镀一层碲化镉薄膜,光电转化率高。下列说法错误的是( )A、普通玻璃含有二氧化硅 B、该发电玻璃能将光能不完全转化为电能 C、碲化镉是一种有机化合物 D、应用该光电转化技术可减少温室气体排放2. 某有机化合物,只含碳、氢二种元素,相对分子质量为56,完全燃烧时产生等物质的量的CO2和H2O。它可能的结构共有(需考虑顺反异构)( )A、3种 B、4种 C、5种 D、6种3. 为实现随处可上网,中国发射了“中星16号”卫星。NH4ClO4是火箭的固体燃料,发生反应为2NH4ClO4 N2↑+Cl2↑+2O2↑+4H2O,NA代表阿伏加德罗常数,下列说法正确的是( )A、1 mol NH4ClO4溶于水含NH4+和ClO4-离子数均为NA B、产生6.4g O2反应转移的电子总数为1.4NA C、反应中还原产物分子数与氧化产物分子总数之比为3:1 D、0.5mol NH4ClO4分解产生的气体体积为44.8L4. 已知C3N4晶体很可能具有比金刚石更大的硬度,且原子间以单键结合。下列有关C3N4晶体的说法中正确的是( )A、C3N4晶体是分子晶体 B、C3N4晶体中C—N键的键长比金刚石中的C—C键的键长长 C、C3N4晶体中C、N原子个数之比为4∶3 D、C3N4晶体中粒子间通过共价键相结合5. 室温下,下列各组离子在指定溶液中能大量共存的是( )A、0.1 mol·L−1K2CO3溶液:Na+、Ba2+、Cl−、OH− B、0.1 mol·L−1FeCl2溶液:K+、Mg2+、SO42-、MnO4- C、0.1 mol·L−1NaOH溶液:Na+、K+、 、 D、0.1 mol·L−1H2SO4溶液:K+、 、 、6. 我国科学家在绿色化学领域取得新进展。利用双催化剂Cu和Cu2O,在水溶液中用H 原子将CO2高效还原为重要工业原料之一的甲醇,反应机理如下图。下列有关说法不正确的是( )
 A、CO2生成甲醇是通过多步还原反应实现的 B、催化剂Cu结合氢原子,催化剂Cu2O结合含碳微粒 C、该催化过程中只涉及化学键的形成,未涉及化学键的断裂 D、有可能通过调控反应条件获得甲醛等有机物7. 下列有关仪器的名称、图形、用途与使用操作的叙述均正确的是( )
A、CO2生成甲醇是通过多步还原反应实现的 B、催化剂Cu结合氢原子,催化剂Cu2O结合含碳微粒 C、该催化过程中只涉及化学键的形成,未涉及化学键的断裂 D、有可能通过调控反应条件获得甲醛等有机物7. 下列有关仪器的名称、图形、用途与使用操作的叙述均正确的是( )选项
A
B
C
D
名称
250 mL容量瓶
分液漏斗
酸式滴定管
冷凝管
图形




用途与使用操作
配制1.0 mol·L-1NaCl溶液,定容时仰视刻度,则配得的溶液浓度小于1.0 mol·L-1
用酒精萃取碘水中的碘,分液时,碘层需从上口放出
可用于量取10.00mL Na2CO3溶液
蒸馏实验中将蒸气冷凝为液体
A、A B、B C、C D、D8. 以太阳能为热源分解Fe3O4 , 经热化学铁氧化合物循环分解水制H2的过程如图所示。下列叙述不正确的是( )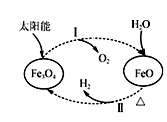
A、过程Ⅰ中的能量转化形式是太阳能→化学能 B、过程Ⅰ中每消耗116 g Fe3O4转移2 mol电子 C、过程Ⅱ的化学方程式为3FeO+H2O Fe3O4+H2↑ D、铁氧化合物循环制H2具有节约能源、产物易分离等优点9. 下列有机物分子中有手性碳原子的是( )A、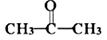 B、
B、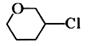 C、
C、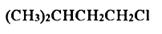 D、
D、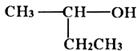 10. BMO(Bi2MoO6)是一种高效光催化剂,可用于光催化降解苯酚,原理如图所示。下列说法不正确的是( )
10. BMO(Bi2MoO6)是一种高效光催化剂,可用于光催化降解苯酚,原理如图所示。下列说法不正确的是( ) A、该过程的总反应:C6H6O+7O2 6CO2+3H2O B、该过程中BMO表现较强还原性 C、降解产物的分子中只含有极性分子 D、①和②中被降解的苯酚的物质的量之比为3:1
A、该过程的总反应:C6H6O+7O2 6CO2+3H2O B、该过程中BMO表现较强还原性 C、降解产物的分子中只含有极性分子 D、①和②中被降解的苯酚的物质的量之比为3:1二、不定项选择题
-
11. 已知电导率越大导电能力越强。常温下用0.100mol·L-1 NaOH溶液分别滴定10.00 mL 浓度均为0.100 mol·L-1的盐酸和醋酸溶液,测得滴定过程中溶液的电导率如图所示。

下列说法正确的是( )
A、曲线②代表滴定盐酸的曲线 B、滴定醋酸的过程应该选择甲基橙作为指示剂 C、a、b、c三点溶液中水的电离程度:a>c>b D、b点溶液中:c(OH-)=c(H+)+c(CH3COO-)+ c(CH3COOH)12. 高能LiFePO4电池,多应用于公共交通。电池中间是聚合物的隔膜,主要作用是在反应过程中只让Li+通过。结构如图所示。
原理如下:(1− x)LiFePO4+xFePO4+LixCn LiFePO4+nC。
下列说法不正确的是( )
A、放电时,电子由负极经导线、用电器、导线到正极 B、充电时,Li+向左移动 C、充电时,阴极电极反应式:xLi++xe− +nC=LixCn D、放电时,正极电极反应式:xFePO4+xLi++xe− =xLiFePO413. X、Y、Z、W是短周期元素,X元素原子的最外层未达到8电子稳定结构,工业上通过分离液态空气获得其单质;Y元素原子最外电子层上s、p电子数相等;Z元素+2价阳离子的核外电子排布与氖原子相同;W元素原子的M层有1个未成对的p电子。下列有关这些元素性质的说法一定正确的是( )A、X、Y、Z、W四种元素都位于元素周期表的p区 B、Z元素的离子半径大于W元素的离子半径 C、Z元素的单质在一定条件下能与X元素的单质反应 D、Y元素最高价氧化物的晶体具有很高的熔点和沸点14. 汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3→K2O+5Na2O+16N2↑。若氧化物比还原物多1.75mol,则下列判断正确的是( )A、生成40.0LN2(标准状况) B、有0.250molKNO3被氧化 C、转移电子的物质的量为1.25mol D、被氧化的N原子的物质的量为3.75mol15. 溴化钙可用作阻燃剂、制冷剂,具有易溶于水,易吸潮等性质。实验室用工业大理石(含有少量Al3+、Fe3+等杂质)制备溴化钙的主要流程如下:
下列说法错误的是( )
A、已知步骤Ⅲ的滤液中不含NH4+ , 步骤Ⅱ加入的试剂a是石灰水 B、步骤Ⅱ控制溶液的pH约为8.0的主要目的是沉淀过量Ca2+ C、试剂b是氢溴酸,步骤Ⅳ的目的是除去过量的氢氧化钙 D、步骤Ⅴ所含的操作依次是蒸发浓缩,冷却结晶三、非选择题:本题共5小题,共60分。
-
16. 燃煤产生的烟气中含有较多的CO2、CO、SO2等影响环境的气体。如何综合利用这些气体一直是科研单位研究的热点。
 (1)、已知:2CO2(g)+6H2(g)=CH3OCH3(g)+3H2O(g) ΔH1
(1)、已知:2CO2(g)+6H2(g)=CH3OCH3(g)+3H2O(g) ΔH1CO(g)+H2O(g)=CO2(g)+H2(g) ΔH2
2CO(g)+4H2(g)=CH3OCH3(g)+H2O(g) ΔH3
用ΔH2、ΔH3表示ΔH1 , ΔH1=
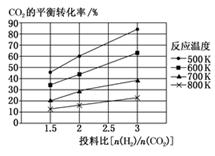
(2)、针对CO2与H2反应转化为二甲醚(g)和H2O(g),研究发现,该反应中CO2的平衡转化率随反应温度、投料比[n(H2)/n(CO2)]的变化曲线如图:①ΔH1(填“>”或“<”)0。
②若其他条件不变,仅仅增大压强,则逆反应速率会(填“增大”“减小”或“不变”,下同),平衡常数K会。
(3)、研究发现,催化剂可以促使烟气CO、SO2转化为CO2、S。反应原理为2CO(g)+SO2(g)=2CO2(g)+S(l) ΔH=-270 kJ·mol-1。
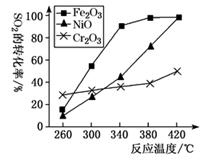
①其他条件相同,研究发现,分别选取Fe2O3、NiO、Cr2O3作上述反应的催化剂时,SO2的转化率随反应温度的变化如图,研究得出,应该选择Fe2O3作催化剂,主要原因可能是
②若在2 L恒容密闭容器中,将3 mol CO、1 mol SO2混合,在一定条件下引发反应,当SO2的平衡转化率为40%时,此时K=。
③向反应容器中再分别通入下列气体,可以使SO2转化率增大的是(填字母)。
A.CO B.SO2 C.N2 D.H2S E.CO2
17. 王帅博士同美国加州大学伯克利分校化工系Enrique Iglesia教授在金属氧化物催化剂表面羟醛缩合反应机理方面的合作研究取得新进展。如图是羰基化合物的自缩合和交叉缩合途径:
回答下列问题:
(1)、基态O原子核外有种不同运动状态的电子,与O元素同周期第一电离能大于O的主族元素有(填元素符号)。(2)、HCHO和H2O都参与上述转化。HCHO分子的空间构型是 , 三聚甲醛的结构如图一所示,三聚甲醛中C原子的杂化方式为。 (3)、H2O能形成多种配位化合物。科研人员通过X射线推测胆矾中既含有配位键,又含有氢键。结构如图二所示。胆矾的化学式用配位化合物的形式可表示为 , 1mol胆矾所含σ键的数目为NA。(4)、TiO2是上述转化的催化剂,CaTiO3是制取TiO2的一种原料,其晶胞结构如图三所示。在CaTiO3晶体中,与某个钛离子距离最近且相等的其他钛离子共有个,设该化合物的式量为M , 密度为a g/cm3 , 阿伏加德罗常数为NA , 则晶体中钙离子与钛离子之间的最短距离为cm。18. 亚硝酰氯(ClNO)是有机物合成中的重要试剂,其沸点为-5.5℃,易水解。已知:AgNO2微溶于水,能溶于硝酸,AgNO2+HNO3=AgNO3 +HNO2 , 某学习小组在实验室用Cl2和NO制备ClNO并测定其纯度,相关实验装置如图所示。
(3)、H2O能形成多种配位化合物。科研人员通过X射线推测胆矾中既含有配位键,又含有氢键。结构如图二所示。胆矾的化学式用配位化合物的形式可表示为 , 1mol胆矾所含σ键的数目为NA。(4)、TiO2是上述转化的催化剂,CaTiO3是制取TiO2的一种原料,其晶胞结构如图三所示。在CaTiO3晶体中,与某个钛离子距离最近且相等的其他钛离子共有个,设该化合物的式量为M , 密度为a g/cm3 , 阿伏加德罗常数为NA , 则晶体中钙离子与钛离子之间的最短距离为cm。18. 亚硝酰氯(ClNO)是有机物合成中的重要试剂,其沸点为-5.5℃,易水解。已知:AgNO2微溶于水,能溶于硝酸,AgNO2+HNO3=AgNO3 +HNO2 , 某学习小组在实验室用Cl2和NO制备ClNO并测定其纯度,相关实验装置如图所示。 (1)、制备Cl2的发生装置可以选用(填字母代号)装置,发生反应的离子方程式为。(2)、欲收集一瓶干燥的氯气,选择合适的装置,其连接顺序为 a→(按气流方向,用小写字母表示)。(3)、实验室可用图示装置制备亚硝酰氯:
(1)、制备Cl2的发生装置可以选用(填字母代号)装置,发生反应的离子方程式为。(2)、欲收集一瓶干燥的氯气,选择合适的装置,其连接顺序为 a→(按气流方向,用小写字母表示)。(3)、实验室可用图示装置制备亚硝酰氯:
①实验室也可用 B 装置制备 NO,X装置的优点为
②检验装置气密性并装入药品,打开K2 , 然后再打开K3 , 通入一段时间气体,其目的是 , 然后进行其他操作,当Z中有一定量液体生成时,停止实验。
(4)、已知:ClNO 与H2O反应生成HNO2和 HCl。①设计实验证明 HNO2是弱酸:。(仅提供的试剂:1 mol•L-1盐酸、1mol•L-1HNO2溶液、 NaNO2溶液、红色石蕊试纸、蓝色石蕊试纸)。
②通过以下实验测定ClNO样品的纯度。取Z中所得液体m g 溶于水,配制成250 mL 溶液;取出25.00 mL样品溶于锥形瓶中,以K2CrO4溶液为指示剂,用c mol•L-1 AgNO3标准溶液滴定至终点,消耗标准溶液的体积为20.00mL。滴定终点的现象是 , 亚硝酰氯(ClNO)的质量分数为。(已知:Ag2CrO4为砖红色固体;Ksp(AgCl)=1.56×10-10 , Ksp(Ag2CrO4)=1×10-12)
19. 铁、镍及其化合物在工业上有广泛的应用。从某矿渣[成分为NiFe2O4(铁酸镍)、NiO、FeO、CaO、SiO2等]中回收NiSO4的工艺流程如下: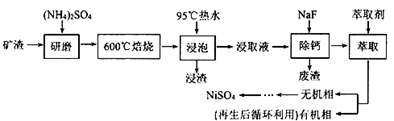
已知(NH4)2SO4在350℃分解生成NH3和H2SO4 , 回答下列问题:
(1)、“浸渣”的成分有Fe2O3、FeO(OH)、CaSO4外,还含有(写化学式)。(2)、矿渣中部分FeO焙烧时与H2SO4反应生成Fe2(SO4)3的化学方程式为(3)、向“浸取液”中加入NaF以除去溶液中Ca2+(浓度为1.0×10-3mol·L-1),当溶液中c(F-)=2.0×10-3mol·L-1时,除钙率为[Ksp(CaF2)=4.0×10-11]。(4)、溶剂萃取可用于对溶液中的金属离子进行富集与分离: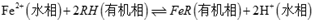 。萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如图甲所示,V0/VA的最佳取值为。在(填“强碱性”“强酸性”或“中性”)介质中“反萃取”能使有机相再生而循环利用。
。萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如图甲所示,V0/VA的最佳取值为。在(填“强碱性”“强酸性”或“中性”)介质中“反萃取”能使有机相再生而循环利用。 
图甲 图乙
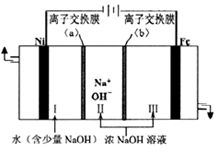
(5)、以Fe、Ni为电极制取Na2FeO4的原理如图乙所示。通电后,在铁电极附近生成紫红色的FeO42- , 若pH过高,铁电极区会产生红褐色物质。①电解时阳极的电极反应式为 , 离子交换膜(b))为(填“阴”或“阳”)离子交换膜。
②向铁电极区出现的红褐色物质中加入少量的NaClO溶液,沉淀溶解。该反应的离子方程式为。
20. 有机物A是一种重要的化工原料,以A为主要起始原料,通过下列途径可以合成高分子材料PA及PC。
回答下列问题:
(1)、B的化学名称为 , B到C的反应条件是。(2)、E到F的反应类型为 , 高分子材料PA的结构简式为。(3)、由A生成H的化学方程式为。(4)、实验室检验有机物A,可选择下列试剂中的。a.盐酸 b.FeCl3溶液 C. NaHCO3溶液 d.浓溴水
(5)、E的同分异构中,既能与碳酸氢钠溶液反应、又能发生银镜反应的有机物共有种。其中核磁共振氢谐图有5组峰,且峰面积之比为6:1:1:1:1的物质的结构简式为。(6)、由B通过三步反应制备1.3-环己二烯的合成路线为。