人教版九年级上册第五单元课题3 利用化学方程式的简单计算 同步训练
试卷更新日期:2017-08-21 类型:同步测试
一、单选题
-
1. 12.8g氧化铁和氧化铜的混合物与CO充分反应后固体质量减少3.2g,则原混合物中Fe2O3和CuO的质量比为( )A、3:2 B、2:1 C、3:1 D、1:12. 将18g高锰酸钾加热,当产生1.6g氧气时,固体剩余物是( )A、KMnO4 MnO2 B、K2MnO4 MnO2 C、KMnO4 MnO2 K2MnO4 D、KMnO4 K2MnO43. 在A+3B=2C+2D的反应中,14克A完全反应生成44克C和18克D,若A的相对分子质量为28,则B的 相对分子质量是( )A、16 B、32 C、64 D、964. 在化学反应A2+BC=B+A2C中,反应物BC与生成物 B的质量关系如图所示.将2g A2与80g BC恰好完全反应,则生成A2C的质量是( )
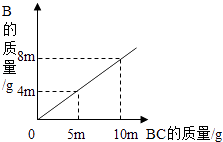 A、64g B、18g C、80g D、9g5. 已知:草钙酸[CaC2O4]比碳酸钙受热易分解,CaC2O4 CaCO3+CO↑.将12.8gCaC2O4固体加热一段时间后剩余7.8g固体.下列说法错误的是( )A、剩余固体为混合物 B、剩余固体中含有钙元素的质量为4.0g C、将剩余固体溶于过量的稀盐酸,产生2.2gCO2 D、将加热产生的气体全部通入足量澄清石灰水中,生成10.0g固体6. 在一密闭容器里放入四种物质,使其在一定条件下充分反应,测得数据如表
A、64g B、18g C、80g D、9g5. 已知:草钙酸[CaC2O4]比碳酸钙受热易分解,CaC2O4 CaCO3+CO↑.将12.8gCaC2O4固体加热一段时间后剩余7.8g固体.下列说法错误的是( )A、剩余固体为混合物 B、剩余固体中含有钙元素的质量为4.0g C、将剩余固体溶于过量的稀盐酸,产生2.2gCO2 D、将加热产生的气体全部通入足量澄清石灰水中,生成10.0g固体6. 在一密闭容器里放入四种物质,使其在一定条件下充分反应,测得数据如表四种物质
甲
乙
丙
丁
反应前质量(g)
2
8
30
50
反应后质量(g)
20
未测
39
23
(已知甲、丙两种物质的相对分子质量之比为1:1)
则下列说法正确的是( )
A、该反应为化合反应 B、待测值为18 C、反应中丁和丙的质量比为3:1 D、甲、丙两种物质化学计量数之比为1:27. 物质X与Ca(OH)2水溶液发生反应的化学方程式为:X+Ca(OH)2=Y+Cu(OH)2↓,下列说法正确的是( )A、X可能是酸 B、X和Y的相对分子质量之差为24 C、X可能是单质,也可能是化合物 D、Y只可能是CaCl28. 为及时发现燃气泄漏,常在燃气中加入少量有特殊气味的乙硫醇(C2H5SH),乙硫醇在煤气燃烧过程中也发生燃烧,其反应如下:2C2H5SH+9O2 4CO2+6H2O+2X,下列关于X的说法正确的是( )A、X由碳、硫、氧三种元素组成 B、X属于有机化合物 C、X中硫、氧元素的原子个数比为1:2 D、X中氧元素的质量分数为60%9. 在密闭容器中加入甲、乙、丙、丁四种物质,使之充分反应,反应前后测得有关数据如表:物质
甲
乙
丙
丁
反应前质量/g
18
1
2
32
反应后质量/g
X
26
2
12
下列说法中,不正确的是( )
A、反应后物质甲的质量为13g B、乙是反应物 C、反应中乙、丁的质量比为5:4 D、物质丙可能是该反应的催化剂10. 10gA和足量B混合加热,充分反应后生成8gC和4gD,则参加反应的A和B的质量比为( )A、1:1 B、2:1 C、4:1 D、5:111. 已知:Cu2O+H2SO4═Cu+CuSO4+H2O。16.0g CuO与CO反应得到Cu、Cu2O混合物13.6g,将此混合物溶于足量的100.0g稀H2SO4得9.6gCu.下列说法正确的是( )A、生成2.4g CO2 B、混合物中含9.6g铜元素 C、混合物中Cu与Cu2O的质量之比为8:9 D、反应后溶液中CuSO4的质量分数约为7.0%二、计算题
-
12. 给29.4克氯酸钾和二氧化锰的混合物加热,测得剩余固体的质量(m)与反应时间(t)的关系如下表:
反应时间t∕s t0 t1 t2 t3 t4 t5 t6 反应后固体的质量m∕g 29.4 27.4 25.4 23.4 21.4 19.8 19.8 请回答下列问题:
(1)当氯酸钾完全反应后,生成氧气的质量为 g。
(2)剩余固体由哪些物质组成?它们的质量各为多少克?13. 小宇同学在实验室里将16g高锰酸钾放在试管里加热制取氧气,反应一段时间后,他称得剩余固体物质的质量为14.4g,试求:①生成氧气为多少克?这些氧气在标准状况下的体积是多少升?(设标准状况下O2的密度为1.4g/L)②剩余固体物质中含有哪些物质,各有多少克?14.称取某石灰石样品20g在高温条件下充分煅烧(杂质不反应),称得剩余固体为13.4g,求该石灰石样品中CaCO3的质量分数.(提示:石灰石的主要成分为碳酸钙,碳酸钙高温分解的化学方程式为CaCO3
 CaO+CO2↑ )15. 向100gBaCl2溶液中滴加Na2SO4溶液,至恰好完全反应,共用去Na2SO4溶液30g.反应后过滤得到溶液125.34g,请计算:(反应的化学方程式为BaCl2+Na2SO4═BaSO4↓+2NaCl)
CaO+CO2↑ )15. 向100gBaCl2溶液中滴加Na2SO4溶液,至恰好完全反应,共用去Na2SO4溶液30g.反应后过滤得到溶液125.34g,请计算:(反应的化学方程式为BaCl2+Na2SO4═BaSO4↓+2NaCl)①生成BaSO4的质量.
②BaCl2溶液中溶质的质量分数(写出计算过程)
16. 某工厂需要100kg氢气做燃料.若用电解水的方法制取这些氢气,消耗水的质量是多少?同时可以得到的氧气的质量是多少?(根据质量守恒定律,写出解题过程)三、填空题
-
17. 丙醇(化学式为C3H8O)是一种清洁燃料,它在一定量的氧气中燃烧的化学方程式可表示为
C3H8O+4O2 4H2O+2CO2+X,
①生成物X的化学式为 .
②要使6.0g丙醇燃烧时不生成X,则消耗氧气的质量至少为 g.
18. 某物质6.4g和O2充分反应,生成4.4gCO2、2.8gCO和7.2g水.则参加反应的O2的质量是 , 生成的CO和H2O的分子个数之比为 .19. 一定条件下,下列物质在密闭容器内充分反应,测得反应前后各物质的质量如下:物质
A
B
C
D
反应前质量/g
1.7
2.2
7.9
0.9
反应后质量/g
待测
6.6
0
2.7
则反应后A的质量为;
该反应中B和D两种物质变化的质量比为 .
20. 在点燃条件下,4.4gC3H8与12.8gO2恰好完全反应,生成7.2g水,4.4g二氧化碳和agX,则a的值为;该反应的化学方程式为: .四、探究题
-
21. 实验室用氯酸钾制取氧气.
 (1)、写出标号为a的仪器名称;(2)、反应的发生装置是;(3)、反应的化学方程式是;(4)、用分析天平称取3.50g氯酸钾和1.00g二氧化锰混合加热,称得反应后固体混合物的质量为3.54g.
(1)、写出标号为a的仪器名称;(2)、反应的发生装置是;(3)、反应的化学方程式是;(4)、用分析天平称取3.50g氯酸钾和1.00g二氧化锰混合加热,称得反应后固体混合物的质量为3.54g.①二氧化锰在固体混合物中的质量分数变化趋势是;
②通过已知条件列出生成氯化钾质量(x)的比例式为;
③剩余固体混合物中氯酸钾的质量为g.
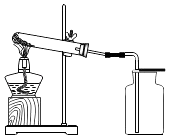
22. 高锰酸钾在生产、生活中有广泛应用.实验小组对高锰酸钾的某些性质进行研究.(1)、Ⅰ.不稳定性如图所示进行实验,受热分解的化学方程式为 , 3.16g KMnO4产生O2的质量为g.
 (2)、用向上排空气法收集O2的原因是 .(3)、Ⅱ.腐蚀性
(2)、用向上排空气法收集O2的原因是 .(3)、Ⅱ.腐蚀性【查阅资料】KMnO4溶液呈中性、有腐蚀性
【进行实验】
实验1:将新鲜鸡皮在不同浓度的KMnO4溶液中浸泡相同时间,现象如表
KMnO4溶液浓度
0.002%
0.01%
0.1%
1%
鸡皮的变化
无明显变化
边缘部分变为棕黄色
全部变为棕色
全部变为黑色
实验2:将铜片分别浸泡在4种浸泡相同时间,现象如下表.
编号
①
②
③
④
实验
25mL0.1%KMnO4溶液

25mL0.1%KMnO4溶液+10滴浓硫酸

25mL蒸馏水+10滴浓硫酸

25mL1%KMnO4溶液+10滴浓硫酸
铜片
质量/g
实验前
0.54
0.54
0.54
0.54
18小时后
0.54
0.52
0.54
0.43
【解释与结论】
实验1的目的是
(4)、实验2中通过对比②和④,得出的结论是 .(5)、实验2中,欲得出“KMnO4和硫酸共同作用对铜才有腐蚀性”的结论,需要对比(填编号).(6)、实验2中,铜片被腐蚀的反应如下,补全该反应的化学方程式.5Cu+2KMnO4+8H2SO4=5CuSO4+2MnSO4+K2SO4+ .
23. 有一种管道疏通剂,主要成分为铝粉和氢氧化钠混合粉末.工作原理是:利用铝和氢氧化钠遇水反应放出大量的热,加快氢氧化钠对毛发等淤积物的腐蚀,同时产生氢气增加管道内的气压,利于疏通.小柯利用如图装置测定疏通剂中铝的质量分数.Ⅰ.取样品20g,倒入容积为200mL的锥形瓶中,然后在分流漏斗中加入水,置于电子天平上测出总质量m1 .
Ⅱ.打开活塞,加入足量的水充分反应,直到没有固体剩余,静置一段时间,测出总质量m2 .
Ⅲ.实验数据如下表:
反应前总质量m1
反应后总质量m2
371.84g
371.24g

回答下列问题:
(1)、配平化学方程式:2Al+2NaOH+2H2O NaAlO2+3H2↑(2)、根据化学方程式计算样品中铝的质量分数.(3)、以下情形会导致样品中铝的质量分数测量结果偏高的原因可能有 .A、向锥形瓶中倒入样品时,撒出了部分粉末 B、在反应过程中有水蒸气逸出 C、没有等装置中氢气全部排尽就称量.