浙教版科学 八年级下册同步练习 2.3 原子的结构模型
试卷更新日期:2020-03-08 类型:同步测试
一、单选题
-
1. 著名科学家居里夫人首先发现某些原子具有放射性,即原子能自动放射出一些粒子。若一种元素的原子经过放射变成了另一种元素的原子,则此原子放射出的粒子中一定有 ( )A、电子 B、中子 C、质子 D、原子核2. 2019年联合国把今年定为“元素周期表年”。俄国科学家门捷列夫对元素周期表的编制做出巨大贡献,人们将101号元素命名为“钔”来纪念他。钔原子的核电荷数为101,相对原子质量为258,则钔原子的质子数为( )A、101 B、157 C、258 D、3593. 图为某原子结构模型的示意图,其中a、b、c是构成该原子的三种不同粒子,下列说法不正确的是( )
 A、决定该原子种类的粒子是c B、原子中b与c的数目一定相同 C、原子中a与c的数目一定相同 D、原子的质量集中在b和c上4. 有3种不同的原子,甲原子核内有6个质子和6个中子,乙原子核内有6个质子和8个中子,丙原子核内有7个质子和7个中子.下列说法正确的是( )A、甲和乙是同一种元素 B、甲和乙的核电荷数不同 C、乙和丙核外电子数相等 D、乙和丙互为同位素原子5. 下列关于原子模型叙述正确的是( )A、卢瑟福建立的“卢瑟福模型”认为电子像云雾一样出现在原子核周围 B、玻尔建立的“分层模型”认为电子在原子核周围分层运动 C、现代科学家认为电子像西瓜籽似地嵌在原子中 D、汤姆生建立的“汤姆生模型”认为电子像行星绕太阳运行6. 原子结构的模型在实验和探索中不断地修正和完善。如图为某原子的结构示意图,该原子的原子核中有( )
A、决定该原子种类的粒子是c B、原子中b与c的数目一定相同 C、原子中a与c的数目一定相同 D、原子的质量集中在b和c上4. 有3种不同的原子,甲原子核内有6个质子和6个中子,乙原子核内有6个质子和8个中子,丙原子核内有7个质子和7个中子.下列说法正确的是( )A、甲和乙是同一种元素 B、甲和乙的核电荷数不同 C、乙和丙核外电子数相等 D、乙和丙互为同位素原子5. 下列关于原子模型叙述正确的是( )A、卢瑟福建立的“卢瑟福模型”认为电子像云雾一样出现在原子核周围 B、玻尔建立的“分层模型”认为电子在原子核周围分层运动 C、现代科学家认为电子像西瓜籽似地嵌在原子中 D、汤姆生建立的“汤姆生模型”认为电子像行星绕太阳运行6. 原子结构的模型在实验和探索中不断地修正和完善。如图为某原子的结构示意图,该原子的原子核中有( ) A、6 个质子和 8 个中子 B、8 个质子和 6 个中子 C、6 个质子和 8 个电子 D、8 个质子和 6 个电子7. 极光是一种绚丽多彩的发光现象,其发生是由于太阳带电粒子流进入地球磁场。在地球南北两极附近地区的高空,夜间出现的灿烂美丽的光辉,在南极被称为南极光,在北极被称为北极光。下列这些微粒中,不会引起极光的是( )A、a粒子(氦的原子核) B、电子 C、质子 D、中子8. 碳一12是指含6个中子的碳原子,下列对氧一16和氧一18两种氧原子的说法正确的是( )A、质子数相同 B、质量相同 C、电子数不相同 D、16和18表示原子个数9. “朝核问题”引发国际关注,核问题的关键是核能的如何利用。已知某种核原料的原子核中含有1个质子和2个中子,那么( )A、该原子核带2个单位的正电荷 B、该元素是金属元素 C、该原子核外有3个电子 D、该原子是一种氢原子10. 如图为原子结构模型的演变图,其中①为道尔顿原子模型,④为近代量子力学原子模型。下列排列符合历史演变顺序的一组是( )
A、6 个质子和 8 个中子 B、8 个质子和 6 个中子 C、6 个质子和 8 个电子 D、8 个质子和 6 个电子7. 极光是一种绚丽多彩的发光现象,其发生是由于太阳带电粒子流进入地球磁场。在地球南北两极附近地区的高空,夜间出现的灿烂美丽的光辉,在南极被称为南极光,在北极被称为北极光。下列这些微粒中,不会引起极光的是( )A、a粒子(氦的原子核) B、电子 C、质子 D、中子8. 碳一12是指含6个中子的碳原子,下列对氧一16和氧一18两种氧原子的说法正确的是( )A、质子数相同 B、质量相同 C、电子数不相同 D、16和18表示原子个数9. “朝核问题”引发国际关注,核问题的关键是核能的如何利用。已知某种核原料的原子核中含有1个质子和2个中子,那么( )A、该原子核带2个单位的正电荷 B、该元素是金属元素 C、该原子核外有3个电子 D、该原子是一种氢原子10. 如图为原子结构模型的演变图,其中①为道尔顿原子模型,④为近代量子力学原子模型。下列排列符合历史演变顺序的一组是( ) A、①③②⑤④ B、①②③④⑤ C、①⑤③②④ D、①③⑤④②11. 下列关于原子核的叙述:①通常是由分子和电子构成;②通常是由质子和中子构成;③带正电荷;④不显电性;⑤不能再分;⑥跟原子比较体积较小,但却集中了原子的主要质量。其中正确的是( )A、②④⑥ B、②③⑥ C、①③⑤ D、①④⑤12. 氚是氢的一种同位素,氚原子含有1个质子和2个中子。下列示意图能正确表示氚原子结构的是( )
A、①③②⑤④ B、①②③④⑤ C、①⑤③②④ D、①③⑤④②11. 下列关于原子核的叙述:①通常是由分子和电子构成;②通常是由质子和中子构成;③带正电荷;④不显电性;⑤不能再分;⑥跟原子比较体积较小,但却集中了原子的主要质量。其中正确的是( )A、②④⑥ B、②③⑥ C、①③⑤ D、①④⑤12. 氚是氢的一种同位素,氚原子含有1个质子和2个中子。下列示意图能正确表示氚原子结构的是( ) A、
A、 B、
B、 C、
C、 D、
D、 13. 下列关于镁原子、镁离子两种粒子的判断中,不正确的是( )
13. 下列关于镁原子、镁离子两种粒子的判断中,不正确的是( )
A、核电荷数相同 B、质量几乎相等 C、镁离子比镁原子稳定 D、电子数与质子数相同14. 目前普遍认为,质子和中子都是由被称为u夸克和d夸克的两类夸克组成的。u夸克带电量为+(2/3)e,d夸克带电量为-(1/3)e,e为基元电荷。下列论断中可能正确的是( )A、质子由1个u夸克和1个d夸克组成,中子由1个u夸克和2个d夸克组成 B、质子由1个u夸克和1个d夸克组成,中子由2个u夸克和1个d夸克组成 C、质子由2个u夸克和1个d夸克组成,中子由1个u夸克和2个d夸克组成 D、质子由2个u夸克和1个d夸克组成,中子由1个u夸克和1个d夸克组成15. 已知R元素的相对原子质量m与其原子核内的质子数和中子数之和在数值上相等。若R2+核外有x个电子,则其原子核内的中子数为( )A、m-x+2 B、m+x-2 C、m-x-2 D、m+x+216. 科学上用符号“ZAX”表示原子的组成,其中X代表元素符号,Z表示原子核内的质子数,A表示原子核内质子数与中子数之和。已知abXn+和cdYm-的核外电子数相等。则下列关系正确的是( )
A、b-a=d-c B、a+n=c-m C、a-n=c+m D、b-n=d+m17. 科学上常用元素符号左下角数字表示原子的质子数,左上角数字表示原子的中子数与质子数之和,如 613C表示核内有6个质子和7个中子的碳原子。下列关于 53131I和 53127I的说法中错误的是( )
A、各取一个原子相比较,中子数相同 B、属于同种元素 C、各取一个原子相比较,核外电子数相同 D、各取一个原子相比较,质子数相同18.下图形象地表示了氯化钠的形成过程。下列相关叙述中正确的是( )
 A、钠原子失去一个电子形成阳离子,氯原子得到一个电子形成阴离子 B、钠原子与钠离子都不显电性 C、氯化钠分子由氯原子和钠原子构成 D、钠原子与钠离子的微观结构相同
A、钠原子失去一个电子形成阳离子,氯原子得到一个电子形成阴离子 B、钠原子与钠离子都不显电性 C、氯化钠分子由氯原子和钠原子构成 D、钠原子与钠离子的微观结构相同二、填空题
-
19. 原子是由带正电的 和带负电的 构成,且正负电荷数量相等.20. 人类对原子结构的认识,经历了汤姆生、卢瑟福和玻尔等提出的模型的过程。
 (1)、卢瑟福核式结构模型是在α粒子轰击金箔实验的基础上提出的。下图中能正确反映他实验结果的示意图是(选填序号)。(2)、从原子结构模型建立的过程中,我们发现 (选填序号)。A、科学模型的建立是一个不断完善、不断修正的过程 B、模型在科学研究中起着很重要的作用 C、玻尔的原子模型建立,使人们对原子结构的认识达到了完美的境界 D、人类借助模型的建立,对原子的认识逐渐接近本质21. 已知原子中:质子数(Z)+中子数(N)=质量数(A),表示 X元素原子的质子数和质量数可用 符号表示。据报道钬元素的原子 可有效治疗肝癌,该原子的中子数是 , 核外电子数是。现有 和 两种原子,则 X 和 Y 是否是同种元素?。22. 下列微粒中,是阳离子的是;互为同位素的是。
(1)、卢瑟福核式结构模型是在α粒子轰击金箔实验的基础上提出的。下图中能正确反映他实验结果的示意图是(选填序号)。(2)、从原子结构模型建立的过程中,我们发现 (选填序号)。A、科学模型的建立是一个不断完善、不断修正的过程 B、模型在科学研究中起着很重要的作用 C、玻尔的原子模型建立,使人们对原子结构的认识达到了完美的境界 D、人类借助模型的建立,对原子的认识逐渐接近本质21. 已知原子中:质子数(Z)+中子数(N)=质量数(A),表示 X元素原子的质子数和质量数可用 符号表示。据报道钬元素的原子 可有效治疗肝癌,该原子的中子数是 , 核外电子数是。现有 和 两种原子,则 X 和 Y 是否是同种元素?。22. 下列微粒中,是阳离子的是;互为同位素的是。组别
质子
中子
电子
A
14
14
14
B
26
30
24
C
26
30
26
D
14
16
14
23. 如图是三种粒子的结构示意图,请通过比较回答下列问题: (1)、三种粒子相对原子质量不同的原因。(2)、由此你可以得出的结论是。
(1)、三种粒子相对原子质量不同的原因。(2)、由此你可以得出的结论是。三、解答题
-
24.
如图为原子构成示意图,请你仔细观察此图片,你从中能获得哪些信息?(答出三条信息)
 25. 如图是 1~18 号元素原子最外层电子数与原子核电荷数的关系图。试回答:
25. 如图是 1~18 号元素原子最外层电子数与原子核电荷数的关系图。试回答: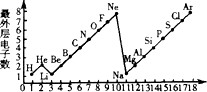 (1)、一个 Mg2+核外共有个电子;Cl-的最外层电子数和原子的最外层电子数相同;(2)、通过对该图的分析,你能发现哪些规律?请写出其中一个。26. 下表是某位同学收集的一些微粒的资料,请根据表格数据回答下列问题。
(1)、一个 Mg2+核外共有个电子;Cl-的最外层电子数和原子的最外层电子数相同;(2)、通过对该图的分析,你能发现哪些规律?请写出其中一个。26. 下表是某位同学收集的一些微粒的资料,请根据表格数据回答下列问题。粒子名称
质子数
中子数
电子数
带电性
A
14
14
14
不带电
B
26
30
24
带 2 个单位正电荷
C
14
14
16
D
14
16
14
不带电
(1)、上述粒子中属于原子的是。(2)、根据表格信息可知 C 的带电性为。(3)、表格中互为同位素的粒子是。(4)、比较 C 与 D 两种粒子,其中质量较大的是。27.探究原子结构的奥秘。
【情景提供】 19世纪以前,人们一直以为原子是不可分的,直到1887年,汤姆生发现了带负电的电子后,才引起人们对原子结构模型的探索。
【提出问题】 电子带负电,原子不带电,说明原子内存在着带正电荷的部分,它们是均匀分布还是集中分布的呢?
【进行实验】 1910年英国科学家卢瑟福进行了著名的α粒子轰击金箔实验。
实验做法如图所示:
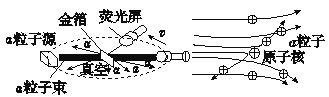
①放射源——放射性物质放出α粒子(带正电荷),质量是电子质量的7000倍;
②金箔——作为靶子,厚度1 μm,重叠了3000层左右的原子;
③荧光屏——α粒子打在上面发出闪光;
④显微镜——通过显微镜观察闪光,且通过360度转动可观察不同角度α粒子的到达情况。
【收集证据】 绝大多数α粒子穿过金箔后仍沿原来的方向前进,但是有少数α粒子却发生了较大的偏转,并且有极少数α粒子的偏转超过90°,有的甚至几乎达到180°,像是被金箔弹了回来。
【猜想与假设】 α粒子遇到电子后,就像飞行的子弹碰到灰尘一样运动方向不会发生明显的改变,而结果却出乎意料,除非原子的大部分质量集中到了一个很小的结构上,否则大角度的散射是不可能的。
【解释与结论】
(1)、若原子质量、正电荷在原子内均匀分布,则极少数α粒子就(填“会”或“不会”)发生大角度散射。卢瑟福所说的“除非原子的大部分质量集中到了一个很小的结构上”中的“很小的结构”指的是。(2)、1 μm厚度的金箔包含了3000层金原子,绝大多数α粒子穿过后方向不变,说明____;A、原子的质量是均匀分布的 B、原子内部绝大部分空间是空的(3)、科学家对原子结构的探究经历了三个过程,通过α粒子散射实验,你认为原子结构为下图中的________。A、 道尔顿模型特点:不可再分的实心球体
B、
道尔顿模型特点:不可再分的实心球体
B、 汤姆生模型特点:正负电荷均匀分布
C、
汤姆生模型特点:正负电荷均匀分布
C、 卢瑟福模型特点:核位于原子中心,重量集中在核上
卢瑟福模型特点:核位于原子中心,重量集中在核上