2016-2017学年湖北省部分重点中学联考高二上学期期末化学试卷
试卷更新日期:2017-08-20 类型:期末考试
一、选择题
-
1. 以下是一些常用的危险品标志,装运乙醇的包装箱应贴的标志是( )A、
 B、
B、 C、
C、 D、
D、 2. 银耳本身为淡黄色,某地生产的一种“雪耳”,颜色洁白如雪.制作如下:将银耳堆放在密闭状态良好的塑料棚内,棚的一端支口小锅,锅内放有硫磺,加热使硫磺熔化并燃烧,两天左右,“雪耳”就制成了.“雪耳”炖而不烂,对人体有害,制作“雪耳”利用的是( )A、硫的还原性 B、硫的漂白性 C、二氧化硫的还原性 D、二氧化硫的漂白性3. 少量的金属钠长期暴露在空气中,它的最终产物是( )A、NaOH B、Na2CO3•10H2O C、Na2CO3 D、NaHCO34. 下列有关试剂的保存方法,错误的是( )A、浓硝酸保存在无色玻璃试剂瓶中 B、少量钠保存在煤油中 C、氢氧化钠溶液保存在带有橡皮塞的玻璃试剂瓶中 D、新制氯水通常保存在棕色试剂瓶中5. 实验室制备氨气,检验是否收集满的正确方法是( )A、用手扇动收集的气体,有气味则已收集满 B、将润湿的淀粉KI试纸接近瓶口,试纸变蓝则已收集满 C、将润湿的红色石蕊试纸伸入瓶内,试纸变蓝则已收集满 D、用玻璃棒一端蘸取浓盐酸,接近瓶口,产生大量白烟,证明已收集满6. 氢氧化铝可作为治疗某种胃病的内服药,这是利用了氢氧化铝的哪个性质( )A、酸性 B、碱性 C、两性 D、氧化性7. 向一小烧杯中分别加入等体积的水和煤油,片刻后再向该烧杯中轻缓地加入一块绿豆大小的金属钠,可能观察到的现象符合下图中的( )A、
2. 银耳本身为淡黄色,某地生产的一种“雪耳”,颜色洁白如雪.制作如下:将银耳堆放在密闭状态良好的塑料棚内,棚的一端支口小锅,锅内放有硫磺,加热使硫磺熔化并燃烧,两天左右,“雪耳”就制成了.“雪耳”炖而不烂,对人体有害,制作“雪耳”利用的是( )A、硫的还原性 B、硫的漂白性 C、二氧化硫的还原性 D、二氧化硫的漂白性3. 少量的金属钠长期暴露在空气中,它的最终产物是( )A、NaOH B、Na2CO3•10H2O C、Na2CO3 D、NaHCO34. 下列有关试剂的保存方法,错误的是( )A、浓硝酸保存在无色玻璃试剂瓶中 B、少量钠保存在煤油中 C、氢氧化钠溶液保存在带有橡皮塞的玻璃试剂瓶中 D、新制氯水通常保存在棕色试剂瓶中5. 实验室制备氨气,检验是否收集满的正确方法是( )A、用手扇动收集的气体,有气味则已收集满 B、将润湿的淀粉KI试纸接近瓶口,试纸变蓝则已收集满 C、将润湿的红色石蕊试纸伸入瓶内,试纸变蓝则已收集满 D、用玻璃棒一端蘸取浓盐酸,接近瓶口,产生大量白烟,证明已收集满6. 氢氧化铝可作为治疗某种胃病的内服药,这是利用了氢氧化铝的哪个性质( )A、酸性 B、碱性 C、两性 D、氧化性7. 向一小烧杯中分别加入等体积的水和煤油,片刻后再向该烧杯中轻缓地加入一块绿豆大小的金属钠,可能观察到的现象符合下图中的( )A、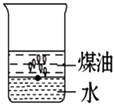 B、
B、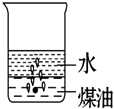 C、
C、 D、
D、 8. 下列物质中既能跟稀H2SO4反应,又能跟氢氧化钠溶液反应的是( )
8. 下列物质中既能跟稀H2SO4反应,又能跟氢氧化钠溶液反应的是( )①NaHCO3 ②Al2O3 ③Al(OH)3 ④Al ⑤Na2CO3 .
A、①②③④ B、②③④ C、②③④⑤ D、全部9. 为了除去铁粉中的少量铝粉,可以选取下列哪种溶液( )A、浓盐酸 B、浓硝酸 C、浓硫酸 D、氢氧化钠溶液10. 取两份等量的铝粉,分别与足量的盐酸、浓氢氧化钠溶液反应,在相同状态下产生的气体体积之比是( )A、1:1 B、1:2 C、1:3 D、3:211. 只用一种试剂可区别Na2SO4、MgCl2、FeCl2、Al2(SO4)3四种溶液,这种试剂是( )A、Ba(NO3)2 B、H2SO4 C、NaOH D、AgNO312. 向MgSO4和Al2(SO4)3的混合溶液中,逐滴加入NaOH溶液.下列图象中,能正确表示上述反应的是(横坐标表示加入NaOH溶液的体积,纵坐标表示反应生成沉淀的质量)( )A、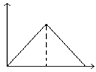 B、
B、 C、
C、 D、
D、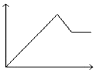 13. 某同学对一无色透明溶液进行分析得出该溶液中含有下列某组离子,你认为该组离子应该是( )A、Al3+、NO3﹣、K+、SO42﹣ B、Ca2+、H+、CO32﹣、AlO2﹣ C、OH﹣、SO42﹣、NH4+、Al3+ D、Fe3+、Mg2+、NO3﹣、Cl﹣14. 下列离子方程式书写正确的是( )A、铝粉投入到NaOH溶液中:2Al+2OH﹣═2AlO2﹣+H2↑ B、AlCl3溶液中加入足量的氨水:Al3++3OH﹣═Al(OH)3↓ C、三氯化铁溶液中加入铁粉Fe3++Fe=2Fe2+ D、FeCl2溶液跟Cl2反应:2Fe2++Cl2=2Fe3++2Cl﹣15. 用NA表示阿伏加德罗常数的值,下列说法中正确的是( )A、1molN2所含有的原子数为NA B、标准状况下,22.4L水中含有的水分子数为NA C、标准状况下,22.4L氯化氢所含的原子数为NA D、24gO2分子和24gO3分子所含的氧原子数目相等16. 下列物质中,不属于合金的是( )A、硬铝 B、水银 C、黄铜 D、钢铁17. 赏心悦目的雕花玻璃是用一种物质对玻璃进行刻蚀而制成的,这种物质是( )A、硫酸 B、烧碱 C、盐酸 D、氢氟酸18. 当光束通过下列分散系:①尘埃的空气 ②稀硫酸 ③蒸馏水 ④墨水,能观察到有丁达尔现象的是( )A、①② B、②③ C、①④ D、②④
13. 某同学对一无色透明溶液进行分析得出该溶液中含有下列某组离子,你认为该组离子应该是( )A、Al3+、NO3﹣、K+、SO42﹣ B、Ca2+、H+、CO32﹣、AlO2﹣ C、OH﹣、SO42﹣、NH4+、Al3+ D、Fe3+、Mg2+、NO3﹣、Cl﹣14. 下列离子方程式书写正确的是( )A、铝粉投入到NaOH溶液中:2Al+2OH﹣═2AlO2﹣+H2↑ B、AlCl3溶液中加入足量的氨水:Al3++3OH﹣═Al(OH)3↓ C、三氯化铁溶液中加入铁粉Fe3++Fe=2Fe2+ D、FeCl2溶液跟Cl2反应:2Fe2++Cl2=2Fe3++2Cl﹣15. 用NA表示阿伏加德罗常数的值,下列说法中正确的是( )A、1molN2所含有的原子数为NA B、标准状况下,22.4L水中含有的水分子数为NA C、标准状况下,22.4L氯化氢所含的原子数为NA D、24gO2分子和24gO3分子所含的氧原子数目相等16. 下列物质中,不属于合金的是( )A、硬铝 B、水银 C、黄铜 D、钢铁17. 赏心悦目的雕花玻璃是用一种物质对玻璃进行刻蚀而制成的,这种物质是( )A、硫酸 B、烧碱 C、盐酸 D、氢氟酸18. 当光束通过下列分散系:①尘埃的空气 ②稀硫酸 ③蒸馏水 ④墨水,能观察到有丁达尔现象的是( )A、①② B、②③ C、①④ D、②④二、填空题
-
19. 洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一.漂白粉是常用的消毒剂.工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学反应方程式为;漂白粉的有效成分是(填化学式) . 该反应中氧化剂与还原剂物质的量之比是 .20. 硫酸具有A﹣D所示的性质,以下过程主要表现了浓硫酸的那些性质?请将选项字母填在下列各小题的括号内:
A强酸性 B 吸水性 C 脱水性 D 强氧化性
(1)、浓硫酸可以干燥氢气(2)、浓硫酸使木条变黑(3)、热的浓硫酸与铜片反应(4)、把锌粒放入稀硫酸中时,有气体放出(5)、在常温下可以用铁、铝制容器盛装冷的浓硫酸 .21. 有X、Y、Z三种元素:⑴X、Y、Z的单质在常温下均为气体;
⑵X单质可以在Z的单质中燃烧,生成物为XZ,火焰呈苍白色;
⑶XZ极易溶于水,在水溶液中电离出X+和Z﹣ , 其水溶液能使蓝色石蕊试纸变红;
⑷每2个X2分子能与1个Y2分子化合成2个X2Y分子,X2Y常温下为液体;
⑸Z单质溶于X2Y中,所得溶液具有漂白性.
试写出其元素符号:X , Y , Z , 以及化合物的分子式:XZ , X2Y .
22. 在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气.进行此实验,所用仪器如图: (1)、连接上述仪器的正确顺序(填各接口处的字母):接;接;接;接 .(2)、装置中,饱和食盐水的作用是;NaOH溶液的作用是 .(3)、化学实验中常用湿润的淀粉KI试纸检验是否有Cl2产生.如果有Cl2产生,可观察到 , 反应方程式 .
(1)、连接上述仪器的正确顺序(填各接口处的字母):接;接;接;接 .(2)、装置中,饱和食盐水的作用是;NaOH溶液的作用是 .(3)、化学实验中常用湿润的淀粉KI试纸检验是否有Cl2产生.如果有Cl2产生,可观察到 , 反应方程式 .
(4)、写出下列化学反应的方程式:①气体发生装置中进行的反应: .
②NaOH溶液中发生的反应: .