2017年河北省保定市高考化学二模试卷
试卷更新日期:2017-08-19 类型:高考模拟
一、选择题
-
1. 下列对于太阳能、生物质能和氢能的利用的说法不正确的是( )A、芒硝晶体(Na2SO4•10H2O)白天在阳光下曝晒后失水、溶解吸热,夜里重新结晶放热,实现了太阳能转化为化学能继而转化为热能 B、将植物的秸秆、枝叶、杂草和人畜粪便加入沼气发酵池中,在富氧条件下,经过缓慢、复杂、充分的氧化反应最终生成沼气,从而有效利用生物质能 C、生活、生成中大量应用氢能源,首先要解决由水制备氢气的能耗、氢气的储存和运输等问题 D、垃圾焚烧处理厂把大量生活垃圾中的生物质能转化为热能、电能,减轻了垃圾给城市造成的压力,改善了城市的环境,增强了市民的环保意识2. 如图是几种常见有机物之间的转化关系,有关说法正确的是( )
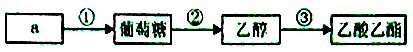 A、a只能是淀粉 B、反应①②③均为取代反应 C、乙醇可以与多种氧化剂发生氧化反应 D、乙酸乙酯的羧酸类同分异构体只有1种3. 下列有关实验操作或实验原理叙述正确的是( )
A、a只能是淀粉 B、反应①②③均为取代反应 C、乙醇可以与多种氧化剂发生氧化反应 D、乙酸乙酯的羧酸类同分异构体只有1种3. 下列有关实验操作或实验原理叙述正确的是( )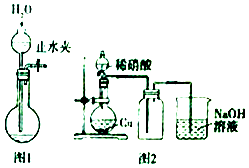 A、可以用pH试纸测定饱和氯水的pH B、用50mL量筒能够量取8.5mL0.1 mol•L﹣1盐酸 C、用图1所示操作检查装置的气密性 D、实验室用图2所示装置制取纯净的NO24. 根据下列实验操作和现象所得到的结论正确的是( )A、向NaAlO2溶液中通入足量CO2 , 有白色沉淀产生,说明碳酸的酸性强于氢氧化铝 B、用铂丝蘸取某溶液进行焰色反应,火焰呈黄色,说明溶液中不含有K+ C、在KI淀粉溶液中滴入氯水变蓝,再通入SO2 , 蓝色褪去,说明SO2具有漂白性 D、向某FeCl2溶液中,加入Na2O2粉末出现红褐色沉淀,说明原FeCl2已氧化变质5. 据报道:美国火星探测车在火星大气层中检测到了气体M,资料显示,1个M分子由X、Y、Z三种短周期非金属元素的各一个原子构成,三种元素在元素周期表中的位置如表.已知:在地球表面温度条件下M不稳定,易分解生成一种单质和一种可燃性氧化物.下列说法正确的是( )
A、可以用pH试纸测定饱和氯水的pH B、用50mL量筒能够量取8.5mL0.1 mol•L﹣1盐酸 C、用图1所示操作检查装置的气密性 D、实验室用图2所示装置制取纯净的NO24. 根据下列实验操作和现象所得到的结论正确的是( )A、向NaAlO2溶液中通入足量CO2 , 有白色沉淀产生,说明碳酸的酸性强于氢氧化铝 B、用铂丝蘸取某溶液进行焰色反应,火焰呈黄色,说明溶液中不含有K+ C、在KI淀粉溶液中滴入氯水变蓝,再通入SO2 , 蓝色褪去,说明SO2具有漂白性 D、向某FeCl2溶液中,加入Na2O2粉末出现红褐色沉淀,说明原FeCl2已氧化变质5. 据报道:美国火星探测车在火星大气层中检测到了气体M,资料显示,1个M分子由X、Y、Z三种短周期非金属元素的各一个原子构成,三种元素在元素周期表中的位置如表.已知:在地球表面温度条件下M不稳定,易分解生成一种单质和一种可燃性氧化物.下列说法正确的是( )X
Y
Z
A、M分解产生的可燃性氧化物为XY B、可以推测出火星大气层的温度比地球衣面温度略高 C、X、Y、Z三种非金属元素形成的单质的沸点X>Y>Z D、X、Y、Z三种非金属元素最简单气态氢化物的稳定性X<Y<Z6. 设NA为阿伏加德罗常数数值,下列有关叙述正确的是( )A、将78g Na2O2与过量CO2反应转移的电子数为2NA B、1molN2与4mol H2反应生成的NH3分子数为2NA C、标准状况下,2.24LCCl4中所含原子数为0.5NA D、标准状况下,18gD2O中所含电子数为9NA7. 含SO2的烟气会形成酸雨,工业上常利用Na2SO3溶液作为吸收液脱除烟气中的SO2 . 随着SO2的吸收,吸收液的pH不断变化.下列粒子浓度关系一定正确的是( )A、Na2SO3溶液中存在: B、已知NaHSO3溶液pH<7,该溶液中: C、当吸收液呈中性时: D、当吸收液呈酸性时:二、解答题
-
8. 化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:
 (1)、常温下,取 pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图1所示.则图中表示醋酸溶液中pH变化的曲线是 填“A”或“B”).
(1)、常温下,取 pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图1所示.则图中表示醋酸溶液中pH变化的曲线是 填“A”或“B”).设盐酸中加入的Zn质量为m1 , 醋酸溶液中加入的Zn质量为 m2 . 则 m1 m2 ( 选填“<”、“=”、“>”).
(2)、如图2所示,在体积为3L的密闭容器中,CO与H2在一定条件下反应生成甲醇:CO(g)+2H2(g)⇌CH3OH(g).升高温度,K值(填“增大”、“减小”或“不变”).在500℃,从反应开始到达到平衡,用氢气浓度变化表示的平均反应速率v(H2)= .(3)、某温度下Ksp=2×10 ﹣11 , 若该温度下某MgSO4溶液里c(Mg 2+)=0.002mol•L﹣1 , 如果生成Mg(OH)2沉淀,应调整溶液pH,使之大于;该温度下,在0.20L的0.002mol/LMgSO4溶液中加入等体积的0.10mol/L的氨水溶液,该温度下电离常数Kb(NH3•H2O)=2×10﹣5 , 试计算(填“有”或“无”) Mg(OH)2沉淀生成?(4)、常温下,某纯碱(Na2CO3)溶液中滴入酚酞,溶液呈红色.在分析该溶液遇酚酞呈红色原因时,甲同学认为是配制溶液所用的纯碱样品中混有NaOH 所致;乙同学认为是溶液中Na2CO3电离出的CO32﹣水解所致.请你设计一个简单的实验方案给甲和乙两位同学的说法以评判(包括操作、现象和结论) .9. 将不可再生的天然气、石油、煤等化石燃料转化利用、提高利用率已成为当务之急.(1)、根据部分键能数据和CH4 (g)+4F2 (g)=CF4(g)+4HF(g)的反应热△H为1940kJ•mol﹣1 , 计算H﹣F键的键能为 .化学键
C﹣H
C﹣F
H﹣F
F﹣F
键能/(kJ.mol﹣1)
414
489
?
155
(2)、甲醇、二甲醚(CH3OCH3)被称为21世纪的新型燃料,二者均可利用CO和H2反应合成.①某燃料电池以二甲醚为原料,熔融碳酸盐为电解质,其负极反应如下:CH3OCH3+6CO32﹣﹣12e﹣═8CO2+3H2O.写出该燃料电池的正极反应式 .
②废水中含甲醇对水质会造成污染,Co3+可将甲醇氧化为CO2 . 某同学以Pt作电极电解酸性含甲醇废水与CoSO4混合液模拟工业除污原理,其阳极反应式 .
(3)、某企业采用如图所示原理处理化石燃料开采、加工过程产生H2S废气.①电解池中电极A、B均为惰性电极,其中A为电解池的极;电极B所得到的物质X的分子式为 .
②反应池中发生的离子反应方程式为 .
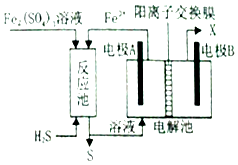 10. 碱式碳酸镁可用于牙膏、医药和化妆品等工业,化学式为4MgCO3•Mg (OH)2•5H2O,某碱式碳酸镁中含有SiO2杂质,为测定其纯度,某兴趣小组设计了如下方案:
10. 碱式碳酸镁可用于牙膏、医药和化妆品等工业,化学式为4MgCO3•Mg (OH)2•5H2O,某碱式碳酸镁中含有SiO2杂质,为测定其纯度,某兴趣小组设计了如下方案: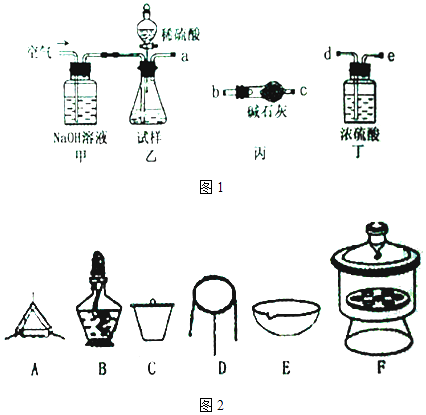
方案I 取一定质量的样品,与硫酸充分反应,通过测定生成CO2的质量计算纯度
(1)、乙中发生反应的方程式为 .(2)、仪器接口的连接顺序为(装置如图1可以重复使用)a , 丁的作用是 .(3)、当样品充分反应完后,缓慢通入空气的目的是 .(4)、方案 II①称取碱式碳酸镁样品mg;②将样品充分高温煅烧,冷却后称量;③重复操作②,测得剩余固体质量为m1g下列仪器如图2中,该方案不会用到的是 .
(5)、判断样品完全分解的方法是;本实验至少需要称量次.(6)、有同学认为方案 II高温煅烧的过程中会发生4MgCO3+SiO2 MgSiO3+CO2↑会导致测定结果有误,你认为这位同学的观点正确吗?(填“正确”或“错误”)请说明理由: .11. 硼(B)、铝(Al)、镓(Ga)均属于硼族元素(第ⅢA族),它们的化合物或单质都有重要用途.回答下列问题: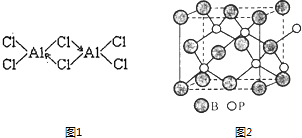 (1)、写出基态镓原子的电子排布式 .(2)、已知:无水氯化铝在178℃升华,它的蒸气是缔合的双分于(Al2Cl6),结构如图1缔合双分子Al2Cl6中Al原子的轨道杂化类型是 .(3)、B原子的电子有个不同的能级;晶体硼熔点为2300℃,则其为晶体.(4)、磷化硼(BP)是一种有价值的耐磨硬涂层材料,它是通过在高温氢气氛围下(>750℃)三溴化硼和三溴化磷反应制得.BP晶胞如图2所示.
(1)、写出基态镓原子的电子排布式 .(2)、已知:无水氯化铝在178℃升华,它的蒸气是缔合的双分于(Al2Cl6),结构如图1缔合双分子Al2Cl6中Al原子的轨道杂化类型是 .(3)、B原子的电子有个不同的能级;晶体硼熔点为2300℃,则其为晶体.(4)、磷化硼(BP)是一种有价值的耐磨硬涂层材料,它是通过在高温氢气氛围下(>750℃)三溴化硼和三溴化磷反应制得.BP晶胞如图2所示.①画出三溴化硼和三溴化磷的空间结构式.
三溴化硼三溴化磷
②在BP晶胞中B的堆积方式为 .
③计算当晶胞晶格参数为apm(即图中立方体的每条边长为apm)时,磷化硼中硼原子和磷原子之间的最近距离 .
12. 席夫碱类化合物G在催化、药物、新材料等方面有广泛应用.合成G的一种路线如下: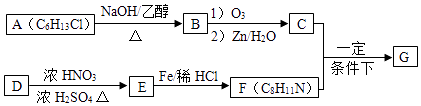
已知以下信息:
①
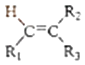 R1CHO+
R1CHO+ 
②1mol B经上述反应可生成2mol C,且C不能发生银镜反应
③D属于单取代芳烃,其相对分子质量为106
④核磁共振氢谱显示F苯环上有两种化学环境的氢原子
⑤RNH2+
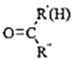
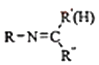 +H2O
+H2O回答下列问题:
(1)、C中官能团名称 , D的化学名称 .(2)、由A生成B的化学方程式为 .(3)、G的结构简式为 .(4)、F的同分异构体中含有苯环的还有种(不考虑立体异构),其中核磁共振氢谱有4组峰,且面积比为6:2:2:1的是(写出其中一种的结构简式).(5)、由苯及化合物C经如下步骤可合成N﹣异丙基苯胺: H I J
H I J 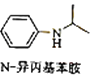
反应条件1所选择的试剂为 , H→I的反应类型为 .