2017年北京市西城区高考化学一模试卷
试卷更新日期:2017-08-19 类型:高考模拟
一、选择题
-
1. 景泰蓝是一种传统的手工艺品.下列制作景泰蓝的步骤中,不涉及化学变化的是( )
A
B
C
D
将铜丝压扁,掰成图案

将铅丹、硼酸盐等化合熔制后描绘

高温焙烧

酸洗去污
 A、A B、B C、C D、D2. 全氮类物质具有高密度、超高能量及爆轰产物无污染等优点.中国科学家成功合成全氮阴离子N5﹣ , N5﹣是制备全氮类物质N5+N5﹣的重要中间体.下列说法中,不正确的是( )A、全氮类物质属于绿色能源 B、每个N5+中含有35个质子 C、每个N5﹣中含有35个电子 D、N5+N5﹣结构中含共价键3. 下列实验方案中,可行的是( )A、用食醋除去热水瓶中的水垢 B、用米汤检验加碘盐中的碘酸钾(KIO3) C、向Al2(SO4)3溶液中加过量NaOH溶液,制Al(OH)3 D、向稀H2SO4催化水解后的麦芽糖溶液中直接加入新制Cu (OH)2悬浊液,检验水解产物4. 25℃时,0.1mol•L﹣1的3种溶液 ①盐酸 ②氨水 ③CH3COONa溶液.下列说法中,不正确的是( )A、3种溶液中pH最小的是① B、3种溶液中水的电离程度最大的是② C、①与②等体积混合后溶液显酸性 D、①与③等体积混合后c(H+)>c(CH3COO﹣)>c(OH﹣)5. 生铁在pH=2和pH=4的盐酸中发生腐蚀.在密闭容器中,用压强传感器记录该过程的压强变化,如图所示.下列说法中,不正确的是( )
A、A B、B C、C D、D2. 全氮类物质具有高密度、超高能量及爆轰产物无污染等优点.中国科学家成功合成全氮阴离子N5﹣ , N5﹣是制备全氮类物质N5+N5﹣的重要中间体.下列说法中,不正确的是( )A、全氮类物质属于绿色能源 B、每个N5+中含有35个质子 C、每个N5﹣中含有35个电子 D、N5+N5﹣结构中含共价键3. 下列实验方案中,可行的是( )A、用食醋除去热水瓶中的水垢 B、用米汤检验加碘盐中的碘酸钾(KIO3) C、向Al2(SO4)3溶液中加过量NaOH溶液,制Al(OH)3 D、向稀H2SO4催化水解后的麦芽糖溶液中直接加入新制Cu (OH)2悬浊液,检验水解产物4. 25℃时,0.1mol•L﹣1的3种溶液 ①盐酸 ②氨水 ③CH3COONa溶液.下列说法中,不正确的是( )A、3种溶液中pH最小的是① B、3种溶液中水的电离程度最大的是② C、①与②等体积混合后溶液显酸性 D、①与③等体积混合后c(H+)>c(CH3COO﹣)>c(OH﹣)5. 生铁在pH=2和pH=4的盐酸中发生腐蚀.在密闭容器中,用压强传感器记录该过程的压强变化,如图所示.下列说法中,不正确的是( )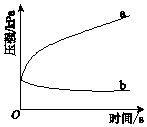 A、两容器中负极反应均为Fe﹣2e﹣═Fe2+ B、曲线a记录的是pH=2的盐酸中压强的变化 C、曲线b记录的容器中正极反应是O2+4e﹣+2H2O═4OH﹣ D、在弱酸性溶液中,生铁能发生吸氧腐蚀6. 某同学用Na2CO3和NaHCO3溶液进行如图所示实验.下列说法中,正确的是( )
A、两容器中负极反应均为Fe﹣2e﹣═Fe2+ B、曲线a记录的是pH=2的盐酸中压强的变化 C、曲线b记录的容器中正极反应是O2+4e﹣+2H2O═4OH﹣ D、在弱酸性溶液中,生铁能发生吸氧腐蚀6. 某同学用Na2CO3和NaHCO3溶液进行如图所示实验.下列说法中,正确的是( ) A、实验前两溶液的pH相等 B、实验前两溶液中离子种类完全相同 C、加入CaCl2溶液后生成的沉淀一样多 D、加入CaCl2溶液后反应的离子方程式都是CO32﹣+Ca2+═CaCO3↓7. 已知:CH3CH2CH2CH2OH CH3CH2CH2CHO
A、实验前两溶液的pH相等 B、实验前两溶液中离子种类完全相同 C、加入CaCl2溶液后生成的沉淀一样多 D、加入CaCl2溶液后反应的离子方程式都是CO32﹣+Ca2+═CaCO3↓7. 已知:CH3CH2CH2CH2OH CH3CH2CH2CHO利用如图装置用正丁醇合成正丁醛.相关数据如表:
物质
沸点/℃
密度/(g•cm﹣3)
水中溶解性
正丁醇
117.2
0.8109
微溶
正丁醛
75.7
0.8017
微溶
下列说法中,不正确的是( )
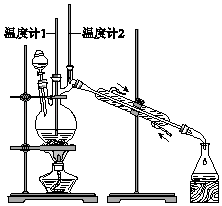 A、为防止产物进一步氧化,应将酸化的Na2Cr2O7溶液逐滴加入正丁醇中 B、当温度计1示数为90~95℃,温度计2示数在76℃左右时,收集产物 C、反应结束,将馏出物倒入分液漏斗中,分去水层,粗正丁醛从分液漏斗上口倒出 D、向获得的粗正丁醛中加入少量金属钠,检验其中是否含有正丁醇
A、为防止产物进一步氧化,应将酸化的Na2Cr2O7溶液逐滴加入正丁醇中 B、当温度计1示数为90~95℃,温度计2示数在76℃左右时,收集产物 C、反应结束,将馏出物倒入分液漏斗中,分去水层,粗正丁醛从分液漏斗上口倒出 D、向获得的粗正丁醛中加入少量金属钠,检验其中是否含有正丁醇二、解答题
-
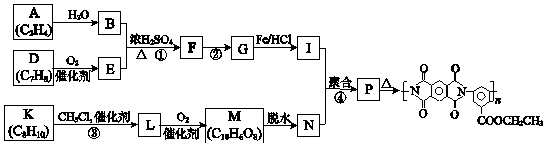
8. 聚酰亚胺是重要的特种工程材料,已广泛应用在航空、航天、纳米、液晶、激光等领域.某聚酰亚胺的合成路线如图(部分反应条件略去).
已知:
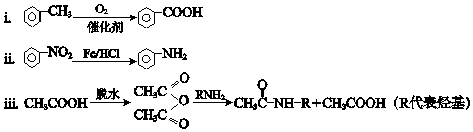 (1)、A所含官能团的名称是 .(2)、①反应的化学方程式是 .(3)、②反应的反应类型是 .(4)、I的分子式为C9H12O2N2 , I的结构简式是 .(5)、K是D的同系物,核磁共振氢谱显示其有4组峰,③的化学方程式是 .(6)、1mol M与足量的NaHCO3溶液反应生成4mol CO2 , M的结构简式是 .(7)、P的结构简式是 .9. As2O3在医药、电子等领域有重要应用.某含砷元素(As)的工业废水经如图1流程转化为粗As2O3 .
(1)、A所含官能团的名称是 .(2)、①反应的化学方程式是 .(3)、②反应的反应类型是 .(4)、I的分子式为C9H12O2N2 , I的结构简式是 .(5)、K是D的同系物,核磁共振氢谱显示其有4组峰,③的化学方程式是 .(6)、1mol M与足量的NaHCO3溶液反应生成4mol CO2 , M的结构简式是 .(7)、P的结构简式是 .9. As2O3在医药、电子等领域有重要应用.某含砷元素(As)的工业废水经如图1流程转化为粗As2O3 .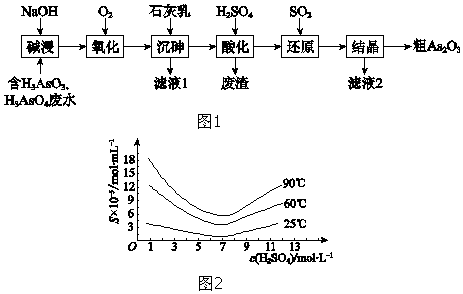 (1)、“碱浸”的目的是将废水中的H3AsO3和H3AsO4转化为盐.H3AsO4转化为Na3AsO4反应的化学方程式是 .(2)、“氧化”时,1mol AsO33﹣转化为AsO43﹣至少需要O2mol.(3)、“沉砷”是将砷元素转化为Ca5(AsO4)3OH沉淀,发生的主要反应有:
(1)、“碱浸”的目的是将废水中的H3AsO3和H3AsO4转化为盐.H3AsO4转化为Na3AsO4反应的化学方程式是 .(2)、“氧化”时,1mol AsO33﹣转化为AsO43﹣至少需要O2mol.(3)、“沉砷”是将砷元素转化为Ca5(AsO4)3OH沉淀,发生的主要反应有:a.Ca(OH)2(s)⇌Ca2+(aq)+2OH﹣(aq)△H<0
b.5Ca2++OH﹣+3AsO43﹣⇌Ca5(AsO4)3OH△H>0
研究表明:“沉砷”的最佳温度是85℃.
用化学平衡原理解释温度高于85℃后,随温度升高沉淀率下降的原因是 .
(4)、“还原”过程中H3AsO4转化为H3AsO3 , 反应的化学方程式是 .(5)、“还原”后加热溶液,H3AsO3分解为As2O3 , 同时结晶得到粗As2O3 . As2O3在不同温度和不同浓度硫酸中的溶解度(S)曲线如图2所示.为了提高粗As2O3的沉淀率,“结晶”过程进行的操作是 .(6)、下列说法中,正确的是(填字母).a.粗As2O3中含有CaSO4
b.工业生产中,滤液2可循环使用,提高砷的回收率
c.通过先“沉砷”后“酸化”的顺序,可以达到富集砷元素的目的.
10. 以黄铜矿(主要成分二硫化亚铁铜CuFeS2)为原料,用Fe2(SO4)3溶液作浸取剂提取铜,总反应的离子方程式是CuFeS2+4Fe3+⇌Cu2++5Fe2++2S.(1)、该反应中,Fe3+体现性.(2)、上述总反应的原理如图1所示.负极的电极反应式是 .(3)、一定温度下,控制浸取剂pH=1,取三份相同质量黄铜矿粉末分别进行如下实验:实验
操作
2小时后Cu2+浸出率/%
I
加入足量0.10mol•L﹣1 Fe2(SO4)3溶液
78.2
II
加入足量0.10mol•L﹣1 Fe2(SO4)3溶液,通入空气
90.8
III
加入足量0.10mol•L﹣1 Fe2(SO4)3溶液,再加入少量0.0005mol•L﹣1 Ag2SO4溶液
98.0
①对比实验 I、II,通入空气,Cu2+浸出率提高的原因是 .
②由实验 III推测,在浸取Cu2+过程中Ag+作催化剂,催化原理是:
ⅰ.CuFeS2+4Ag+═Fe2++Cu2++2Ag2S
ⅱ.Ag2S+2Fe3+═2Ag++2Fe2++S
为证明该催化原理,进行如下实验:
a.取少量黄铜矿粉末,加入少量0.0005mol•L﹣1 Ag2SO4溶液,充分混合后静置.取上层清液,加入稀盐酸,观察到溶液中 , 证明发生反应 i.
b.取少量Ag2S粉末,加入溶液,充分混合后静置.取上层清液,加入稀盐酸,有白色沉淀,证明发生反应 ii.
(4)、用实验 II的浸取液电解提取铜的原理如图2所示: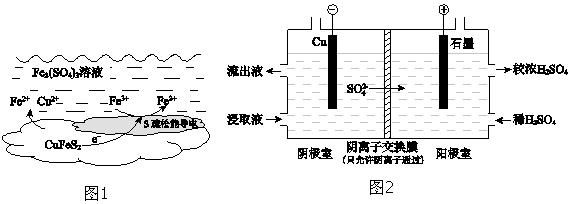
①电解初期,阴极没有铜析出.用电极反应式解释原因是 .
②将阴极室的流出液送入阳极室,可使浸取剂再生,再生的原理是 .
11. 某化学小组研究盐酸被氧化的条件,进行如下实验.(1)、研究盐酸被MnO2氧化.实验
操作
现象
I
常温下将MnO2和12mol•L﹣1浓盐酸混合
溶液呈浅棕色,略有刺激性气味
II
将 I中混合物过滤,加热滤液
生成大量黄绿色气体
III
加热MnO2和4mol•L﹣1稀盐酸混合物
无明显现象
①已知MnO2呈弱碱性. I中溶液呈浅棕色是由于MnO2与浓盐酸发生了复分解反应,化学方程式是 .
②II中发生了分解反应,反应的化学方程式是 .
③III中无明显现象的原因,可能是c(H+)或c(Cl﹣)较低,设计实验(图1)IV进行探究:
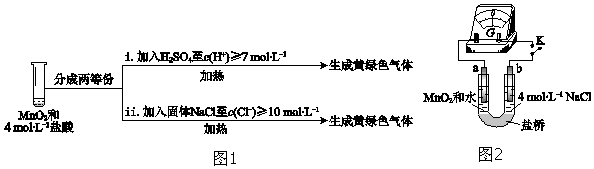
将实验 III、IV作对比,得出的结论是;将 i、ii作对比,得出的结论是 .
④用图2装置(a、b均为石墨电极)进行实验 V:
ⅰ.K闭合时,指针向左偏转
ⅱ.向右管中滴加浓H2SO4至c(H+)≥7mol•L﹣1 , 指针偏转幅度变化不大
ⅲ.再向左管中滴加浓H2SO4至c(H+)≥7mol•L﹣1 , 指针向左偏转幅度增大
将ⅰ和ⅱ、ⅲ作对比,得出的结论是 .
(2)、研究盐酸能否被氧化性酸氧化.①烧瓶中放入浓H2SO4 , 通过分液漏斗向烧瓶中滴加浓盐酸,烧瓶上方立即产生白雾,用湿润的淀粉KI试纸检验,无明显现象.由此得出浓硫酸(填“能”或“不能”)氧化盐酸.
②向试管中加入3mL浓盐酸,再加入1mL浓HNO3 , 试管内液体逐渐变为橙色,加热,产生棕黄色气体,经检验含有NO2 .
实验
操作
现象
I
将湿润的淀粉KI试纸伸入棕黄色气体中
试纸先变蓝,后褪色
II
将湿润的淀粉KI试纸伸入纯净Cl2中
试纸先变蓝,后褪色
III
…
…
通过实验 I、II、III证明混合气体中含有Cl2 , III的操作是 .
由上述实验得出:盐酸能否被氧化与氧化剂的种类、有关.