2015年高考化学真题试卷(上海卷)
试卷更新日期:2016-04-14 类型:高考真卷
一、选择题:本题共10小题,每小题2分,每题只有一个正确选项
-
1. 中国科学技术名词审定委员会已确定第116号元素Lv的名称为鉝。关于Lv的叙述错误的是( )
A、原子序数116 B、中子数177 C、核外电子数116 D、相对原子质量2932. 下列物质见光不会分解的是( )A、HClO B、NH4Cl C、HNO3 D、AgNO33. 某晶体中含有极性键,关于该晶体的说法错误的是( )A、不可能有很高的熔沸点 B、不可能是单质 C、可能是有机物 D、可能是离子晶体4. 不能作为判断硫、氯两种元素非金属性强弱的依据是( )A、单质氧化性的强弱 B、单质沸点的高低 C、单质与氢气化合的难易 D、最高价氧化物对应的水化物酸性的强弱5. 二氧化硫能使溴水褪色,说明二氧化硫具有( )A、还原性 B、氧化性 C、漂白性 D、酸性6. 将Na、Na2O、NaOH、Na2S、Na2SO4分别加热熔化,需要克服相同类型作用力的物质有( )A、2种 B、3种 C、4种 D、5种7. 检验用硫酸亚铁制得的硫酸铁中是否含有硫酸亚铁,可使用的试剂是( )A、NaOH B、KMnO4 C、KSCN D、 8.
8.已知H2O2在催化剂作用下分解速率加快,其能量随反应进程的变化如下图所示。下列说法正确的是( )
 A、加入催化剂,减小了反应的热效应 B、加入催化剂,可提高H2O2的平衡转化率 C、H2O2分解的热化学方程式:H2O2 → H2O +O2+Q D、反应物的总能量高于生成物的总能量9.
A、加入催化剂,减小了反应的热效应 B、加入催化剂,可提高H2O2的平衡转化率 C、H2O2分解的热化学方程式:H2O2 → H2O +O2+Q D、反应物的总能量高于生成物的总能量9.已知咖啡酸的结构如右图所示。关于咖啡酸的描述正确的是( )
 A、分子式为C9H5O4 B、1mol咖啡酸最多可与5mol氢气发生加成反应 C、与溴水既能发生取代反应,又能发生加成反应 D、能与Na2CO3溶液反应,但不能与NaHCO3溶液反应10. 卤代烃的制备有多种方法,下列卤代烃不适合由相应的烃经卤代反应制得的是( )A、
A、分子式为C9H5O4 B、1mol咖啡酸最多可与5mol氢气发生加成反应 C、与溴水既能发生取代反应,又能发生加成反应 D、能与Na2CO3溶液反应,但不能与NaHCO3溶液反应10. 卤代烃的制备有多种方法,下列卤代烃不适合由相应的烃经卤代反应制得的是( )A、 B、
B、 C、
C、 D、
D、 11. 下列有关物质性质的比较,错误的是( )A、溶解度:小苏打 < 苏打 B、密度:溴乙烷 > 水 C、硬度:晶体硅 < 金刚石 D、碳碳键键长:乙烯 > 苯12. 与氢硫酸反应有沉淀生成的电解质是( )A、硫酸铜 B、氢氧化钠 C、硫酸亚铁 D、二氧化硫13. 实验室回收废水中苯酚的过程如右图所示。下列分析错误的是( )
11. 下列有关物质性质的比较,错误的是( )A、溶解度:小苏打 < 苏打 B、密度:溴乙烷 > 水 C、硬度:晶体硅 < 金刚石 D、碳碳键键长:乙烯 > 苯12. 与氢硫酸反应有沉淀生成的电解质是( )A、硫酸铜 B、氢氧化钠 C、硫酸亚铁 D、二氧化硫13. 实验室回收废水中苯酚的过程如右图所示。下列分析错误的是( ) A、操作I中苯作萃取剂 B、苯酚钠在苯中的溶解度比在水中的大 C、通过操作II苯可循环使用 D、三步操作均需要分液漏斗14.
A、操作I中苯作萃取剂 B、苯酚钠在苯中的溶解度比在水中的大 C、通过操作II苯可循环使用 D、三步操作均需要分液漏斗14.研究电化学腐蚀及防护的装置如右图所示。下列有关说法错误的是( )
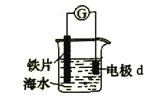 A、d为石墨,铁片腐蚀加快 B、d为石墨,石墨上电极反应为:O2 + 2H2O + 4e → 4OH– C、d为锌块,铁片不易被腐蚀 D、d为锌块,铁片上电极反应为:2H+ + 2e → H2↑15. 一般情况下,前者无法决定后者的是( )A、原子核外电子排布——元素在周期表中的位置 B、弱电解质的相对强弱——电离常数的大小 C、分子间作用力的大小——分子稳定性的高低 D、物质内部储存的能量——化学反应的热效应16. 短周期元素甲、乙、丙、丁的原子序数依次增大,甲和丁的原子核外均有两个未成对电子,乙、丙、丁最高价氧化物对应的水化物两两之间能相互反应。下列说法错误的是( )A、元素丙的单质可用于冶炼金属 B、甲与丁形成的分子中有非极性分子 C、简单离子半径:丁 > 乙 > 丙 D、甲与乙形成的化合物均有强氧化性17. 某无色溶液含有下列离子中的若干种:H+、NH4+、Fe3+、Ba2+、Al3+、CO32–、Cl–、OH–、NO3–。向该溶液中加入铝粉,只放出H2 , 则溶液中能大量存在的离子最多有( )
A、d为石墨,铁片腐蚀加快 B、d为石墨,石墨上电极反应为:O2 + 2H2O + 4e → 4OH– C、d为锌块,铁片不易被腐蚀 D、d为锌块,铁片上电极反应为:2H+ + 2e → H2↑15. 一般情况下,前者无法决定后者的是( )A、原子核外电子排布——元素在周期表中的位置 B、弱电解质的相对强弱——电离常数的大小 C、分子间作用力的大小——分子稳定性的高低 D、物质内部储存的能量——化学反应的热效应16. 短周期元素甲、乙、丙、丁的原子序数依次增大,甲和丁的原子核外均有两个未成对电子,乙、丙、丁最高价氧化物对应的水化物两两之间能相互反应。下列说法错误的是( )A、元素丙的单质可用于冶炼金属 B、甲与丁形成的分子中有非极性分子 C、简单离子半径:丁 > 乙 > 丙 D、甲与乙形成的化合物均有强氧化性17. 某无色溶液含有下列离子中的若干种:H+、NH4+、Fe3+、Ba2+、Al3+、CO32–、Cl–、OH–、NO3–。向该溶液中加入铝粉,只放出H2 , 则溶液中能大量存在的离子最多有( )
A、3种 B、4种 C、5种 D、6种二、多选题:本大题共20分,每小题4分
-
18. 下列反应中的氨与反应4NH3 + 5O2 → 4NO + 6H2O中的氨作用相同的是( )A、2Na + 2NH3 → 2NaNH2 + H2↑ B、2NH3 + 3CuO → 3Cu + N2 +3H2O C、4NH3 + 6NO → 5N2 + 6H2O D、3SiH4 + 4NH3 → Si3N4 + 12H219. 对于合成氨反应,达到平衡后,以下分析正确的是( )A、升高温度,对正反应的反应速率影响更大 B、增大压强,对正反应的反应速率影响更大 C、减小反应物浓度,对逆反应的反应速率影响更大 D、加入催化剂,对逆反应的反应速率影响更大20. 离子方程式2Ca2+ + 3HCO3– + 3OH– → 2CaCO3↓ + CO32– + 3H2O可以表示( )A、Ca(HCO3)2与NaOH溶液反应 B、NaHCO3与澄清石灰水反应 C、Ca(HCO3)2与澄清石灰水反应 D、NH4HCO3与澄清石灰水反应21. 工业上将Na2CO3和Na2S以1:2的物质的量之比配成溶液,再通入SO2 , 可制取Na2S2O3 , 同时放出CO2。在该反应中( )A、硫元素既被氧化又被还原 B、氧化剂与还原剂的物质的量之比为1:2 C、每生成1molNa2S2O3 , 转移4mol电子 D、相同条件下,每吸收10m3SO2就会放出2.5m3CO222. 将O2和NH3的混合气体448mL通过加热的三氧化二铬,充分反应后,再通过足量的水,最终收集到44.8mL气体。原混合气体中O2的体积可能是(假设氨全部被氧化;气体体积均已换算成标准状况)( )A、231.5mL B、268.8mL C、287.5mL D、313.6mL
三、探究题
-
23. 白云石的主要成分是CaCO3·MgCO3 , 在我国有大量的分布。以白云石为原料生产的钙镁系列产品有广泛的用途。白云石经煅烧、水化后得到钙镁的氢氧化物,再经过碳化实现Ca2+、Mg2+的分离。碳化反应是放热反应,化学方程式如下:Ca(OH)2 + Mg(OH)2 + 3CO2 ⇌ CaCO3 + Mg(HCO3)2 + H2O。
完成下列填空。
(1)、Ca(OH)2的碱性比Mg(OH)2的碱性 (选填“强”或“弱”), Ca(OH)2的溶解度比Mg(OH)2的溶解度 (选填“大”或“小”)(2)、碳化温度保持在50~60℃。温度偏高不利于碳化反应,原因是 、 。温度偏低也不利于碳化反应,原因是 。(3)、已知某次碳化时溶液中钙离子浓度随时间的变化如右图所示,在10 min到13 min之内钙离子的反 应速率为 。15 min之后钙离子浓度增大,原因是 (用化学方程式表示)。
 (4)、Mg原子核外电子排布式为 ;Ca原子最外层电子的能量 Mg原子最外层电子的能量。(选填“低于”、“高于”或“等于”)24.
(4)、Mg原子核外电子排布式为 ;Ca原子最外层电子的能量 Mg原子最外层电子的能量。(选填“低于”、“高于”或“等于”)24.氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品。下图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过。完成下列填空:

已知: H2SO3 Ki1=1.54×10-2 Ki2=1.02×10-7
HClO Ki1=2.95×10-8
H2CO3 Ki1=4.3×10-7 Ki2=5.6×10-11
(1)、写出电解饱和食盐水的离子方程式。(2)、离子交换膜的作用为: 、 。(3)、精制饱和食盐水从图中 位置补充,氢氧化钠溶液从图中 位置流出。(选填“a”、“b”、“c”或“d”)(4)、KClO3可以和草酸(H2C2O4)、硫酸反应生成高效的消毒杀菌剂ClO2 , 还生成CO2和KHSO4等物质。写出该反应的化学方程式
(5)、室温下,0.1 mol/L NaClO溶液的pH 0.1 mol/L Na2SO3溶液的pH。(选填“大于”、“小于”或“等于”)。浓度均为0.1 mol/L 的Na2SO3和Na2CO3的混合溶液中,SO32–、CO32–、HSO3–、HCO3– 浓度从大到小的顺序为 。
25. 过氧化钙(CaO2)是一种白色、无毒、难溶于水的固体,能杀菌消毒,广泛用于果蔬保鲜、空气净化、污水处理等方面。工业生产过程如下:①在NH4Cl溶液中加入Ca(OH)2;
②不断搅拌的同时加入30% H2O2 , 反应生成CaO2·8H2O沉淀;
③经过陈化、过滤,水洗得到CaO2·8H2O,再脱水干燥得到CaO2。
完成下列填空
(1)、第①步反应的化学方程式为 。第②步反应的化学方程式为 。(2)、可循环使用的物质是 。工业上常采用Ca(OH)2过量而不是H2O2过量的方式来生产,这是因为 。(3)、检验CaO2·8H2O是否洗净的方法是 。(4)、CaO2·8H2O加热脱水的过程中,需不断通入不含二氧化碳的氧气,目的是 、 。(5)、已知CaO2在350℃迅速分解生成CaO和O2。下图是实验室测定产品中CaO2含量的装置(夹持装置省略)。

若所取产品质量是m g,测得气体体积为V mL(已换算成标准状况),则产品中CaO2的质量分数为 (用字母表示)。
过氧化钙的含量也可用重量法测定,需要测定的物理量有 。
26. 甲醛是深受关注的有机化合物。甲醛含量的测定有多种方法,例如:在调至中性的亚硫酸钠溶液中加入甲醛水溶液,经充分反应后,产生的氢氧化钠的物质的量与甲醛的物质的量相等,然后用已知浓度的硫酸滴定氢氧化钠。完成下列填空:(1)、将4.00 mL甲醛水溶液加入到经调至中性的亚硫酸钠溶液中,充分反应后,用浓度为1.100 mol/L的硫酸滴定,至终点时耗用硫酸20.00 mL。甲醛水溶液的浓度为 mol/L。(2)、上述滴定中,若滴定管规格为50mL,甲醛水溶液取样不能超过 mL。(3)、工业甲醛含量测定的另一种方法:在甲醛水溶液中加入过氧化氢,将甲醛氧化为甲酸,然后用已知浓度的氢氧化钠溶液滴定。HCHO + H2O2 → HCOOH + H2O NaOH + HCOOH → HCOONa + H2O
已知H2O2能氧化甲酸生成二氧化碳和水。
如果H2O2用量不足,会导致甲醛含量的测定结果 (选填“偏高”、“偏低”或“不受影响”),因为 ;如果H2O2过量,会导致甲醛含量的测定结果 (选填“偏高”、“偏低”或“不受影响”),因为 。
(4)、甲醛和新制氢氧化铜的反应显示了甲醛的还原性,发生反应的化学方程式通常表示如下:
HCHO + 2Cu(OH)2
 HCOOH + Cu2O↓ + 2H2O
HCOOH + Cu2O↓ + 2H2O若向足量新制氢氧化铜中加入少量甲醛,充分反应,甲醛的氧化产物不是甲酸或甲酸盐,设计一个简单实验验证这一判断。
①主要仪器:试管 酒精灯
②可供选用的试剂:硫酸铜溶液、甲醛、甲酸、氢氧化钠溶液
27.对溴苯乙烯与丙烯的共聚物是一种高分子阻燃剂,具有低毒、热稳定性好等优点。
完成下列填空:(合成路线常用的表示方式为:
 )(1)、写出该共聚物的结构简式(2)、
)(1)、写出该共聚物的结构简式(2)、实验室由乙苯制取对溴苯乙烯,需先经两步反应制得中间体
 。
。
写出该两步反应所需的试剂及条件。(3)、将
 与足量氢氧化钠溶液共热得到A,A在酸性条件下遇FeCl3溶液不显色。
与足量氢氧化钠溶液共热得到A,A在酸性条件下遇FeCl3溶液不显色。A的结构简式为 。
由上述反应可推知 。
由A生成对溴苯乙烯的反应条件为 。
(4)、丙烯催化二聚得到2,3-二甲基-1-丁烯,B与2,3-二甲基-1-丁烯互为同分异构体,且所有碳原子处于同一平面。写出B的结构简式。设计一条由2,3-二甲基-1-丁烯制备B的合成路线。
28.局部麻醉药普鲁卡因E(结构简式为
 )的三条合成路线如下图所示(部分反应试剂和条件已省略):(1)、比A多一个碳原子,且一溴代物只有3种的A的同系物的名称是 。(2)、写出反应试剂和反应条件。反应① ;③(3)、设计反应②的目的是 。(4)、B的结构简式为 ;C的名称是 。(5)、写出一种满足下列条件的D的同分异构体的结构简式。
)的三条合成路线如下图所示(部分反应试剂和条件已省略):(1)、比A多一个碳原子,且一溴代物只有3种的A的同系物的名称是 。(2)、写出反应试剂和反应条件。反应① ;③(3)、设计反应②的目的是 。(4)、B的结构简式为 ;C的名称是 。(5)、写出一种满足下列条件的D的同分异构体的结构简式。①芳香族化合物 ②能发生水解反应 ③有3种不同化学环境的氢原子
1 mol该物质与NaOH溶液共热最多消耗 mol NaOH。
(6)、普鲁卡因的三条合成路线中,第一条合成路线与第二条、第三条相比不太理想,理由是 。四、本题共14分
-
29. 氨碱法制纯碱包括石灰石分解、粗盐水精制、氨盐水碳酸化等基本步骤。
完成下列计算:
(1)、CaCO3质量分数为0.90的石灰石100 kg完成分解产生CO2 L(标准状况)。石灰窑中,该石灰石100 kg与焦炭混合焙烧,产生CO2 29120 L(标准状况),如果石灰石中碳酸钙完全分解,且焦炭完全燃烧,不产生CO,则焦炭的物质的量为 mol。(2)、已知粗盐水含MgCl2 6.80 mol/m3 , 含CaCl2 3.00mol/m3。向粗盐水中加入Ca(OH)2除镁离子:MgCl2 + Ca(OH)2 → Mg(OH)2↓ + CaCl2
然后加入Na2CO3除钙离子。处理上述粗盐水10 m3 , 至少需要加Na2CO3 g。
如果用碳酸化尾气(含NH3体积分数为0.100、CO2体积分数0.040)代替碳酸钠,发生如下反应: Ca2+ + 2NH3 + CO2 + H2O → CaCO3↓ + 2NH4+
处理上述10 m3粗盐水至少需要通入多少L(标准状况)碳酸化尾气?列式计算。
(3)、某氨盐水含氯化钠1521 kg,通入二氧化碳后析出碳酸氢钠晶体,过滤后溶液中含氯化铵1070 kg。列式计算:(1)过滤后溶液中氯化钠的质量。
(2)析出的碳酸氢钠晶体的质量。