浙江省湖州市高中联盟2018-2019学年高一下学期化学期中考试试卷
试卷更新日期:2020-03-03 类型:期中考试
一、单选题
-
1. 根据物质的组成和分类,MgCl2属于( )A、氧化物 B、酸 C、碱 D、盐2. 下列仪器名称为“容量瓶”的是( )A、
 B、
B、 C、
C、 D、
D、 3. 下列物质中,易溶于水的是( )A、CuO B、BaCO3 C、AgCl D、K2SO44. 硅是现代信息材料的核心元素。硅在元素周期表中处( )A、第ⅡA族 B、第ⅣA族 C、第VIA族 D、第ⅤA族5. 分离汽油和水的混合物,合理的分离方法是( )A、过滤 B、蒸发 C、萃取 D、分液6. 反应C+2H2SO4(浓) CO2↑+2SO2↑+2H2O中,作还原剂是( )A、 B、C C、 D、7. 下列不属于电解质的是( )A、CH3CH2OH B、NaOH C、CH3COOH D、Na2SO48. 下列化学用于表述正确的是( )A、HCl的电子式:
3. 下列物质中,易溶于水的是( )A、CuO B、BaCO3 C、AgCl D、K2SO44. 硅是现代信息材料的核心元素。硅在元素周期表中处( )A、第ⅡA族 B、第ⅣA族 C、第VIA族 D、第ⅤA族5. 分离汽油和水的混合物,合理的分离方法是( )A、过滤 B、蒸发 C、萃取 D、分液6. 反应C+2H2SO4(浓) CO2↑+2SO2↑+2H2O中,作还原剂是( )A、 B、C C、 D、7. 下列不属于电解质的是( )A、CH3CH2OH B、NaOH C、CH3COOH D、Na2SO48. 下列化学用于表述正确的是( )A、HCl的电子式: B、S2―的离子结构示意图:
B、S2―的离子结构示意图:  C、乙烯的分子式:C2H4
D、质子数为6、中子数为8的碳原子:86C
9. 下列说法不正确的是( )A、 和 互为同位素 B、红磷和白磷互为同素异形体 C、 和 互为同系物 D、 和 互为同分异构体10. 下列说法不正确的是( )A、钠和钾的合金在常温下是液体,可用于快中子反应堆的热交换剂 B、氯化铁、硫酸亚铁是优良的净水剂 C、碳酸钡可作为检查肠胃的内服药剂,俗称“钡餐” D、乙醇可以直接作为燃料,也可以和汽油混合后作发动机燃料11. 短周期元素X、Y、Z、W在周期表中的相对位置如图所示,已知X原子的最外层电子数为4。下列说法正确的是( )
C、乙烯的分子式:C2H4
D、质子数为6、中子数为8的碳原子:86C
9. 下列说法不正确的是( )A、 和 互为同位素 B、红磷和白磷互为同素异形体 C、 和 互为同系物 D、 和 互为同分异构体10. 下列说法不正确的是( )A、钠和钾的合金在常温下是液体,可用于快中子反应堆的热交换剂 B、氯化铁、硫酸亚铁是优良的净水剂 C、碳酸钡可作为检查肠胃的内服药剂,俗称“钡餐” D、乙醇可以直接作为燃料,也可以和汽油混合后作发动机燃料11. 短周期元素X、Y、Z、W在周期表中的相对位置如图所示,已知X原子的最外层电子数为4。下列说法正确的是( ) A、元素Z的主要化合价:-2、+6 B、原子半径:X>Y>Z C、最低价气态氢化物的稳定性:W>Z D、最高价氧化物对应的水化物的酸性:X>Y12. 下列方程式正确的是( )A、小苏打与盐酸反应的离子方程式: B、乙烯与氯化氢加成的化学方程式: C、碳酸钾在水中的电离方程式: D、醋酸钠水解的离子方程式:13. 下列实验操作对应的现象不符合事实的是( )
A、元素Z的主要化合价:-2、+6 B、原子半径:X>Y>Z C、最低价气态氢化物的稳定性:W>Z D、最高价氧化物对应的水化物的酸性:X>Y12. 下列方程式正确的是( )A、小苏打与盐酸反应的离子方程式: B、乙烯与氯化氢加成的化学方程式: C、碳酸钾在水中的电离方程式: D、醋酸钠水解的离子方程式:13. 下列实验操作对应的现象不符合事实的是( )



A.少量二氧化硫通入氯化钡溶液中,产生白色沉淀亚硫酸钡
B.在新制Cu(OH)2悬浊液中加入少量的葡萄糖,加热,产生砖红色沉淀
C.将少量钠投入到无水乙醇中,钠表面有气泡产生
D.在盛水的烧杯中加入氯化钠固体,小灯泡会逐渐亮起来
A、A B、B C、 D、D14. 下列说法不正确的是( )A、甲烷可在光照条件下与氯气发生取代反应 B、工业上通过石油的裂化获得乙烯,乙烯能使溴水褪色 C、等质量的乙炔和苯完全燃烧,消耗氧气的量相等 D、苯为不饱和烃,苯分子中的六个碳原子和六个氢原子在同一平面上15. 下列说法不正确的是( )A、食用植物油的主要成分是不饱和高级脂肪酸甘油酯,是一类重要的营养物质 B、含淀粉或纤维素的物质可以制造酒精 C、向蛋白质溶液中分别加入硫酸铜、硫酸铵的浓溶液都可以发生盐析 D、不同种类的氨基酸能以不同的数目和顺序彼此结合,形成更复杂的多肽化合物16. 硫代硫酸钠溶液与稀硫酸反应的化学方程式为: Na2S2O3+ H2SO4=Na2SO4+SO2+S↓+H2O,下列各组实验中最先出现浑浊的是( )实验
反应温度/℃
Na2S2O3溶液
稀H2SO4
H2O
V/mL
c/(mol·L-1)
V/mL
c/(mol·L-1)
V/mL
A
25
5
0.1
10
0.1
5
B
25
5
0.2
5
0.2
10
C
35
5
0.1
10
0.1
5
D
35
5
0.2
5
0.2
10
A、A B、B C、C D、D17. 银锌纽扣电池,其电池的电池反应式为:Zn + Ag2O + H2O =Zn(OH)2 + 2Ag
下列说法不正确的是( )
A、锌作负极 B、正极发生还原反应 C、电池工作时,电流从Ag2O经导线流向Zn D、负极的电极方程式为:Zn-2e- = Zn2+18. 下列说法不正确的是( )A、pH<7的溶液不一定呈酸性 B、在相同温度下,物质的量浓度相等的氨水、NaOH溶液,c(OH-)相等 C、在相同温度下,pH相等的盐酸、CH3COOH溶液,c(Cl-)=c(CH3COO-) D、在相同温度下,等物质的量浓度的氨水和盐酸等体积混合,所得溶液呈酸性19. 下列说法正确的是( )A、H2SO4 和Ca(OH)2含有化学键类型相同 B、水分子很稳定,是因为水分子的分子间作用力强 C、二氧化碳和乙烯的碳原子的最外电子层都具有8电子稳定结构 D、冰和水晶都是分子晶体20. 已知拆开1molH2(g)中的H-H键需要消耗436kJ能量,如图反应3H2(g)+N2(g) 2NH3(g)的能量变化示意图.下列说法不正确的是( ) A、断开1 mol N2(g)中的N
A、断开1 mol N2(g)中的N N键要吸收941 kJ能量
B、生成2mol NH3(g)中的N-H键吸收2346 kJ能量
C、3H2(g) + N2(g) 2NH3(g) △H=-97
D、NH3(g) 3/2H2(g) +1/2 N2(g) △H=48.5
21. 用NA表示阿伏加德罗常数,N表示微粒数,下列说法正确的是( )A、7.8 g苯含有碳碳双键的数目为0.3NA B、标准状况下,足量的Fe与2.24 L Cl2反应转移电子的数目为0.3NA C、1.6 g CH4含有共用电子对的数目为0.4NA D、常温下1 L pH=2的稀硫酸中H+的数目为0.02NA22. 在一体积2L的密闭容器中加入反应物N2、H2 , 发生如下反应:N2(g)+3H2(g) 2NH3(g)。反应过程中的部分数据如下表所示,下列说法正确的是( )
N键要吸收941 kJ能量
B、生成2mol NH3(g)中的N-H键吸收2346 kJ能量
C、3H2(g) + N2(g) 2NH3(g) △H=-97
D、NH3(g) 3/2H2(g) +1/2 N2(g) △H=48.5
21. 用NA表示阿伏加德罗常数,N表示微粒数,下列说法正确的是( )A、7.8 g苯含有碳碳双键的数目为0.3NA B、标准状况下,足量的Fe与2.24 L Cl2反应转移电子的数目为0.3NA C、1.6 g CH4含有共用电子对的数目为0.4NA D、常温下1 L pH=2的稀硫酸中H+的数目为0.02NA22. 在一体积2L的密闭容器中加入反应物N2、H2 , 发生如下反应:N2(g)+3H2(g) 2NH3(g)。反应过程中的部分数据如下表所示,下列说法正确的是( )物质的量/ mol
时间/min
n(N2)
n(H2)
n(NH3)
0
1.0
1.2
0
2
0.9
4
0.75
6
0.3
A、0~2 min内,NH3的反应速率为0.1 mol·Lˉ1·minˉ1 B、2 min时, H2的物质的量0.3 mol C、4 min时,反应已达到平衡状态,此时正、逆反应的速率都为0 D、4~6 min内,容器内气体分子的总物质的量不变23. 通过海水晾晒可以得到粗盐,粗盐除还有NaCl外,还含有MgCl2、 CaCl2、 Na2SO4以及泥沙等杂质。以下是某兴趣小组制备精盐的实验方案,各步操作流程如下。下列说法正确的是( )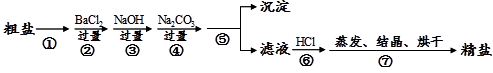 A、实验过程中①、⑤步骤的操作分别是溶解、过滤 B、实验过程中步骤④的目的是仅除去溶液中的Ca2+ C、实验过程中步骤⑦中的蒸发所用到的仪器是酒精灯、玻璃棒、烧杯、铁架台(带铁圈) D、实验过程中②、④步骤互换,对实验结果不影响24. 向NaOH和Na2CO3混合溶液中滴加0.1mol·L-1稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示。下列判断正确的是( )
A、实验过程中①、⑤步骤的操作分别是溶解、过滤 B、实验过程中步骤④的目的是仅除去溶液中的Ca2+ C、实验过程中步骤⑦中的蒸发所用到的仪器是酒精灯、玻璃棒、烧杯、铁架台(带铁圈) D、实验过程中②、④步骤互换,对实验结果不影响24. 向NaOH和Na2CO3混合溶液中滴加0.1mol·L-1稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示。下列判断正确的是( ) A、在0~a范围内,只发生中和反应 B、a=0.3 C、ab段发生反应的离子方程式为CO32-+2H+=CO2↑+H2O D、原混合溶液中NaOH与Na2CO3的物质的量之比为1∶225. 为确定试样Fe2O3、Cu、Fe混合物中铜的质量分数,某同学取质量为ag的试样进行下列实验,所得气体数据在标准状况下测得,所涉及的过程如下:
A、在0~a范围内,只发生中和反应 B、a=0.3 C、ab段发生反应的离子方程式为CO32-+2H+=CO2↑+H2O D、原混合溶液中NaOH与Na2CO3的物质的量之比为1∶225. 为确定试样Fe2O3、Cu、Fe混合物中铜的质量分数,某同学取质量为ag的试样进行下列实验,所得气体数据在标准状况下测得,所涉及的过程如下:
注:已知:Fe3+、Fe2+、Cu2+转化为相应的氢氧化物,开始沉淀和沉淀完全时的pH如下表:
氢氧化物
Fe3+
Fe2+
Cu2+
开始沉淀PH
2.5
7.0
4.7
完全沉淀PH
3.7
9.0
6.7
下列说法不正确的是( )
A、气体B为氢气 B、溶液A中所含的阳离子可能是H+ 、 Fe3+ 、 Fe2+、 Cu2+ C、加入过氧化氢溶液时发生的反应:2Fe2++H2O2+2H+=2Fe3++2H2O D、若沉淀E经洗涤、烘干、灼烧后得到固体mg,则试样中Cu的质量分数=(a-m-0.56)/a×100%二、填空题
-
26.(1)、①写出乙炔的结构式;②写出水玻璃中溶质的化学式。(2)、写出二氧化锰与浓盐酸共热反应的化学方程式:。
三、计算题
-
27. 分别称取2.39g(NH4)2SO4和NH4Cl固体混合物两份。(1)、将其中一份配成溶液,逐滴加入一定浓度的Ba(OH)2溶液,产生的沉淀质量与加入Ba(OH)2溶液体积的关系如图。混合物中n[(NH4)2SO4]:n(NH4Cl)为。
 (2)、另一份固体混合物中NH4+与Ba(OH)2溶液(浓度同上)恰好完全反应时,溶液中c(Cl-)=(溶液体积变化忽略不计)。
(2)、另一份固体混合物中NH4+与Ba(OH)2溶液(浓度同上)恰好完全反应时,溶液中c(Cl-)=(溶液体积变化忽略不计)。四、推断题
-
28. 有机物A是基本的有机化工原料,A与CO、H2O以物质的量1:1:1的比例生成B。B、C两物质中的官能团分别具有乙酸、乙醇中官能团的性质。D是有芳香味、不溶于水的油状液体。有关物质的转化关系如下:

请回答:
(1)、A的结构简式(2)、B + C → D的化学方程式(3)、下列说法不正确的是 ___________________A、有机物A能使酸性高锰酸钾溶液褪色 B、有机物B与乙酸互为同系物 C、有机物B,C都能与金属钠反应,且等物质的量的B,C与足量钠反应产生氢气质量相等 D、可用NaOH溶液来除去有机物D中混有的杂质B29. 为探究某固体氧化物A(仅含两种元素)的组成和性质,设计并完成如下实验。请回答: (1)、固体A的化学式。(2)、单质B在氯气中反应的现象。(3)、写出C→D在溶液中发生氧化还原反应的离子方程式。
(1)、固体A的化学式。(2)、单质B在氯气中反应的现象。(3)、写出C→D在溶液中发生氧化还原反应的离子方程式。五、实验题
-
30. 为确定碳酸钠和碳酸氢钠混合样品中碳酸钠的质量分数,可通过加热分解得到的CO2质量进行计算,某同学设计的实验装置示意图如下:

请回答:
(1)、仪器a的名称是。(2)、装置B中冰水的作用是。(3)、该同学设计的实验装置存在缺陷,有关该实验装置及实验过程中,下列因素可能使碳酸钠的质量分数偏高的是______。A、样品分解不完全 B、装置 B、C之间缺少CO2的干燥装置 C、产生CO2气体的速率太快,没有被碱石灰完全吸收 D、反应完全后停止加热,通入过量的空气
-
-