广东省深圳四校发展联盟体2018-2019学年高一下学期化学期中考试试卷
试卷更新日期:2020-03-03 类型:期中考试
一、单选题
-
1. 下列说法不正确的是( )A、元素周期表有7个主族,7个副族,1个0族,1个第Ⅷ族,共18纵行 B、元素周期表中的所有过渡元素都是金属元素,过渡元素包含副族和第Ⅷ族 C、第IA族又叫碱金属元素,第VIIA族元素又叫卤族元素 D、X2+ 的核外电子数目为18,则X在第四周期第ⅡA族2. 下列递变规律正确的是( )A、密度:Cs>Rb>K>Na>Li B、还原性:Mg>Na>Al C、碱性:KOH>NaOH>LiOH D、还原性:Cl- >Br- > I-3. 下列反应既属于氧化还原反应,又是吸热反应的是( )A、碳在高温下与水蒸气反应 B、Ba(OH)2·8H2O 与 NH4Cl 的反应 C、锌与稀盐酸的反应 D、稀盐酸与NaOH溶液的反应4. 德国重离子研究中心人工合成的第 112 号元素的正式名称为“Copernicium”,相应的元素符号为“Cn” 。该元素的名称是为了纪念天文学家哥白尼而得名。该中心人工合成 Cn的过程可表示为:7030Zn+20882Pb=22782Cn+10n下列叙述中正确的是( )A、上述合成过程属于化学变化 B、Cn 元素的相对原子质量为 277 C、22782Cn的原子核内中子数比质子数多 53 D、Cn 元素位于元素周期表的第六周期,是副族元素5. 下列变化不需要破坏化学键的是( )A、加热分解氯化铵 B、氯化氢溶于水 C、水通电分解 D、碘单质升华6. 下列说法正确的是( )A、I的原子半径大于Br,HI比HBr的热稳定性强 B、P的非金属性强于Si,H3PO4比H2SiO3的酸性强 C、HClO具有强还原性,可用于自来水的消毒杀菌 D、SO2和SO3混合气体通入Ba(NO3)2溶液可得到BaSO3和BaSO47. 下列叙述中正确的是 ( )A、液溴易挥发,在存放液溴的试剂瓶中应加水封 B、能使润湿的淀粉KI试纸变成蓝色的物质一定是Cl2 C、某溶液加入CCl4 , CCl4层显紫色,证明原溶液中存在I- D、某溶液加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀,该溶液一定含有Ag+8. 下列关于氮及其化合物的说法不正确的是( )A、N2化学性质稳定,可用作保护气 B、NO、NO2均为大气污染气体,在大气中可稳定存在 C、可用浓盐酸检测输送NH3的管道是否发生泄漏 D、HNO3具有强氧化性,可溶解铜、银等不活泼金属9. 下列事实与浓硫酸表现出的性质(括号中)对应关系正确的是( )A、在空气中敞口久置的浓硫酸,溶液质量增大(难挥发性) B、在加热条件下铜与浓硫酸反应(强氧化性、酸性) C、蔗糖与浓硫酸反应中有海绵状的炭生成(吸水性) D、浓硫酸与少量胆矾晶体混合,晶体由蓝色变成白色(脱水性)10. 元素X、Y、Z原子序数之和为36,X、Y在同一周期, X+与Z2-具有相同的核外电子层结构。下列推测不正确的是( )A、三种元素按原子个数比1:1:1所形成的化合物含有共价键 B、同周期元素中Y的最高价含氧酸的酸性最强 C、 、 Z 形成的化合物一定只含离子键 D、离子半径:Y> Z> X11. 实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )

选项
a中的物质
b中的物质
c中收集的气体
d中的物质
A
浓氨水
CaO
NH3
H2O
B
浓盐酸
MnO2
Cl2
NaOH溶液
C
稀硝酸
Cu
NO2
H2O
D
浓硫酸
Na2SO3
SO2
NaOH溶液
A、A B、B C、C D、D12. 如图所示,将SO2通入下列不同溶液中,实验现象与所得结论均正确的是( )溶液
实验现象
实验结论

A
NaOH溶液
无明显现象
SO2与NaOH
溶液不反应
B
H2S溶液
产生黄色沉淀
SO2有氧化性
C
酸性KMnO4溶液
紫色溶液褪色
SO2有漂白性
D
紫色石蕊试液
溶液先变红,
后褪色
SO2的水溶液呈酸性,
且SO2有漂白性
A、A B、B C、C D、D13. 利用二氧化铈(CeO2)在太阳能的作用下将H2O、CO2转变成H2、CO。其过程如下:mCeO2 (m-x)CeO·xCe+xO2、(m-x)CeO2·xCe+xH2O+xCO2 mCeO2+xH2+xCO。下列说法不正确的是( )A、CeO2·xCe是该反应的催化剂 B、该过程中CeO2没有消耗 C、该过程实现了太阳能向化学能的转化 D、O2在第一个反应中作氧化产物14. 如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化。下列说法不正确的是( ) A、通常情况下,N2比NO稳定 B、“雷雨发庄稼”中涉及到N2(g)和O2(g)的反应 C、1mol N2(g)和1mol O2(g)反应吸收的能量为179.3kJ D、NO是酸性氧化物,可直接用氢氧化钠溶液吸收而除去15. 现有W、X、Y、Z四种短周期元素,W分别于X、Y、 Z结合生成甲、 乙、丙三种化合物,且每个甲、乙、丙分子中均含10个电子,Y和Z化合生成丁,有关物质的转化关系如下图所示。下列说法不正确的是( )
A、通常情况下,N2比NO稳定 B、“雷雨发庄稼”中涉及到N2(g)和O2(g)的反应 C、1mol N2(g)和1mol O2(g)反应吸收的能量为179.3kJ D、NO是酸性氧化物,可直接用氢氧化钠溶液吸收而除去15. 现有W、X、Y、Z四种短周期元素,W分别于X、Y、 Z结合生成甲、 乙、丙三种化合物,且每个甲、乙、丙分子中均含10个电子,Y和Z化合生成丁,有关物质的转化关系如下图所示。下列说法不正确的是( ) A、原子序数由小到大的顺序是:W<Z<Y<X B、Z的最高价氧化物对应的水化物一定为强酸 C、元素的非金属性:W<Z<Y<X D、Y与W、Z都能形成两种或两种以上的化合物
A、原子序数由小到大的顺序是:W<Z<Y<X B、Z的最高价氧化物对应的水化物一定为强酸 C、元素的非金属性:W<Z<Y<X D、Y与W、Z都能形成两种或两种以上的化合物二、推断题
-
16. 非金属单质A经如图所示的过程转化为含氧酸D,已知D为强酸,请回答下列问题。
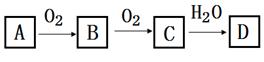 (1)、若A在常温下为固体,B是能使品红溶液褪色的有刺激性气味的无色气体。
(1)、若A在常温下为固体,B是能使品红溶液褪色的有刺激性气味的无色气体。①D的化学式是;
②在工业生产中,B气体的大量排放被雨水吸收后形成了而污染了环境。
(2)、若A在常温下为气体,C是红棕色的气体。①A、C的化学式分别是:A;C 。
②请写出C→D的反应化学方程式 。该反应与中,氧化剂与还原剂的物质的量之比为。
三、填空题
-
17. 下表是元素周期表的一部分,请用标出的元素回答有关问题:
主族
周期
IA
IIA
IIIA
IVA
VA
VIA
VIIA
0
2
①
②
③
3
④
⑤
⑥
⑦
⑧
4
⑨
⑩
(1)、表中给出的化学性质最不活泼的元素,其原子结构示意图为 。(2)、表中能形成两性氢氧化物的元素是 (用元素符号表示),写出该元素形成的单质与⑨最高价氧化物对应的水化物反应的离子方程式:。(3)、用电子式表示④元素与⑦元素形成化合物的过程 。(4)、写出②的最高价氧化物对应的水化物与其简单气态氢化物反应的生成物的化学式 。(5)、③元素与⑩元素两者核电荷数之差是 。(6)、为探究元素性质的递变规律,某化学兴趣小组将NaOH 溶液与NH4Cl 溶液混合生成NH3·H2O,从而验证NaOH 的碱性大于NH3·H2O,继而可以验证Na的金属性大于N,你认为此设计是否合理?并说明理由。 ; 。四、实验题
-
18. 氮元素形成的化合物种类十分丰富。(1)、请回答下列有关NH3的问题:
①实验室常用NH4Cl与Ca(OH)2制取氨气,该反应的化学方程式为:
②欲收集一瓶干燥的氨气,选择下图中的装置,其连接顺序为:a → (按气流方向,用小写字母表示)。

③ 氨气的催化氧化的化学方程式为
(2)、工业生产中利用氨水吸收SO2和NO2 ,原理如下图所示
写出 NO2 被吸收过程的离子方程式: 。
19. 氯气与碱溶液反应,在低温、稀碱溶液中主要产物是ClO-和Cl- , 在75℃以上、浓碱溶液中主要产物是ClO3-和Cl-。研究小组用如下实验装置制取氯酸钾(KClO3),并测定其纯度。(夹持装置已省略)
a为浓盐酸,b为MnO2 , c为饱和食盐水, d为30%KOH溶液,e为NaOH溶液
回答下列问题:
(1)、检查装置气密性后,添加药品,待装置III水温升至75℃开始反应。①装置I中反应的化学方程式为 。
②若取消装置II,对本实验的影响是 。
③实验结束,拆解装置I前为了防止大量氯气逸出,可采取的措施是。
④从装置III的试管中分离得到KClO3粗产品,其中混有的杂质是KClO和。
(2)、为测定产品KClO3的纯度,进行如下实验:步骤1:取2.45g样品溶于水配成250mL溶液。
步骤2:取25.00mL溶液于锥形瓶中,调至pH=10, 滴加足量H2O2溶液充分振荡以除尽ClO-。然后煮沸溶液1~2分钟,冷却。
步骤3:加入过量KI溶液,再逐滴加入足量稀硫酸。(ClO3-+6I-+6H+=Cl-+3I2+3H2O)
步骤4:加入指示剂,用0.5000mol/LNa2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL。 (2S2O32-+I2=S4O62-+2I-)
①步骤2中除去ClO-的离子方程式是。
②样品中KClO3的貭量分数为。(保留三位有效数字,KClO3式量:122.5)
-
-