2017年福建省福州市联考中考化学模拟试卷
试卷更新日期:2017-08-17 类型:中考模拟
一、选择题
-
1. 紫色卷心菜遇到碱性物质会变成黄绿色.下列能使紫色卷心菜呈黄绿色的物质是( )
物质
柠檬汁
肥皂水
食盐水
雪碧
pH
1.5
8.8
7.0
4.5
A、柠檬汁 B、雪碧 C、食盐水 D、肥皂水2. 元素周期表中,镁元素的信息如图所示,对图中信息解释不正确的是( ) A、核外电子数为 24 B、原子序数为12 C、元素符号为Mg D、相对原子质量为24.313. 加热胆矾固体的实验过程中,操作正确的是( )A、
A、核外电子数为 24 B、原子序数为12 C、元素符号为Mg D、相对原子质量为24.313. 加热胆矾固体的实验过程中,操作正确的是( )A、 取样
B、
取样
B、 加药
C、
加药
C、 加热
D、
加热
D、 熄灭
4. 不适于作实验室制取二氧化碳的发生装置的是( )A、
熄灭
4. 不适于作实验室制取二氧化碳的发生装置的是( )A、 B、
B、 C、
C、 D、
D、 5. 下列关于物质用途的描述不正确的是( )A、熟石灰用于改良酸性土壤 B、氧气可用做燃料 C、铜丝用做导线 D、二氧化碳可用做气体肥料6. 将密封良好的方便面从平原带到高原时,包装袋鼓起,是因为袋内的气体分子( )A、质量增大 B、个数增多 C、体积增大 D、间隔增大7. 卫星运载火箭的动力由高氯酸铵(NH4ClO4)发生反应提供,化学方程式为:2NH4ClO4 N2↑+Cl2↑+2O2↑+4X.则X的化学式是( )A、H2 B、H2O C、H2O2 D、HCl8. 氧烛是一种用于缺氧环境中自救的化学氧源,广泛用于航空、航海等领域,其主要成分为NaClO3 , 还含有适量的催化剂、成型剂等.氧烛通过撞击火帽引发反应后,能持续放出高纯氧气,主要反应原理为2NaClO3═2NaCl+3O2↑.一根氧烛大约可以供100个人呼吸1小时.下列说法不正确的是( )A、氧烛是一种纯净物 B、NaClO3中Cl为+5价 C、氧烛制取氧气的反应为分解反应 D、在运输氧烛时,应避免其受到撞击9. 下列符号能表示两个氧分子的是( )A、O2 B、2O C、2O2 D、2O2﹣10. 下列实验操作能达到实验目的是( )
5. 下列关于物质用途的描述不正确的是( )A、熟石灰用于改良酸性土壤 B、氧气可用做燃料 C、铜丝用做导线 D、二氧化碳可用做气体肥料6. 将密封良好的方便面从平原带到高原时,包装袋鼓起,是因为袋内的气体分子( )A、质量增大 B、个数增多 C、体积增大 D、间隔增大7. 卫星运载火箭的动力由高氯酸铵(NH4ClO4)发生反应提供,化学方程式为:2NH4ClO4 N2↑+Cl2↑+2O2↑+4X.则X的化学式是( )A、H2 B、H2O C、H2O2 D、HCl8. 氧烛是一种用于缺氧环境中自救的化学氧源,广泛用于航空、航海等领域,其主要成分为NaClO3 , 还含有适量的催化剂、成型剂等.氧烛通过撞击火帽引发反应后,能持续放出高纯氧气,主要反应原理为2NaClO3═2NaCl+3O2↑.一根氧烛大约可以供100个人呼吸1小时.下列说法不正确的是( )A、氧烛是一种纯净物 B、NaClO3中Cl为+5价 C、氧烛制取氧气的反应为分解反应 D、在运输氧烛时,应避免其受到撞击9. 下列符号能表示两个氧分子的是( )A、O2 B、2O C、2O2 D、2O2﹣10. 下列实验操作能达到实验目的是( )选项
实验目的
实验操作
A
空气、氧气和氮气
燃着的木条
B
除去CuSO4溶液中的少量FeSO4
加入足量铜粉
C
鉴别澄清石灰水和NaOH溶液
加入稀盐酸
D
氯化钠溶液和稀盐酸
酚酞溶液
A、A B、B C、C D、D二、非选择题
-
11. 小明去采摘草莓.
 (1)、草莓大棚所用的塑料薄膜属于 (填序号,下同).A、有机合成材料 B、金属材料(2)、用发酵后的牛奶做肥料,种出的草每又大又甜.发酵后的牛奶含有C、H、O和N等元素.浇“牛奶”相当于施加了 .A、氮肥 B、磷肥 C、钾肥(3)、食用草莓前,需要用“食材清洗剂”泡5~10分钟,再用清水洗净.小明用1g氢氧化钙和2L水配制成“食材清洗剂”,其溶质的质量分数的计算式为;从生石灰制得氢氧化钙所发生的反应 .12. 金属在日常生活中应用广泛.(1)、下列金属制品中,利用金属的导热性的是 .
(1)、草莓大棚所用的塑料薄膜属于 (填序号,下同).A、有机合成材料 B、金属材料(2)、用发酵后的牛奶做肥料,种出的草每又大又甜.发酵后的牛奶含有C、H、O和N等元素.浇“牛奶”相当于施加了 .A、氮肥 B、磷肥 C、钾肥(3)、食用草莓前,需要用“食材清洗剂”泡5~10分钟,再用清水洗净.小明用1g氢氧化钙和2L水配制成“食材清洗剂”,其溶质的质量分数的计算式为;从生石灰制得氢氧化钙所发生的反应 .12. 金属在日常生活中应用广泛.(1)、下列金属制品中,利用金属的导热性的是 . (2)、我国湿法冶金早在西汉时期就已开始,其中,“曾青得铁则化为铜”便是佐证,即将铁浸入硫酸铜溶液,该反应的化学方程式为 .(3)、“暖宝宝”中的主要成分是铁粉、氯化钠、活性炭等,其发热原理应用的是铁粉缓慢氧化放热,检验“暖宝宝”是否有效的方法是 .13. 一碳化学是以分子中只含有一个碳原子的化合物(如CO、CH4等)为原料,合成一系列化工原料和燃料的化学.(1)、煤和高温水蒸气反应可以生成CO和H2 , 反应的化学方程式为 .(2)、天然气的重整可以得到合成气.其微观过程示意图如下所示:
(2)、我国湿法冶金早在西汉时期就已开始,其中,“曾青得铁则化为铜”便是佐证,即将铁浸入硫酸铜溶液,该反应的化学方程式为 .(3)、“暖宝宝”中的主要成分是铁粉、氯化钠、活性炭等,其发热原理应用的是铁粉缓慢氧化放热,检验“暖宝宝”是否有效的方法是 .13. 一碳化学是以分子中只含有一个碳原子的化合物(如CO、CH4等)为原料,合成一系列化工原料和燃料的化学.(1)、煤和高温水蒸气反应可以生成CO和H2 , 反应的化学方程式为 .(2)、天然气的重整可以得到合成气.其微观过程示意图如下所示:
上述物质中,生成物C与D的质量比为 .
(3)、合成气(CO和H2)在不同催化剂的作用下,可以合成不同的物质.仅以合成气为原料不可能得到的物质是 (填字母序号).A、草酸(H2C2O4) B、甲醇(CH3OH) C、尿素[CO(NH2)2](4)、根据下表回答相关问题.温度(℃)
0
20
40
60
80
100
溶解度
(g/100g 水)
KNO3
13.3
31.6
63.9
110.0
169.0
246.0
NaCl
35.7
36.0
36.6
37.3
38.4
39.8
①如表中两种物质的溶解度相等的温度范围是在℃.
②20℃时,硝酸钾的溶解度是 , 该温度下,将20gKNO3放入50g水中,充分搅拌,所得溶液的质量是 . 要进一步提高该溶液的溶质质量分数,可进行的操作是 .
14. 客家围屋如同城堡,可以抵御外敌入侵.现有A、B、C、D、E 5种物质作为围屋的守护“卫士”,它们分别由氢、碳、氧、钠、钙中的两种或三种元素组成.五种物质间建立起如图1所示的关系才能组成守护的防线,其中物质A和B是常用的灭火剂. (1)、物质A的化学式为 .(2)、生成物质D的化学方程式为 .(3)、现有下列物质作为“外敌”分别对围屋发起进攻,若该物质只要与两位相邻的守护“卫士”都能发生反应就能攻破防线,那么能攻入围屋的物质是 .
(1)、物质A的化学式为 .(2)、生成物质D的化学方程式为 .(3)、现有下列物质作为“外敌”分别对围屋发起进攻,若该物质只要与两位相邻的守护“卫士”都能发生反应就能攻破防线,那么能攻入围屋的物质是 .①铁 ②稀盐酸 ③氧化铁 ④稀硫酸
(4)、室温下,将稀盐酸慢慢滴入装有D溶液的烧杯中,利用温度传感器测出烧杯中溶液的温度,溶液温度随加入盐酸的质量而变化的曲线如图2所示.
①请解释xy段温度变化的原因 .
②在z处溶液中的溶质是(填化学式).
15. 实验室去除粗盐中难溶性杂质的过程如图所示.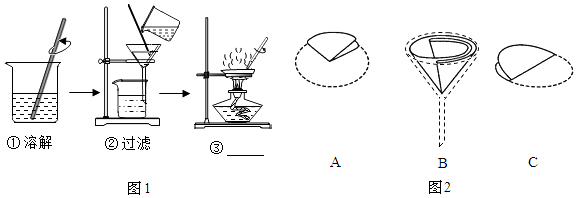
①步骤①中使用玻璃棒的目的是 .
②步骤②中过滤器的制作如图2,正确的顺序是(填序号).
③步骤③的名称是 , 当观察到时,停止加热.
16. 请用下列实验装置完成气体的制取及性质实验.
①仪器b的名称 .
②用双氧水和二氧化锰混合制氧气,为了得到平稳的氧气流,应该选择的发生装置是(填序号) , 反应的化学方程式为;当产生的氧气从D的左边导管通入时,很快看到G中导管口有气泡冒出;D中白磷始终没有燃烧的原因是;E中观察到的现象是 .
③实验过程中,F中反应的化学方程式为; G中溶液由紫色变红色,G中颜色变化的原因是(用化学方程式表示).
④用H装置可以收集剩余气体,H装置收集气体的依据是 .
17. 实验室有不纯的氯酸钾样品,把该样品与1g二氧化锰混合加热制取氧气(杂质不参加反应),充分反应后,固体混合物质量变化如下所示:(反应化学方程式2KClO3 2KCl+3O2↑)反应前固体总质量
反应后固体总质量
13.5g
8.7g
(1)、生成氧气的质量为g;(2)、样品中氯酸钾的质量分数是多少?