2017年北京市昌平区高考化学二模试卷
试卷更新日期:2017-08-16 类型:高考模拟
一、选择题
-
1. 下列电池工作时能量转化形式与其它三个不同的是( )




A.锌锰碱性电池
B.硅太阳能电池
C.氢燃料电池
D.银锌纽扣电池
A、A B、B C、C D、D2. 下列解释事实的方程式不正确的是( )A、焊接铁轨:2Fe+Al2O3 2Al+Fe2O3 B、工业固氮:N2+3H2 2NH3 C、用纯碱除油污:CO32﹣+H2O⇌HCO3﹣+OH﹣ D、用湿润的淀粉KI试纸检验Cl2:Cl2+2I﹣═2Cl﹣+I23. 关于a:0.1mol/L NH4Cl溶液和b:0.1mol/L NH3•H2O溶液,下列说法不正确的是( )A、两溶液中存在的微粒种类:a>b B、c(NH4+):a>b C、c(OH﹣):a<b D、水电离出的c(H+):a<b4. 某离子反应涉及到H2O、ClO﹣、NH4+、OH﹣、N2、Cl﹣等微粒,其中N2、ClO﹣的物质的量随时间变化的曲线如图所示,下列说法正确的是( )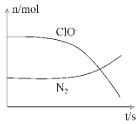 A、该反应中Cl﹣为氧化产物 B、消耗1 mol还原剂,转移6 mol电子 C、反应后溶液的酸性减弱 D、NH4+被ClO﹣氧化成N25. 下列说法正确的是( )A、葡萄糖制镜利用了葡萄糖的氧化性 B、室温下,在水中的溶解度:乙醇>苯酚>乙酸乙酯 C、酯在碱性条件下水解生成对应的酸和醇 D、甲苯能使酸性高锰酸钾溶液褪色,说明甲基使苯环变活泼6. 下列实验中,对应的现象以及结论都正确且两者具有因果关系的是( )
A、该反应中Cl﹣为氧化产物 B、消耗1 mol还原剂,转移6 mol电子 C、反应后溶液的酸性减弱 D、NH4+被ClO﹣氧化成N25. 下列说法正确的是( )A、葡萄糖制镜利用了葡萄糖的氧化性 B、室温下,在水中的溶解度:乙醇>苯酚>乙酸乙酯 C、酯在碱性条件下水解生成对应的酸和醇 D、甲苯能使酸性高锰酸钾溶液褪色,说明甲基使苯环变活泼6. 下列实验中,对应的现象以及结论都正确且两者具有因果关系的是( )选项
实验操作
实验现象
结论
A
将少量Fe(NO3)2加水溶解后,滴加稀硫酸酸化,再滴加KSCN溶液
溶液变成血红色
Fe(NO3)2已变质
B
在KI溶液中滴加少量氯水,再加入CCl4 , 充分震荡.
液体分层,下层溶液呈紫红色.
氯的非金属性比碘强
C
炭粉中加入浓硫酸并加热,导出的气体通入BaCl2溶液中
有白色沉淀产生
有SO2和CO2产生
D
向AgNO3溶液中滴加少量NaCl溶液,然后再向其中滴加KI溶液
先生成白色沉淀,后生成黄色沉淀
溶解度:AgCl>AgI
A、A B、B C、C D、D7. 常温时,用0.1000mol/L NaOH溶液滴定25.00mL 0.1000mol/L某一元酸HX溶液,滴定过程中pH变化曲线如图所示.下列说法不正确的是( )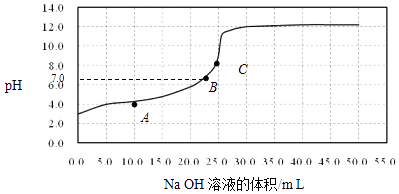 A、在A点:c(HX)>c(Na+)>c(X﹣) B、在B点,溶液中c(H+)=c(OH﹣) C、C点溶液中存在的主要平衡是X﹣+H2O⇌HX+OH﹣ D、0.05mol/L NaX溶液的pH≈9
A、在A点:c(HX)>c(Na+)>c(X﹣) B、在B点,溶液中c(H+)=c(OH﹣) C、C点溶液中存在的主要平衡是X﹣+H2O⇌HX+OH﹣ D、0.05mol/L NaX溶液的pH≈9二、非选择题
-
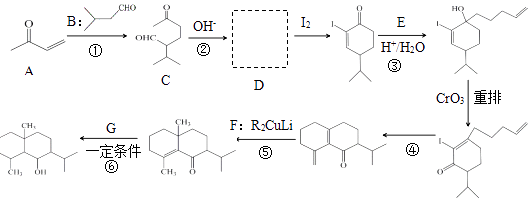
8. 天然产物萜类化合物eudesmane合成路线片段如图.(某些反应条件省略)
已知:
i.RCHO+R′﹣CH2﹣CHO
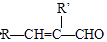 +H2O
+H2Oii.RMgX+
 →
→ 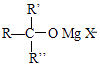
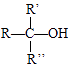
iii.

回答下列问题:
(1)、A中的官能团名称是羰基、 .(2)、反应②的化学方程式是 .(3)、反应③中试剂E的结构简式是 .(4)、反应④的另一种产物是 .(5)、F的结构简式是 .(6)、G的电子式是 .(7)、D有多种同分异构体,满足下列条件的有种,写出其中任意一种.a.能发生银镜反应b.结构为六元环状c.环上有3种氢原子
(8)、以CH3CH2OH与CH3COCH3为原料,结合已知信息选用必要的无机物合成B,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上标明试剂和反应条件).9. 磷石膏(主要成分是CaSO4•2H2O)是磷酸及磷肥类工业在生产过程中产生的一种废渣,我国每年排放的磷石膏大约2000万吨以上,开发利用磷石膏,保护资源和环境,符合持续发展的观念.图1所示为对磷石膏进行综合利用的路径之一.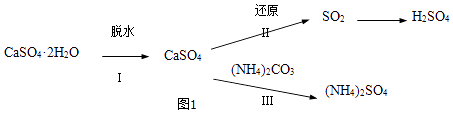 (1)、过程Ⅰ中CaSO4•2H2O脱水反应相关的热化学方程式为:
(1)、过程Ⅰ中CaSO4•2H2O脱水反应相关的热化学方程式为:CaSO4•2H2O(s)=CaSO4• H2O(s)+ H2O(g)△H1=+83.2KJ•mol﹣1
CaSO4•2H2O(s)=CaSO4(s)+2H2O(l)△H2=+26KJ•mol﹣1
H2O(g)=H2O(l)△H3=﹣44KJ•mol﹣1
则反应CaSO4• H2O(s)=CaSO4(s)+ H2O(g)的△H4=KJ•mol﹣1 .
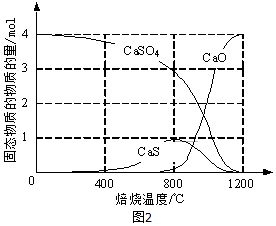
(2)、过程Ⅱ用合适的还原剂可以将CaSO4还原,所得SO2可用于工业生产硫酸.①CO作还原剂,改变反应温度可得到不同的产物.不同温度下所得固体成分的物质的量如图2所示.在低于800℃时还原产物为;1200℃时主要发生的反应的化学方程式为 .
②高硫煤作还原剂,焙烧2.5小时,测不同温度下硫酸钙的转化率,如图3所示.CaCl2的作用是;当温度高于1200℃时,无论有无CaCl2 , CaSO4的转化率趋于相同,其原因是 .
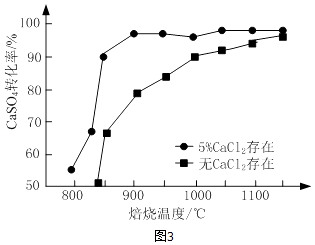
③以SO2为原料,工业生产硫酸的化学方程式 .
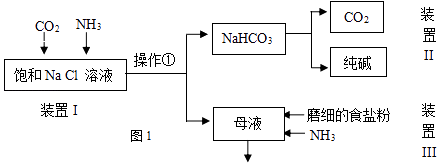
(3)、过程III将CaSO4投入(NH4)2CO3溶液中,发生反应的离子方程式是 .10. 纯碱是重要的化工原料,在医药、冶金、化工、食品等领域被广泛使用.(1)、工业生产纯碱的第一步是除去饱和食盐水的中Mg2+、Ca2+离子,从成本角度考虑加入试剂的化学式为、 .某实验小组的同学模拟侯德榜制碱法制取纯碱,流程如图1:
已知:几种盐的溶解度
NaCl
NH4HCO3
NaHCO3
NH4Cl
溶解度(20℃,100gH2O时)
36.0
21.7
9.6
37.2
(2)、①写出装置I中反应的化学方程式 .②从平衡移动角度解释该反应发生的原因 .
③操作①的名称是 .
(3)、写出装置II中发生反应的化学方程式 .(4)、请结合化学用语说明装置III中加入磨细的食盐粉及NH3的作用.(5)、该流程中可循环利用的物质是(6)、制出的纯碱中含有杂质NaCl,为测定其纯度,下列方案中不可行的是 .a.向m克纯碱样品中加入足量CaCl2溶液,测生成CaCO3的质量
b.向m克纯碱样品中加入足量稀H2SO4 , 干燥后测生成气体的体积
c.向m克纯碱样品中加入足量AgNO3溶液,测生成沉淀的质量.
11. 某研究小组为了验证反应物浓度对反应速率的影响,选用硫酸酸化的高锰酸钾溶液与草酸溶液在室温下进行反应.实验中所用的草酸为稀溶液,可视为强酸.
(1)、将高锰酸钾氧化草酸的离子方程式补充完整.2MnO4﹣+C2O42﹣+=2 Mn2++CO2↑+H2O
(2)、该小组进行了实验I,数据如表.H2SO4溶液
KMnO4溶液
H2C2O4溶液
褪色时间(分:秒)
1mL 2mol/L
2mL 0.01mol/L
1mL 0.1mol/L
2:03
1mL 2mol/L
2mL 0.01mol/L
1mL 0.2mol/L
2:16
一般来说,其他条件相同时,增大反应物浓度,反应速率.
但分析实验数据,得到的结论是 .
(3)、该小组欲探究出现上述异常现象的原因,在实验I的基础上,只改变草酸溶液浓度进行了实验II,获得实验数据并绘制曲线图如图.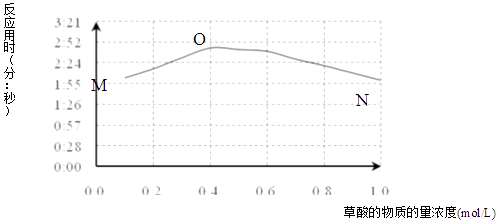
①用文字描述曲线图表达的信息 .
②该小组查阅资料获取如下信息,其中能够解释MO变化趋势的是 .
a
KMnO4与H2C2O4反应是分步进行的,反应过程中生成Mn(VI)、Mn(III)、Mn(IV),最终变为无色的Mn(II).(括号中罗马数字表示锰的化合价)
b
草酸根易与不同价态锰离子形成较稳定的配位化合物.
c
草酸稳定性较差,加热至185℃可分解.
(4)、该小组为探究ON段曲线变化趋势的原因,又进行了实验III,所得数据如表.H2SO4溶液
Na2SO4固体
KMnO4溶液
H2C2O4溶液
褪色时间(分:秒)
1mL 0.1mol/L
1.9×10﹣3mol
2mL 0.01mol/L
1mL 0.2mol/L
16:20
1mL 0.5mol/L
1.5×10﹣3mol
2mL 0.01mol/L
1mL 0.2mol/L
8:25
1mL 1.0mol/L
1.0×10﹣3mol
2mL 0.01mol/L
1mL 0.2mol/L
6:15
1mL 2.0mol/L
0
2mL 0.01mol/L
1mL 0.2mol/L
2:16
该小组进行实验III的目的是 .
(5)、综合实验I、II、III,推测造成曲线MN变化趋势的原因.为验证该推测还需要补充实验,请对实验方案进行理论设计.