2017年上海市金山区高考化学二模试卷
试卷更新日期:2017-08-16 类型:高考模拟
一、选择题
-
1. 漂粉精的有效成分是( )A、Ca(ClO)2 B、CaCl2 C、CaCO3 D、Ca(OH)22. 将两种互不相溶的液体分离的方法是( )A、分液 B、结晶 C、纸层析 D、过滤3. 既能和盐酸反应,又能和氢氧化钠溶液反应的物质是( )A、Fe B、Fe2O3 C、Al D、AlCl34. 有关HF和HCl判断正确的是( )A、键长:HF>HCl B、键能:HF>HCl C、稳定性:HCl>HF D、共用电子对偏移程度:HCl>HF5. 可用来鉴别乙醇、乙醛的试剂是( )
A、银氨溶液 B、乙酸溶液 C、氯化铁溶液 D、氢氧化钠溶液6. 下列化工生产涉及的变化主要是物理变化的是( )A、煤的干馏 B、石油的分馏 C、石油的裂化 D、石油的裂解7. 按照有机物的命名规则,下列命名正确的是( )A、1,2﹣二甲基戊烷 B、2﹣乙基丁烷 C、3﹣乙基己烷 D、3,4﹣二甲基戊烷8. 能说明二氧化硫具有还原性的事实是( )A、使品红溶液褪色 B、使溴水褪色 C、与氢硫酸反应 D、与烧碱反应9. 具有下列性质的物质可能属于离子晶体的是( )A、熔点801℃,易溶于水 B、熔点10.31℃,液态不导电 C、熔点112.8℃,能溶于CS2 D、熔点97.81℃,固态能导电10. 下列事实与盐类水解无关的是( )A、氯化铝溶液蒸干后灼烧得不到无水氯化铝 B、氯化铁溶液常用作制印刷电路板的腐蚀剂 C、常用热的纯碱溶液除去油污 D、长期施用硫酸铵易使土壤酸化11. 下列物质的工业生产原理不涉及氧化还原反应的是( )A、烧碱 B、纯碱 C、硫酸 D、液溴12. 研究电化学腐蚀及防护的装置如图所示.下列有关说法正确的是( ) A、锌片发生氧化反应作阴极 B、电子从铁片经过导线流向锌片 C、铁片上电极反应为:O2+2H2O+4e→4OH﹣ D、该装置可用于研究外加电流阴极保护法13. 在密闭容器中,反应2X(g)+Y(g)⇌3Z(g)达到平衡后,若将容器体积缩小一半,对反应产生的影响是( )A、v(正)减小,v(逆)增大 B、v(正)增大,v(逆)减小 C、v(正)、v(逆)都减小 D、v(正)、v(逆)都增大14. 布洛芬片常用来减轻感冒症状,其结构简式如图,下列有关说法错误的是( )
A、锌片发生氧化反应作阴极 B、电子从铁片经过导线流向锌片 C、铁片上电极反应为:O2+2H2O+4e→4OH﹣ D、该装置可用于研究外加电流阴极保护法13. 在密闭容器中,反应2X(g)+Y(g)⇌3Z(g)达到平衡后,若将容器体积缩小一半,对反应产生的影响是( )A、v(正)减小,v(逆)增大 B、v(正)增大,v(逆)减小 C、v(正)、v(逆)都减小 D、v(正)、v(逆)都增大14. 布洛芬片常用来减轻感冒症状,其结构简式如图,下列有关说法错误的是( ) A、布洛芬的分子式为C13H18O2 B、布洛芬与苯乙酸是同系物 C、1mol 布洛芬最多能与3mol 氢气发生加成反应 D、布洛芬在苯环上发生取代反应,其一氯代物有4种15. 配制一定物质的量浓度的NaOH溶液时,下列因素会导致溶液浓度偏高的是( )A、溶解时有少量液体溅出 B、洗涤液未全部转移到容量瓶中 C、容量瓶使用前未干燥 D、定容时液面未到刻度线16. 下列离子在溶液中能大量共存的是( )A、H+、AlO2﹣、CO32﹣ B、K+、Ba2+、SO42﹣ C、NH4+、OH﹣、NO3﹣ D、Fe3+、NO3﹣、Cl﹣17. 将少量NH4HCO3粉末加入盐酸,反应剧烈,溶液温度降低,下列判断正确的是( )A、NH4HCO3和盐酸的反应是放热反应 B、溶液温度降低主要是因为NH4HCO3溶解吸热造成的 C、反应物的总能量低于生成物的总能量 D、反应的热化学方程式为:NH4HCO3+HCl→NH4Cl+CO2↑+H2O﹣Q18. 25℃时,将10mL质量分数为50%(密度1.4g/mL)的硫酸稀释成100mL,下列说法正确的是( )A、纯硫酸的摩尔质量为98 B、上述100mL稀硫酸中含溶质14g C、上述稀释过程所需要的蒸馏水为90mL D、质量分数为50%的硫酸物质的量浓度为7.14mol/L19. 等体积等物质的量浓度的NaHCO3溶液和Ba(OH)2溶液混合,离子方程式正确的是( )A、CO32﹣+Ba2+→BaCO3↓ B、HCO3﹣+OH﹣→H2O+CO32﹣ C、HCO3﹣+Ba2++OH﹣=H2O+BaCO3↓ D、2HCO3﹣+Ba2++2OH﹣→BaCO3↓+2H2O+CO32﹣20. 工业上常用NaHSO3处理含Cr2O72﹣的废液,反应的离子方程式为:5H++Cr2O72﹣+3HSO3﹣→2Cr3++3SO42﹣+4H2O
A、布洛芬的分子式为C13H18O2 B、布洛芬与苯乙酸是同系物 C、1mol 布洛芬最多能与3mol 氢气发生加成反应 D、布洛芬在苯环上发生取代反应,其一氯代物有4种15. 配制一定物质的量浓度的NaOH溶液时,下列因素会导致溶液浓度偏高的是( )A、溶解时有少量液体溅出 B、洗涤液未全部转移到容量瓶中 C、容量瓶使用前未干燥 D、定容时液面未到刻度线16. 下列离子在溶液中能大量共存的是( )A、H+、AlO2﹣、CO32﹣ B、K+、Ba2+、SO42﹣ C、NH4+、OH﹣、NO3﹣ D、Fe3+、NO3﹣、Cl﹣17. 将少量NH4HCO3粉末加入盐酸,反应剧烈,溶液温度降低,下列判断正确的是( )A、NH4HCO3和盐酸的反应是放热反应 B、溶液温度降低主要是因为NH4HCO3溶解吸热造成的 C、反应物的总能量低于生成物的总能量 D、反应的热化学方程式为:NH4HCO3+HCl→NH4Cl+CO2↑+H2O﹣Q18. 25℃时,将10mL质量分数为50%(密度1.4g/mL)的硫酸稀释成100mL,下列说法正确的是( )A、纯硫酸的摩尔质量为98 B、上述100mL稀硫酸中含溶质14g C、上述稀释过程所需要的蒸馏水为90mL D、质量分数为50%的硫酸物质的量浓度为7.14mol/L19. 等体积等物质的量浓度的NaHCO3溶液和Ba(OH)2溶液混合,离子方程式正确的是( )A、CO32﹣+Ba2+→BaCO3↓ B、HCO3﹣+OH﹣→H2O+CO32﹣ C、HCO3﹣+Ba2++OH﹣=H2O+BaCO3↓ D、2HCO3﹣+Ba2++2OH﹣→BaCO3↓+2H2O+CO32﹣20. 工业上常用NaHSO3处理含Cr2O72﹣的废液,反应的离子方程式为:5H++Cr2O72﹣+3HSO3﹣→2Cr3++3SO42﹣+4H2O下列判断错误的是( )
A、氧化产物是SO42﹣ B、氧化剂与还原剂的物质的量之比是1:3 C、Cr2O72﹣表现了氧化性 D、还原1molCr2O72﹣ , 电子转移3mol二、综合题(一)
-
21. 表为元素周期表的一部分:
IA
IIA
IIIA
IVA
VA
VIA
VIIA
二
C
N
①
三
②
③
④
P
⑤
⑥
请填写下列空白:
(1)、表中元素,原子半径最大的是(填写元素符号);①的核外电子排布式;③和⑥两元素形成化合物的电子式为 .(2)、②③④三种元素最高价氧化物对应的水化物中,碱性最强的是(填化学式).(3)、比较④、⑤两种元素的简单离子半径:>(填离子符号);元素④最高价氧化物对应的水化物与硝酸反应的离子方程式为 .(4)、列举一个事实来证明元素①比元素⑤的非金属性强 .(5)、若8g甲烷气体完全燃烧生成液态水时放出445.15kJ的热量,请写出其热化学方程式 .22. 氮的单质及其化合物性质多样,用途广泛.完成下列填空.
(1)、科学家正在研究利用催化技术将超音速飞机尾气中的NO和CO转变成CO2和N2:2NO+2CO 2CO2+N2+Q(Q>0)某温度下测得该反应在不同时间的CO浓度如表:
时间(s)
浓度(mol/L)
0
1
2
3
4
5
c(CO)
3.60×10﹣3
3.05×10﹣3
2.85×10﹣3
2.75×10﹣3
2.70×10﹣3
2.70×10﹣3
该反应平衡常数K的表达式为;温度升高,K值(选填“增大”、“减小”、“不变”);前2s内的平均反应速率v(N2)=;若上述反应在密闭容器中发生,达到平衡时能提高NO转化率的措施之一是 .
(2)、工业合成氨的反应温度选择500℃左右的原因是 .(3)、实验室在固定容积的密闭容器中加入1mol氮气和3mol氢气模拟工业合成氨,反应在一定条件下已达到平衡的标志是 .a.N2、H2、NH3的浓度之比为1:3:2
b.容器内的压强保持不变
c.N2、H2、NH3的浓度不再发生变化
d.反应停止,正、逆反应的速率都等于零
(4)、常温下向含1mol溶质的稀盐酸中缓缓通入1mol NH3(溶液体积变化忽略不计),反应结束后溶液中离子浓度由大到小的顺序是;在通入NH3的过程中溶液的导电能力(选填“变大”、“变小”、“几乎不变”).23. 乙烯是一种重要的化工原料,以乙烯为原料生产部分化工产品的反应如图(部分反应条件已略去):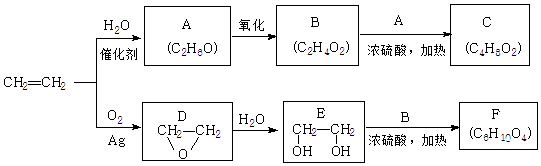
请回答下列问题:
(1)、A的名称是 , 含有的官能团名称是 , 实验室由A转化为乙烯的反应条件为 .(2)、B和A反应生成C的化学方程式为 , 该反应的类型为 .(3)、F的结构简式为 .(4)、写出D的同分异构体的结构简式 .(5)、乙炔也是常见的一种化工原料,它可以制取很多化工产品,例如:聚氯乙烯塑料.写出由乙炔合成聚氯乙烯的合成路线.(合成路线常用的表示方式为:A B… 目标产物)24. 孔雀石主要含Cu2(OH)2CO3 , 以及少量Fe、Si的化合物.可以用孔雀石为原料制备胆矾(CuSO4•5H2O),步骤如图:
请回答下列问题:
(1)、试剂①是一种常见的酸,写出其化学式 . 过滤所需要的玻璃仪器有(2)、实验室检验Fe3+的常用方法是 .(3)、溶液A中的金属离子有Cu2+、Fe2+、Fe3+ , 上述流程中需要用试剂②将溶液A中的Fe2+全部转化为Fe3+ , 从而形成溶液B,则试剂②能否用氯水(填“能”或“不能”,若“不能”,请解释原因).(4)、由溶液C获得胆矾,需要经过、、过滤等操作.(5)、取25.00mL溶液A,用1.000×10﹣2mol/LKMnO4标准溶液滴定.反应离子方程式为:5Fe2++MnO4﹣+8H+→5Fe3++Mn2++4H2O,若消耗标准溶液20.00mL,则溶液A中Fe2+的浓度为 .