2017年山西省吕梁市孝义市高考化学考前热身试卷 ,
试卷更新日期:2017-08-16 类型:高考模拟
一、选择题
-
1. 化学与生产、生活密切相关.下列叙述正确的是( )A、煤的干馏和煤的液化均是物理变化 B、天然纤维和合成纤维的主要成分都是纤维素 C、海水淡化的方法有蒸馏法、电渗析法等 D、用活性炭为糖浆脱色和用次氯酸盐漂白纸浆的原理相同2. 《新修本草》是我国古代中药学著作之一,记载药物844种,其中有关于“青矾”的描述为:“本来绿色,新出窟未见风者,正如瑠璃…烧之赤色…”据此推测,“青矾”的主要成分为( )
A、CuSO4•5H2O B、FeSO4•7H2O C、KAl(SO4)2•12H2O D、Fe2(SO4)3•9H2O3. 下列图示与对应的叙述相符的是( )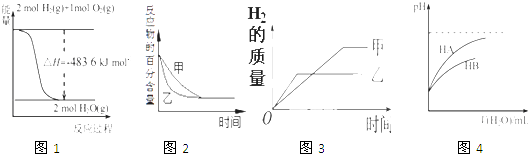 A、图1表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为241.8 kJ•mol﹣1 B、图2表示压强对可逆反应2A(g)+2 B(g)⇌3C(g)+D(s)的影响,乙的压强比甲的压强大 C、图3表示等质量的钾、钠分别与足量水反应,则甲为钠 D、图4表示常温下,稀释HA,HB两种酸的稀溶液时,溶液pH随加水量的变化,则相同条件下NaA溶液的pH大于同浓度的NaB溶液的pH4. 如图所示,甲池的总反应式为:N2H4+O2═N2+2H2O下列关于该电池工作时说法正确的是( )
A、图1表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为241.8 kJ•mol﹣1 B、图2表示压强对可逆反应2A(g)+2 B(g)⇌3C(g)+D(s)的影响,乙的压强比甲的压强大 C、图3表示等质量的钾、钠分别与足量水反应,则甲为钠 D、图4表示常温下,稀释HA,HB两种酸的稀溶液时,溶液pH随加水量的变化,则相同条件下NaA溶液的pH大于同浓度的NaB溶液的pH4. 如图所示,甲池的总反应式为:N2H4+O2═N2+2H2O下列关于该电池工作时说法正确的是( )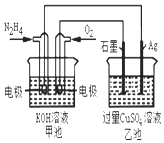 A、甲池中负极反应为:N2H4﹣4e﹣═N2+4H+ B、甲池溶液pH不变,乙池溶液pH减小 C、反应一段时间后,向乙池中加一定量CuO固体,能使CuSO4溶液恢复到原浓度 D、甲池中消耗2.24L O2 , 此时乙池中理论上最多产生12.8g固体5. 分子式为C4H2Cl8的同分异构体共有(不考虑立体异构)( )A、10种 B、9种 C、8种 D、7种6. 下列说法不正确的是( )A、常温下,在0.1mol•L﹣1的HNO3溶液中,由水电离出的c(H+)< B、浓度为0.1mol•L﹣1的NaHCO3溶液:c(H2CO3)>c(CO32﹣) C、25℃时,AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶度积相同 D、冰醋酸中逐滴加水,溶液的导电性、醋酸的电离程度、pH均先增大后减小7. 在体积为2L的恒容密闭容器中发生反应xA(g)+yB(g)⇌zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A)n(B)的变化关系.则下列结论正确的是( )
A、甲池中负极反应为:N2H4﹣4e﹣═N2+4H+ B、甲池溶液pH不变,乙池溶液pH减小 C、反应一段时间后,向乙池中加一定量CuO固体,能使CuSO4溶液恢复到原浓度 D、甲池中消耗2.24L O2 , 此时乙池中理论上最多产生12.8g固体5. 分子式为C4H2Cl8的同分异构体共有(不考虑立体异构)( )A、10种 B、9种 C、8种 D、7种6. 下列说法不正确的是( )A、常温下,在0.1mol•L﹣1的HNO3溶液中,由水电离出的c(H+)< B、浓度为0.1mol•L﹣1的NaHCO3溶液:c(H2CO3)>c(CO32﹣) C、25℃时,AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶度积相同 D、冰醋酸中逐滴加水,溶液的导电性、醋酸的电离程度、pH均先增大后减小7. 在体积为2L的恒容密闭容器中发生反应xA(g)+yB(g)⇌zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A)n(B)的变化关系.则下列结论正确的是( )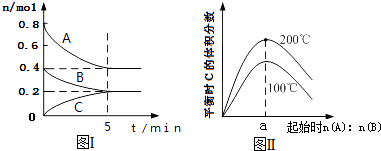 A、200℃时,反应从开始到平衡的平均速率v(B)=0.04mol•L﹣1•min﹣1 B、图Ⅱ所知反应xA(g)+yB(g)⇌zC(g)的△H<0,且a=2 C、若在图Ⅰ所示的平衡状态下,再向体系中充入He,重新达到平衡前v(正)>v(逆) D、200℃时,向容器中充入2 mol A 和1 mol B,达到平衡时,A 的体积分数小于50%
A、200℃时,反应从开始到平衡的平均速率v(B)=0.04mol•L﹣1•min﹣1 B、图Ⅱ所知反应xA(g)+yB(g)⇌zC(g)的△H<0,且a=2 C、若在图Ⅰ所示的平衡状态下,再向体系中充入He,重新达到平衡前v(正)>v(逆) D、200℃时,向容器中充入2 mol A 和1 mol B,达到平衡时,A 的体积分数小于50%二、解答题
-
8. CoCl2•6H2O是一种饲料营养强化剂.一种利用水钴矿(主要成分为Co2O3、Co(OH)3 , 还含少量Fe2O3、Al2O3、MnO等)制取CoCl2•6H2O的工艺流程如图1:
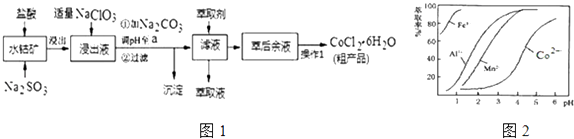
已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:(金属离子浓度为:0.01mol/L)
沉淀物
Fe(OH)3
Fe(OH)2
Co(OH)2
Al(OH)3
Mn(OH)2
开始沉淀
2.7
7.6
7.6
4.0
7.7
完全沉淀
3.7
9.6
9.2
5.2
9.8
③CoCl2•6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴.
(1)、写出浸出过程中Co2O3发生反应的离子方程式 .(2)、写出NaClO3发生反应的主要离子方程式;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式 .(3)、“加Na2CO3调pH至a”,过滤所得到的两种沉淀的化学式为 .(4)、制得的CoCl2•6H2O在烘干时需减压烘干的原因是 .(5)、萃取剂对金属离子的萃取率与pH的关系如图2.向“滤液”中加入萃取剂的目的是;其使用的最佳pH范围是 .A.2.0~2.5 B.3.0~3.5 C.4.0~4.5 D.5.0~5.5
(6)、为测定粗产品中CoCl2•6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl2•6H2O的质量分数大于100%,其原因可能是 . (答一条即可)9. 某研究性学习小组对过量炭粉与氧化铁反应的气体产物成分进行研究.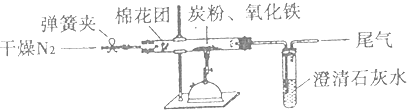 (1)、提出假设
(1)、提出假设①该反应的气体产物是CO2 .
②该反应的气体产物是CO.
③该反应的气体产物是 .
(2)、设计方案如图所示,将一定量的氧化铁在隔绝空气的条件下与过量炭粉完全反应,测定参加反应的碳元素与氧元素的质量比.
查阅资料
氮气不与碳、氧化铁发生反应.实验室可以用氯化铵饱和溶液和亚硝酸钠(NaNO2)饱和溶液混合加热反应制得氮气.请写出该反应的离子方程式: .
(3)、实验步骤①按如图连接装置,并检查装置的气密性,称取3.20g氧化铁、2.00g碳粉混合均匀,放入10.38g的硬质玻璃管中;
②加热前,先通一段时间纯净干燥的氮气;
③停止通入N2后,夹紧弹簧夹,加热一段时间,澄清石灰水(足量)变浑浊;
④待反应结束,再缓缓通入一段时间的氮气.冷却至室温,称得硬质玻璃管和固体总质量为53.02g;
⑤过滤出石灰水中的沉淀,洗涤、烘干后称得质量为1g.步骤②、④中都分别通入N2 , 其作用分别为 .
(4)、数据处理试根据实验数据分析,写出该实验中氧化铁与碳发生反应的化学方程式: .
(5)、实验优化学习小组有同学认为应对实验装置进一步完善.
①甲同学认为:应将澄清石灰水换成Ba(OH)2溶液,其理由是 .
②从环境保护的角度,请你再提出一个优化方案: .
10. 工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、SO2等气体,严重污染空气.对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用.(1)、Ⅰ.脱硝:已知:H2的燃烧热为285.8kJ•mol﹣1
N2(g)+2O2(g)═2NO2(g)△H=+133kJ•mol﹣1
H2O(g)═H2O(l)△H=﹣44kJ•mol﹣1
催化剂存在下,H2还原NO2生成水蒸气和其他无毒物质的热化学方程式为: .
(2)、Ⅱ.脱碳:向2L密闭容器中加入2molCO2和6molH2 , 在适当的催化剂作用下,发生反应:CO2(g)+3H2(g)⇌CH3OH(l)+H2O(l)
①该反应自发进行的条件是(填“低温”、“高温”或“任意温度”)
②下列叙述能说明此反应达到平衡状态的是 . (填字母)
a.混合气体的平均式量保持不变 b.CO2和H2的体积分数保持不变
c.CO2和H2的转化率相等 d.混合气体的密度保持不变
e.1molCO2生成的同时有3mol H﹣H键断裂
③CO2的浓度随时间(0~t2)变化如图1所示,在t2时将容器容积缩小一倍,t3时达到平衡,t4时降低温度,t5时达到平衡,请画出t2~t6CO2浓度随时间的变化.
 (3)、改变温度,使反应CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H<0中的所有物质都为气态.起始温度、体积相同(T1℃、2L密闭容器).反应过程中部分数据见表:
(3)、改变温度,使反应CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H<0中的所有物质都为气态.起始温度、体积相同(T1℃、2L密闭容器).反应过程中部分数据见表:反应时间
CO2(mol)
H2(mol)
CH3OH(mol)
H2O(mol)
反应Ⅰ:恒温恒容
0min
2
6
0
0
10min
4.5
20min
1
30min
1
反应Ⅱ:绝热恒容
0min
0
0
2
2
①达到平衡时,反应Ⅰ、Ⅱ对比:平衡常数K(I) K(II)(填“>”“<”或“=”下同);平衡时CH3OH的浓度c(I) c(II).
②对反应Ⅰ,前10min内的平均反应速率v(CH3OH)= . 在其他条件不变的情况下,若30min时只改变温度T2℃,此时H2的物质的量为3.2mol,则T1T2(填“>”、“<”或“=”).若30min时只向容器中再充入1molCO2(g)和1molH2O(g),则平衡移动(填“正向”“逆向”或“不”).
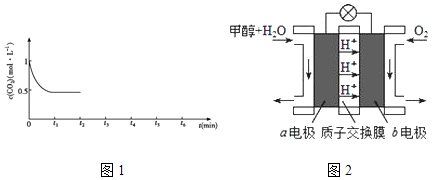
(4)、利用人工光合作用可将CO2转化为甲酸,反应原理为2CO2+2H2O═2HCOOH+O2 , 装置如图所示:①电极2的电极反应式是;
②在标准状况下,当电极2室有11.2L CO2反应. 理论上电极1室液体质量(填“增加”或“减少” g.
11. 第四周期中的18中元素具有重要的用途,在现代工业中备受青睐.(1)、铬是一种硬二脆,抗腐蚀性强的金属,常用于电镀和制造特种钢.基态Cr原子中,电子占据最高能层的符号为 , 该能层上具有的原子轨道数为 , 电子数为 ,(2)、第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的,30Zn与31Ga的第一电离能是否符合这一规律?(填“是”或“否”),原因是(如果前一问填“是”,此问可以不答)(3)、镓与第VA族元素可形成多种新型人工半导体材料,砷化镓(GaAs)就是其中一种,其晶体结构如下图所示(白色球代表As原子).在GaAs晶体中,每个Ga原子与个As原子相连,与同一个Ga原子相连的As原子构成的空间构型为;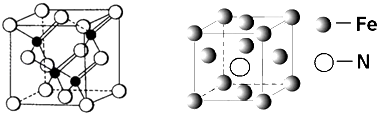 (4)、与As同主族的短周期元素是N、P.AsH3中心原子杂化的类型;一定压强下将AsH3和NH3 . PH3的混合气体降温是首先液化的是 , 理由是;(5)、铁的多种化合物均为磁性材料,氮化铁石期中一种,某氮化铁的井胞结构如图所示,则氮化铁的化学式为;设晶胞边长为acm,阿伏加德罗常数为NA , 该晶体的密度为 g.cm﹣3(用含a和NA的式子表示)
(4)、与As同主族的短周期元素是N、P.AsH3中心原子杂化的类型;一定压强下将AsH3和NH3 . PH3的混合气体降温是首先液化的是 , 理由是;(5)、铁的多种化合物均为磁性材料,氮化铁石期中一种,某氮化铁的井胞结构如图所示,则氮化铁的化学式为;设晶胞边长为acm,阿伏加德罗常数为NA , 该晶体的密度为 g.cm﹣3(用含a和NA的式子表示)三、[化学-选修5:有机化学基础]
-
12. 3﹣对甲苯丙烯酸甲酯(E)是一种用于合成抗血栓药的中间体,其合成路线如下:
 +CO
+CO 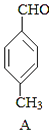 B
B 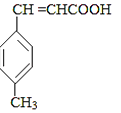 E
E已知:HCHO+CH3CHO CH2═CHCHO+H2O
(1)、A中官能团的名称为 , A分子中核磁共振氢谱各峰值比为(2)、物质B的结构简式为 , 生成E的反应类型为(3)、试剂C可选用下列中的 .a.溴水 b.银氨溶液 c.酸性KMnO4溶液 d.新制Cu(OH)2悬浊液
(4)、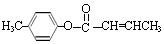 是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为 . (5)、遇FeCl3溶液呈紫色,且苯环上有两个取代基的A的同分异构体有种,E在一定条件下可以生成高聚物F,F的结构简式为 .
是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为 . (5)、遇FeCl3溶液呈紫色,且苯环上有两个取代基的A的同分异构体有种,E在一定条件下可以生成高聚物F,F的结构简式为 .