2017年北京市西城区高考化学二模试卷
试卷更新日期:2017-08-16 类型:高考模拟
一、选择题
-
1. 下列材料中不属于有机高分子化合物的是( )
A
B
C
D

宇宙飞船外壳

光导纤维

宇航服

尿不湿
酚醛树脂
二氧化硅
聚酯纤维
聚丙烯酸钠
A、A B、B C、C D、D2. 下列事实与水解反应无关的是( )A、用Na2S除去废水中的Hg2+ B、用热的Na2CO3溶液去油污 C、利用油脂的皂化反应制造肥皂 D、配制CuSO4溶液时加少量稀H2SO43. 下列事实不能用元素周期律解释的是( )A、酸性:HClO4>H2SO4 B、Na、Mg与水反应,Na更剧烈 C、气态氢化物的稳定性:HF>HCl D、向Na2SO3溶液中加盐酸,有气泡产生4. 已知反应:2Fe3++2I﹣⇌2Fe2++I2 , 用KI溶液和FeCl3溶液进行如下实验.下列说法中,不正确的是( )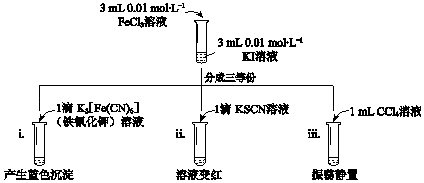 A、实验i中现象说明有Fe2+生成 B、实验ii中现象说明反应后溶液中含有Fe3+ C、实验iii水溶液中c(Fe2+)大于i中c(Fe2+) D、实验iii中再加入4滴0.1 mol•L﹣1 FeCl2溶液,振荡静置,CCl4层溶液颜色无变化5. 在一定条件下,利用CO2合成CH3OH的反应如下:
A、实验i中现象说明有Fe2+生成 B、实验ii中现象说明反应后溶液中含有Fe3+ C、实验iii水溶液中c(Fe2+)大于i中c(Fe2+) D、实验iii中再加入4滴0.1 mol•L﹣1 FeCl2溶液,振荡静置,CCl4层溶液颜色无变化5. 在一定条件下,利用CO2合成CH3OH的反应如下:CO2(g)+3H2(g)⇌H3OH(g)+H2O(g)△H1 ,
研究发现,反应过程中会有副反应:
CO2(g)+H2(g)⇌CO(g)+H2O(g)△H2 .
温度对CH3OH、CO的产率影响如图所示.下列说法中,不正确的是( )
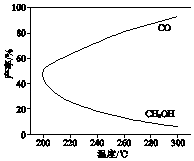 A、△H1<0,△H2>0 B、增大压强有利于加快合成反应的速率 C、生产过程中,温度越高越有利于提高CH3OH的产率 D、合成CH3OH反应的平衡常数表达式是K=6. 依据下列实验现象,不能得出对应结论的是( )
A、△H1<0,△H2>0 B、增大压强有利于加快合成反应的速率 C、生产过程中,温度越高越有利于提高CH3OH的产率 D、合成CH3OH反应的平衡常数表达式是K=6. 依据下列实验现象,不能得出对应结论的是( )实验
现象
结论
A
室温下测0.1mol•L﹣1醋酸pH
pH≈3.3
醋酸是弱酸
B
向2mL 0.1mol•L﹣1NaOH溶液中
i.滴加几滴同浓度的MgSO4溶液
ii.再滴加几滴同浓度FeCl3溶液
i.产生白色沉淀 ii.产生红褐色沉淀
溶解度:Fe(OH)3<Mg(OH)2
C
常温下,将CO2通入苯酚钠溶液中
溶液变浑浊
酸性:碳酸>苯酚
D
将少量溴乙烷与NaOH溶液共热,冷却、HNO3酸化后,滴加AgNO3溶液
淡黄色沉淀
证明含有溴元素
A、A B、B C、C D、D7. 工业酸性废水中的Cr2O72﹣可转化为Cr3+除去,实验室用电解法模拟该过程,结果如表所示(实验开始时溶液体积为50mL,Cr2O72﹣的起始浓度、电压、电解时间均相同).下列说法中,不正确的是( )实验
①
②
③
电解条件
阴、阳极均为石墨
阴、阳极均为石墨,
滴加1mL浓硫酸
阴极为石墨,阳极为铁,滴加1mL浓硫酸
Cr2O72﹣的去除率/%
0.922
12.7
57.3
A、对比实验①②可知,降低pH可以提高Cr2O72﹣的去除率 B、实验②中,Cr2O72﹣在阴极放电的电极反应式是Cr2O72﹣+6e﹣+14H+═2Cr3++7H2O C、实验③中,Cr2O72﹣去除率提高的原因是Cr2O72﹣+6 Fe2++14H+═2Cr3++6Fe3++7H2O D、实验③中,理论上电路中每通过6 mol电子,则有1 mol Cr2O72﹣被还原二、非选择题
-
8. 聚合物
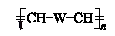 (W是链节中的部分结构)是一类重要的功能高分子材料.聚合物 X是其中的一种,转化路线如图:
(W是链节中的部分结构)是一类重要的功能高分子材料.聚合物 X是其中的一种,转化路线如图: 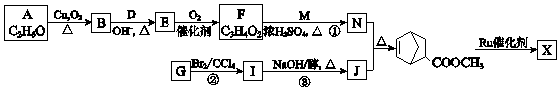
已知:
i.R1CHO+R2CH2CHO
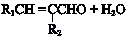
ii.
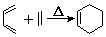
iii.R1CH=CHR2+R3CH=CHR4 R1CH=CHR4+R3CH=CHR2
(R代表烃基或氢原子)
(1)、A的结构简式是 .(2)、B所含的官能团名称是 .(3)、E的结构简式是 .(4)、①的化学方程式是 .(5)、②的反应类型是 .(6)、J是五元环状化合物,③的化学方程式是 .(7)、X的结构简式是 .9. MnSO4在工业中有重要应用.用软锰矿浆(主要成分为MnO2和水,含有Fe2O3、FeO、Al2O3和少量PbO等杂质)浸出制备MnSO4 , 其过程如下:I. 向软锰矿浆中通入SO2 , 锰、铁、铝、铅元素以离子形式浸出,测得浸出液的pH<2.
II. 向浸出液中加MnO2 , 充分反应后,加入石灰乳,调溶液pH=4.7.
III.再加入阳离子吸附剂,静置后过滤.
IV.滤液蒸发浓缩,冷却结晶,获得MnSO4晶体.
【资料】部分阳离子形成氢氧化物沉淀的pH
离子
Fe2+
Fe3+
Al3+
Mn2+
Pb2+
开始沉淀时的pH
7.6
2.7
3.8
8.3
8.0
完全沉淀时的pH
9.7
3.7
4.7
9.8
8.8
(1)、I中向软锰矿浆中通入SO2生成MnSO4 , 该反应的化学方程式是 .(2)、II 中加入MnO2的主要目的是;调溶液 pH=4.7,生成的沉淀主要含有和少量CaSO4 .
(3)、III中加入阳离子吸附剂,主要除去的离子是 .(4)、用惰性电极电解MnSO4溶液,可以制得高活性MnO2 .①电解MnSO4溶液的离子方程式是
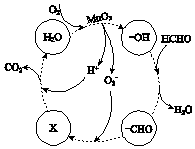
②高活性MnO2可用于催化降解甲醛,有关微粒的变化如图所示,其中X是 , 总反应的化学方程式是 .
10. 氨氮废水中的氮元素多以NH4+和NH3•H2O的形式存在.某工厂处理氨氮废水的流程如下:含NH4+的废水 低浓度氨氮废水 含余氯废水 达标废水
(1)、I中加入NaOH溶液,调pH=11并鼓入大量空气.用离子方程式表示加NaOH溶液的作用是;鼓入大量空气的目的是 .(2)、II中加入适量NaClO溶液,控制pH在6~7,将氨氮转化为无毒物质.①为了完全从废水中去除氨氮,加入的NaClO与水体中NH4+的物质的量之比最小是 .
②过程 II发生3个反应:
i.ClO﹣+H+═HClO
ii.NH4++HClO═NH2Cl+H++H2O (NH2Cl中Cl元素为+1价)
iii. …
已知:水体中以+1价形式存在的氯元素有消毒杀菌的作用,被称为“余氯”.图为NaClO加入量与“余氯”含量的关系示意图.其中氨氮含量最低的点是c点.
b点表示的溶液中氮元素的主要存在形式是(用化学式表示);反应iii的化学方程式是 .
 (3)、III中用Na2SO3溶液处理含余氯废水,要求达标废水中剩余Na2SO3的含量小于5mg•L﹣1 . 若含余氯废水中NaClO的含量是7.45mg•L﹣1 , 则处理10m3含余氯废水,至多添加10% Na2SO3溶液 kg(溶液体积变化忽略不计).11. 某小组同学设计如下实验,研究亚铁盐与H2O2溶液的反应.
(3)、III中用Na2SO3溶液处理含余氯废水,要求达标废水中剩余Na2SO3的含量小于5mg•L﹣1 . 若含余氯废水中NaClO的含量是7.45mg•L﹣1 , 则处理10m3含余氯废水,至多添加10% Na2SO3溶液 kg(溶液体积变化忽略不计).11. 某小组同学设计如下实验,研究亚铁盐与H2O2溶液的反应.【实验Ⅰ】
试剂:酸化的0.5mol•L﹣1FeSO4溶液(pH=0.2),5% H2O2溶液(pH=5)
操作
现象
取2mL上述FeSO4溶液于试管中,加入5滴5% H2O2溶液
溶液立即变为棕黄色,稍后,产生气泡.测得反应后溶液pH=0.9
向反应后的溶液中加入KSCN溶液
溶液变红
(1)、上述实验中H2O2溶液与FeSO4溶液反应的离子方程式是 .(2)、产生气泡的原因是(3)、【实验Ⅱ】试剂:未酸化的0.5mol•L﹣1FeSO4溶液(pH=3),5% H2O2溶液(pH=5)
操作
现象
取2mL 5% H2O2溶液于试管中,加入5滴上述FeSO4溶液
溶液立即变为棕黄色,产生大量气泡,并放热,反应混合物颜色加深且有浑浊.测得反应后溶液pH=1.4
将上述混合物分离,得到棕黄色沉淀和红褐色胶体.取部分棕黄色沉淀洗净,加4mol•L﹣1盐酸,沉淀溶解得到黄色溶液.初步判断该沉淀中含有Fe2O3 , 经检验还含有SO42﹣ . 检验棕黄色沉淀中SO42﹣的方法是 .
(4)、对于生成红褐色胶体的原因,提出两种假设:i. H2O2溶液氧化Fe2+消耗H+
ii.Fe2+氧化的产物发生了水解
①根据实验II记录否定假设 i,理由是
②实验验证假设 ii:取 , 加热,溶液变为红褐色,pH下降,证明假设 ii成立.
(5)、将FeSO4溶液加入H2O2溶液后,产生红褐色胶体,反应的离子方程式是(6)、【实验Ⅲ】若用FeCl2溶液替代FeSO4溶液,其余操作与实验 II相同,除了产生与 II相同的现象外,还生成刺激性气味气体,该气体能使湿润的蓝色石蕊试纸变红但不褪色.
产生刺激性气味气体的原因是 .
(7)、由实验Ⅰ、Ⅱ、Ⅲ可知,亚铁盐与H2O2反应的现象与(至少写两点)有关.