2017年重庆市中考化学预测试卷(一)
试卷更新日期:2017-08-16 类型:中考模拟
一、单项选择题
-
1. 下列属于化学变化的是( )A、冰块制成冰雕 B、石油蒸馏制得汽油 C、泥土烧成瓷器 D、瓷碗破碎2. 空气中,主要与维持自然生态平衡的“碳﹣氧循环”有关的气体是( )A、O2和CO2 B、H2O和CO2 C、O2和N2 D、CO2和N23. 为补充维生素C,医生可能会建议该同学饮食中适量增加( )A、面食 B、植物油 C、瘦肉 D、蔬菜、水果4. 小红家里的花卉叶黄株矮,农业技术人员说植物生长缺氮和磷,那么小红应购买下列哪一种化肥回家施用( )A、NH4HCO3 B、CO(NH2)2 C、K2CO3 D、(NH4)2HPO45. 如表列出了一些常见物质在常温下的pH范围,其中酸性最强的是( )
物质名称
肥皂水
菠萝汁
柠檬汁
泡菜
pH范围
9.5﹣10.5
3.3﹣5.2
2.0﹣3.0
3.4﹣4.0
A、肥皂水 B、菠萝汁 C、柠檬汁 D、泡菜6. 下列生活用品所使用的主要材料属于有机合成材料的是( )A、不锈钢厨具 B、陶瓷餐具 C、塑料保鲜膜 D、棉质口罩7. 2017年3月22日“世界水日”的主题是“Wastewater”(废水),旨在关注废水,并改善收集和处理废水的方式,实现废水安全再利用.下列做法与该主题无关的是( )A、家庭污水进行集中处理排放 B、工业用水尽可能循环利用 C、农作物采用大水浸灌 D、在乡镇普及中小型污水处理厂8. 一种新型氮化碳(C3N4)材料,它比金刚石还坚硬,可做切割工具.在C3N4中,C的化合价为+4,则N的化合价是( )A、5 B、3 C、﹣3 D、29. 下列图示的实验操作不正确的是( )A、给液体加热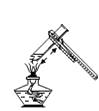 B、测溶液的pH
B、测溶液的pH 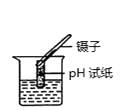 C、稀释浓硫酸
C、稀释浓硫酸 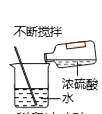 D、蒸发食盐水
D、蒸发食盐水  10. 2016年诺贝尔化学奖授予了在“分子机器”的设计和合成方面作出了杰出贡献的科学家.下列物质中,由分子构成的是( )A、金刚石 B、氢气 C、铁 D、硫酸铜11. 采取正确的措施,能够避免火灾发生或减少灾害损失.下列灭火方法不恰当的是( )A、油锅起火﹣﹣用锅盖盖灭 B、酒精灯着火﹣﹣用湿抹布盖灭 C、汽车油箱着火﹣﹣用水浇灭 D、森林起火﹣﹣砍伐树木形成隔离带12. 下列化学用语书写正确的是( )A、两个氧分子:2O B、三个二氧化硫分子:3SO2 C、水中氧元素的化合价为﹣2价: D、一个钙离子:Ca+213. 下列关于水和溶液的说法错误的是( )A、自然界中的水过滤后即变成纯水 B、硬水和软水可以肥皂水来鉴别 C、酒精的水溶液是均一稳定的混合物 D、水是最常见的良好溶剂14. 下列对实验现象的描述正确的是( )A、红磷在空气中燃烧产生大量白雾 B、铁锈在稀硫酸里浸泡一段时间后,铁锈消失,溶液变为浅绿色 C、向纯碱溶液中滴加酚酞溶液,溶液变为红色 D、向硫酸铜溶液中滴加氢氧化钠溶液,生成白色沉淀15. 食醋是厨房中常用的调味品,它含有乙酸,乙酸分子的模型如图所示,其中
10. 2016年诺贝尔化学奖授予了在“分子机器”的设计和合成方面作出了杰出贡献的科学家.下列物质中,由分子构成的是( )A、金刚石 B、氢气 C、铁 D、硫酸铜11. 采取正确的措施,能够避免火灾发生或减少灾害损失.下列灭火方法不恰当的是( )A、油锅起火﹣﹣用锅盖盖灭 B、酒精灯着火﹣﹣用湿抹布盖灭 C、汽车油箱着火﹣﹣用水浇灭 D、森林起火﹣﹣砍伐树木形成隔离带12. 下列化学用语书写正确的是( )A、两个氧分子:2O B、三个二氧化硫分子:3SO2 C、水中氧元素的化合价为﹣2价: D、一个钙离子:Ca+213. 下列关于水和溶液的说法错误的是( )A、自然界中的水过滤后即变成纯水 B、硬水和软水可以肥皂水来鉴别 C、酒精的水溶液是均一稳定的混合物 D、水是最常见的良好溶剂14. 下列对实验现象的描述正确的是( )A、红磷在空气中燃烧产生大量白雾 B、铁锈在稀硫酸里浸泡一段时间后,铁锈消失,溶液变为浅绿色 C、向纯碱溶液中滴加酚酞溶液,溶液变为红色 D、向硫酸铜溶液中滴加氢氧化钠溶液,生成白色沉淀15. 食醋是厨房中常用的调味品,它含有乙酸,乙酸分子的模型如图所示,其中 代表一个碳原子,
代表一个碳原子,  代表一个氢原子,
代表一个氢原子,  代表一个氧原子.下列说法错误的是( )
代表一个氧原子.下列说法错误的是( )  A、乙酸是一种化合物 B、乙酸的相对分子质量为60 C、乙酸中碳元素的质量分数为60% D、乙酸分子中的碳原子、氢原子、氧原子的个数比为1:2:116. 我国化工先驱侯德榜发明的“侯氏制碱法”利用饱和食盐水依次吸收氨和二氧化碳最终制的碳酸钠等产品,该法的主要反应为“NaCl+CO2+NH3+H2O═NaHCO3↓+NH4Cl”.下列有关叙述正确的是( )A、该方法制得的是火碱 B、析出晶体后,剩余溶液中溶质只有NH4Cl C、配制饱和食盐水时,可通过搅拌来提高食盐的溶解度 D、向饱和食盐水中先通入氨气使溶液呈碱性,能促进二氧化碳的吸收
A、乙酸是一种化合物 B、乙酸的相对分子质量为60 C、乙酸中碳元素的质量分数为60% D、乙酸分子中的碳原子、氢原子、氧原子的个数比为1:2:116. 我国化工先驱侯德榜发明的“侯氏制碱法”利用饱和食盐水依次吸收氨和二氧化碳最终制的碳酸钠等产品,该法的主要反应为“NaCl+CO2+NH3+H2O═NaHCO3↓+NH4Cl”.下列有关叙述正确的是( )A、该方法制得的是火碱 B、析出晶体后,剩余溶液中溶质只有NH4Cl C、配制饱和食盐水时,可通过搅拌来提高食盐的溶解度 D、向饱和食盐水中先通入氨气使溶液呈碱性,能促进二氧化碳的吸收二、填空题
-
17. 硫酸铜溶液的溶质、溶剂分别为CuSO4和H2O.回答下列有关问题.(1)、“CuSO4”中硫元素的化合价为 .(2)、猜想使硫酸铜溶液呈蓝色的离子可能是(用离子符号表示).(3)、“H2O”中数字2的含义是 .18. 生活中处处有化学,请根据所学化学知识回答下列问题.(1)、用洗涤剂清洗油污,是利用了洗涤剂的作用.(2)、氮气常用作保护气体,原因是 .(3)、天然气(主要成分为甲烷)作燃料时燃烧的反应方程式为 .19. 根据溶解度有关知识回答下列问题.(1)、如表是KNO3在水中的溶解度:
温度/℃
0
20
40
60
80
100
溶解度/g
13.3
31.6
63.9
110
169
246
①分析表中数据规律,要从KNO3溶液中分离出KNO3 , 适宜的结晶方法是 .
②60℃时,30g KNO3饱和溶液中溶质与溶剂的质量比为 .
(2)、水中的溶氧量大小对水生生物至关重要.①夏季为鱼池水补养,常用水泵将池水喷到空气中落下,其原理是 . (填序号)
A、增大氧气溶解度 B、增大水与空气的接触面积 C.升高水温
②下列大致图象中,不能反映氧气在水中溶解度规律的是 . (填序号)
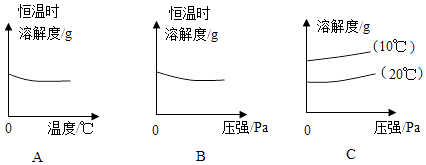 20. 氢臭酸(HBr)的性质与盐酸非常相似.回答下列有关问题:
20. 氢臭酸(HBr)的性质与盐酸非常相似.回答下列有关问题: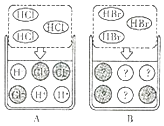 (1)、将紫色石蕊溶液滴入氢臭酸中,溶液将呈色.(2)、HCl在水中的解离可表示为:HCl═H++Cl﹣ , 其解离过程为 .(3)、烧碱在空气中容易变质,变质反应的方程式为 . 若将氢臭酸滴入已经变质的烧碱溶液中,观察到有气泡现象产生,该过程中发生的化学方程式为 .21. “鍮石”是一种铜锌合金.北宋时,我国已出现了利用炉甘石(主要含ZnCO3)、铜、木炭的化合物冶炼这种合金的技术,并用于铸造实用器.(1)、炉甘石中ZnCO3所属的物质类别为(填“氧化物”“酸”“碱”或“盐”).(2)、“鍮石”比纯铜更有利用于铸造,原因是其熔点比纯铜更(填“高”或“低”).(3)、800℃时,炉甘石发生分解反应:ZnCO3 ZnO+X↑,反应中X的化学式为 .(4)、冶炼“鍮石”过程中,木炭与氧化锌反应的方程式为 .(5)、“鍮石”与盐酸反应可用于测定“鍮石”中锌的质量分数,测定中发生的化学反应的方程式为 .
(1)、将紫色石蕊溶液滴入氢臭酸中,溶液将呈色.(2)、HCl在水中的解离可表示为:HCl═H++Cl﹣ , 其解离过程为 .(3)、烧碱在空气中容易变质,变质反应的方程式为 . 若将氢臭酸滴入已经变质的烧碱溶液中,观察到有气泡现象产生,该过程中发生的化学方程式为 .21. “鍮石”是一种铜锌合金.北宋时,我国已出现了利用炉甘石(主要含ZnCO3)、铜、木炭的化合物冶炼这种合金的技术,并用于铸造实用器.(1)、炉甘石中ZnCO3所属的物质类别为(填“氧化物”“酸”“碱”或“盐”).(2)、“鍮石”比纯铜更有利用于铸造,原因是其熔点比纯铜更(填“高”或“低”).(3)、800℃时,炉甘石发生分解反应:ZnCO3 ZnO+X↑,反应中X的化学式为 .(4)、冶炼“鍮石”过程中,木炭与氧化锌反应的方程式为 .(5)、“鍮石”与盐酸反应可用于测定“鍮石”中锌的质量分数,测定中发生的化学反应的方程式为 .三、实验题
-
22. 为配制20℃时的饱和氯化钠溶液,并粗略测定此温度下氯化钠的溶解度,其化学小组进行了下列实验.
①称取20.0g氯化钠固体;
②20℃时,量取50mL水倒入烧杯中;
③将氯化钠逐步加入水中,用玻璃棒搅拌,至不能溶解;
④分离出未溶解的氯化钠,并称得所有剩余氯化钠质量为2.0g.
分析上述实验过程并回答下列问题:
(1)、实验中不会使用到下列仪器中的(填序号). (2)、步骤③中,玻璃棒的作用是 .(3)、步骤④中,分离出未溶解氯化钠的操作名称是 .(4)、经过实验,20℃时,氯化钠在水中的溶解度为g.(5)、步骤②中,若量取水时,仰视量筒读数,将导致所配饱和氯化钠溶液溶质的质量分数(填“偏大”“偏小”或“无影响”).23. 某班学生分三组分别做了二氧化碳制取和性质验证实验,如图所示.
(2)、步骤③中,玻璃棒的作用是 .(3)、步骤④中,分离出未溶解氯化钠的操作名称是 .(4)、经过实验,20℃时,氯化钠在水中的溶解度为g.(5)、步骤②中,若量取水时,仰视量筒读数,将导致所配饱和氯化钠溶液溶质的质量分数(填“偏大”“偏小”或“无影响”).23. 某班学生分三组分别做了二氧化碳制取和性质验证实验,如图所示.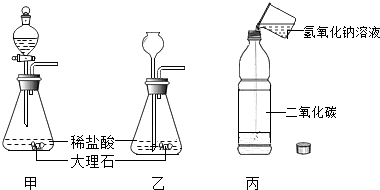 (1)、按甲或乙制取二氧化碳时,反应的化学方程式为 , 然后可用法收集二氧化碳.(2)、进行丙实验时,盖紧瓶塞振荡后,塑料瓶变瘪,其原因是 .(3)、实验结束后,老师取两份等质量的丙废液,分别与甲、乙废液混合,将甲废液与丙废液倒入烧杯A中,只有白色沉淀生成;将乙废液与丙废液倒入烧杯B中,有气泡产生.则:
(1)、按甲或乙制取二氧化碳时,反应的化学方程式为 , 然后可用法收集二氧化碳.(2)、进行丙实验时,盖紧瓶塞振荡后,塑料瓶变瘪,其原因是 .(3)、实验结束后,老师取两份等质量的丙废液,分别与甲、乙废液混合,将甲废液与丙废液倒入烧杯A中,只有白色沉淀生成;将乙废液与丙废液倒入烧杯B中,有气泡产生.则:①烧杯A的沉淀中一定有的成分是(用化学式填空,下同).
②甲废液与乙废液所含溶质的成分可能不同的是 .
③另取少量丙废液样品,加入足量的氯化钡溶液,有白色沉淀生成.过滤,向滤液中滴加氯化铁溶液,观察到有红褐色程沉淀生成,未发现其他明显现象.
由此推测出,烧杯A的上层清液中溶质中一定有的成分是 .
四、计算题
-
24. 某钢材酸洗车间为实现原材料高效利用,对盐酸酸洗后废液进行预处理得到质量分数为20.0%的FeCl2废液127.0kg,再经原理为4FeCl2+4X+O2 2Fe2O3+8HCl的二次处理后进行回收利用.(1)、上述原理中,X的化学式为 .(2)、通过上述原理和已知数据,可以计算出的量有 (填序号).A、产生上述127.0kg酸洗废液所消耗的稀盐酸质量 B、上述127.0kg废液中氯化亚铁的质量 C、理论上反应消耗氧气的质量 D、理论上可以回收的氧化铁的质量(3)、用上述所得HCl气体溶于水另配成14.6%的稀盐酸再利用,计算可得稀盐酸质量和配制时所需水的质量(写出计算过程).