2017年山东省济宁市曲阜市中考化学一模试卷
试卷更新日期:2017-08-15 类型:中考模拟
一、选择题
-
1. 物质的性质决定用途,下列物质的用途中利用其物理性质的是( )A、液氮用作制冷剂 B、镁粉用作照明弹 C、生石灰用作干燥剂 D、碘酒用作消毒剂2. 元素观是化学的重要观念之一,下列有关元素的说法中错误的是( )A、元素是具有相同核电荷数的一类原子的总称 B、元素周期表中元素的原子序数与该元素原子核电荷数在数值上相同 C、同种元素的原子核内质子数与中子数一定相等 D、在物质发生化学变化时,电子总数、原子总数、物质的总质量一定不变3. 2017年政府工作报告中指出:“环境污染形势依然严峻,特别是一些地区严重雾霾频发,治理措施需要进一步加强.”下列做法不利于减少空气污染的是( )A、减少化石燃料的使用 B、改进燃煤锅炉烟囱,将废弃排到高空 C、积极植树、造林、种草 D、增加使用太阳能、核能、太阳能等新能源4. 下列有关微观粒子的说法中,正确的是( )A、花香四溢,是因为分子在不断运动 B、大多数物体受热时体积增大,是因为受热时分子体积增大 C、搅拌能加快蔗糖在水中的溶解,是因为搅拌使蔗糖分子在水中溶解更多 D、电解水生成氢气和氧气,是因为水是由氢气和氧气组成的混合物5. 下列反应的化学方程式书写完全正确的是( )A、铁在氧气中燃烧2Fe+3O2 2Fe2O3 B、盐酸除铁锈Fe2O3+6HCl═2FeCl3+3H2O C、密闭容器中燃烧红磷验证质量守恒定律2P+O2 P2O5 D、CO还原氧化铁Fe2O3+3CO═2Fe+3CO26.
下列实验操作能够达到目的是( )
A
B
C
D

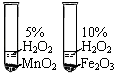


测定空气中氧气
含量
比较MnO2和Fe2O3
的催化效果
收集氧气并测量
氧气的体积
探究可燃物燃烧的
条件
A、A B、B C、C D、D7. 下列实验操作中(括号内为待检验物质或杂质)不能达到实验目的是( )选项
物质
目的
主要实验操作
A
CO、CH4气体
鉴别
点燃,火焰上方罩干冷烧杯,观察现象
B
Na2CO3(NaOH)溶液
检验
滴加酚酞试液,观察溶液颜色的变化
C
Na2CO3(NaHCO3)固体
除杂
充分加热至固体质量不变
D
MnO2、KCl固体
分离
溶解、过滤、洗涤、烘干、蒸发
A、A B、B C、C D、D8. 列表和作图是常用的数据处理方法.结合所绘图表判断下列说法正确的是( )氢氧化钠、碳酸钠分别在水、酒精中的溶解度
氢氧化钠
碳酸钠
20℃
40℃
20℃
40℃
水
109g
129g
21.8g
49g
酒精
17.3g
40g
不溶
不溶
 A、图象与表格均能反映温度对固体物质溶解度的影响,其中表格的优点是变化规律更直观 B、由表格数据可知,物质的溶解度只受温度影响 C、40℃时,将50g NaOH分别投入到100g水和酒精中都能得到饱和溶液 D、40℃时,将CO2通入饱和的NaOH酒精溶液中有沉淀生成9. 向一定质量FeCl2和CuCl2的混和溶液中逐渐加入足量的锌粒,下列图象不能正确反映对应关系的是( )A、
A、图象与表格均能反映温度对固体物质溶解度的影响,其中表格的优点是变化规律更直观 B、由表格数据可知,物质的溶解度只受温度影响 C、40℃时,将50g NaOH分别投入到100g水和酒精中都能得到饱和溶液 D、40℃时,将CO2通入饱和的NaOH酒精溶液中有沉淀生成9. 向一定质量FeCl2和CuCl2的混和溶液中逐渐加入足量的锌粒,下列图象不能正确反映对应关系的是( )A、 B、
B、 C、
C、 D、
D、 10. 某研究性学习小组调查发现,甲、乙两工厂排放的污水各含下列离子Ag+、Ba2+、Na+、Cl﹣、CO32﹣、NO3﹣中的三种离子,若两厂单独排放都会造成严重的水污染,如将两厂的污水按一定比例混合,沉淀后污水便会变成无色澄清只含硝酸钠而排放,污染程度会大大降低,关于污染源的分析,你认为正确的是( )A、CO32﹣和NO3﹣可能来自同一工厂 B、Cl﹣和CO32﹣不在同一工厂 C、Ag+和Na+不在同一工厂 D、Na+和NO3﹣来自同一工厂
10. 某研究性学习小组调查发现,甲、乙两工厂排放的污水各含下列离子Ag+、Ba2+、Na+、Cl﹣、CO32﹣、NO3﹣中的三种离子,若两厂单独排放都会造成严重的水污染,如将两厂的污水按一定比例混合,沉淀后污水便会变成无色澄清只含硝酸钠而排放,污染程度会大大降低,关于污染源的分析,你认为正确的是( )A、CO32﹣和NO3﹣可能来自同一工厂 B、Cl﹣和CO32﹣不在同一工厂 C、Ag+和Na+不在同一工厂 D、Na+和NO3﹣来自同一工厂二、填空与简答
-
11. 请从H、C、O、Ca四种元素中选一种或几种元素,写出一个符合下列要求的化学符号:(1)、由原子组成的单质;(2)、由分子组成的氧化物;(3)、由分子组成的有机物;(4)、由四个原子组成的酸根 .12. 化学就在我们身边,请用所学知识回答下列问题:(1)、在生活中,当水的硬度大或者病菌过多,可以采取的方法降低水的硬度和杀灭病菌.(2)、铁制品生锈是铁与共同作用的结果.(3)、银锌纽扣电池放电时,能转化为电能,主要发生反应为:Zn+Ag2O+H2O═Zn(OH)2+2Ag,反应前后锌元素的化合价由零价转变为价.13. 根据图中提供的信息,请回答下列问题:
 (1)、由A图可知,硅的相对原子质量为;(2)、B,C,D,E中属于同种元素的是;(3)、B,C,D,E中在化学反应中易失去电子的是 .14. 某科研小组设计利用稀硫酸浸取某废弃的氧化铜锌矿(主要成分为CuO和ZnO,其余成分既不与酸反应,也不溶解与水)的方案,实现废物综合利用,部分实验流程如下:
(1)、由A图可知,硅的相对原子质量为;(2)、B,C,D,E中属于同种元素的是;(3)、B,C,D,E中在化学反应中易失去电子的是 .14. 某科研小组设计利用稀硫酸浸取某废弃的氧化铜锌矿(主要成分为CuO和ZnO,其余成分既不与酸反应,也不溶解与水)的方案,实现废物综合利用,部分实验流程如下:请根据上述实验流程回答下列问题:
 (1)、操作1的名称是;(2)、在氧化铜锌矿中加入过量稀硫酸,写出其中反应的一个化学方程式;(3)、加过量铁粉后,溶液颜色为 , 发生反应的基本反应类型是 , 得到滤渣1的成分为(填化学式).15. 生活处处皆化学,从化学的视角看下列做法中正确的是(填序号).
(1)、操作1的名称是;(2)、在氧化铜锌矿中加入过量稀硫酸,写出其中反应的一个化学方程式;(3)、加过量铁粉后,溶液颜色为 , 发生反应的基本反应类型是 , 得到滤渣1的成分为(填化学式).15. 生活处处皆化学,从化学的视角看下列做法中正确的是(填序号).①误服重金属中毒,喝牛奶、豆浆等富含蛋白质的食品缓解
②香肠中加入过量亚硝酸钠防腐
③炒菜时油锅着火立即盖上锅盖
④食用牛奶可为人体补充蛋白质
⑤氢氧化钠溶液不慎沾在皮肤上,立即用大量的水冲洗,然后涂上硼酸溶液
⑥铵态氮肥与熟石灰混合使用可以明显提高肥效.
三、实验与探究
-
16. 探究学习小组在实验室中用下图所示装置制取 CO2并探究CO2与过氧化钠(Na2O2)的反应.

查阅资料得知:过氧化钠(Na2O2)是一种淡黄色固体,能与CO2、H2O 发生反应:2Na2O2+2CO2═2Na2CO3+O2 , 2Na2O2+2H2O═4NaOH+O2↑.
请回答下列问题:
(1)、装置A中发生反应的化学方程式为 , 利用装置 A 制取 CO2的优点是;(2)、装置B的作用是吸收CO2中混有的HCl,发生反应的化学方程式为;(3)、装置 D 的作用是;(4)、装置E中收集到的气体是(填化学式),该气体还可以用下图装置中的进行收集(填写字母序号); 17. 皮蛋是我国传统的蛋制品,深受人们喜爱,由少量 NaCl,CaO 和过量的 Na2CO3混合得到的粉末状混合物 A 是制皮蛋的配方之一.(1)、某化学兴趣小组从市场获取少量的混合物 A 于烧杯中,缓慢加入足量的蒸馏水,边加边搅拌,静置,过滤得滤液.滤液中含有 Cl﹣、OH﹣ , 还含有的阴离子是 .(2)、在混合物 A 中加入少量的 ZnSO4 可改善皮蛋品质,该兴趣小组获得某样品,探究混合物中是否添加了少量的 ZnSO4 .
17. 皮蛋是我国传统的蛋制品,深受人们喜爱,由少量 NaCl,CaO 和过量的 Na2CO3混合得到的粉末状混合物 A 是制皮蛋的配方之一.(1)、某化学兴趣小组从市场获取少量的混合物 A 于烧杯中,缓慢加入足量的蒸馏水,边加边搅拌,静置,过滤得滤液.滤液中含有 Cl﹣、OH﹣ , 还含有的阴离子是 .(2)、在混合物 A 中加入少量的 ZnSO4 可改善皮蛋品质,该兴趣小组获得某样品,探究混合物中是否添加了少量的 ZnSO4 .设计实验方案,完成下述表格.
实验操作
预期现象和必要结论
步骤1:取少量样品于烧杯中,缓慢加入足量蒸馏水,充分搅拌,静置,过滤
步骤2:取少量步骤1所得的滤液于试管中, .
步骤3: .
, 说明样品中有ZnSO4;
, 说明样品中没有ZnSO4 .
四、分析与计算
-
18. 如图是消炎药诺氟沙星胶囊的说明书,请阅读说明书回答以下问题:
 (1)、诺氟沙星中含种元素;(2)、诺氟沙星分子中氢、氧的原子个数比为 .19. 为测定某市售碳酸钙药品中碳酸钙的质量分数(杂质为SiO2 , 与稀盐酸不反应),某同学的方法是:将样品与稀盐酸反应,测定反应后生成的
(1)、诺氟沙星中含种元素;(2)、诺氟沙星分子中氢、氧的原子个数比为 .19. 为测定某市售碳酸钙药品中碳酸钙的质量分数(杂质为SiO2 , 与稀盐酸不反应),某同学的方法是:将样品与稀盐酸反应,测定反应后生成的CO2质量,再根据CO2的质量求出样品中碳酸钙的质量,从而计算出样品中碳酸钙的质量分数.为测定生成CO2的质量,他设计了如下实验方案(已知:无水氯化钙是常见的干燥剂):
①按图组装好装置,检查装置气密性后,在分液漏斗中加入过量稀盐酸,并在干燥管中加入适量无水氯化钙样品,称得装置和药品的总质量为564.57g;

②在广口瓶中加入碳酸钙样品,称得装置和药品的总质量为574.57g;
③旋紧橡皮塞,打开分液漏斗旋塞,向广口瓶中滴加稀盐酸,使样品与稀盐酸完全反应;
④反应结束后,称得装置及装置内所有物质的总质量为571.27g
请根据上述实验回答下列问题:
(1)、该方案测得样品中碳酸钙的质量分数是多少(写出详细解题过程)?(2)、该实验中用稀盐酸与碳酸钙样品反应,而不用浓盐酸与碳酸钙样品反应,其原因是 . 若实验中不用无水氯化钙干燥,则测得样品中碳酸钙的质量分数与上述实验计算结果相比(选填“偏小”或“不变”或“偏大”).