2017年浙江中考真题分类汇编(科学)专题:常见的物质—水、空气、金属
试卷更新日期:2017-08-15 类型:二轮复习
一、单选题
-
1.
科学家用石墨烯膜制成“筛子”,可以筛掉盐类物质。当海水流过该膜时,钠离子和氯离子被水分子包裹而不能通过,独立的水分子却能通过(如图)。下列关于石墨烯膜“筛掉”氯化钠的说法错误的是( )
 A、该过程属于物理变化 B、该过程可应用于海水淡化 C、“筛掉”氯化钠过程类似于过滤操作 D、“筛掉”氯化钠后的海水溶质质量分数增大2. 通过一步化学反应实现如图所示的X、Y、Z三种物质间转化,表格中X、Y、Z对应的物质不能实现这种转化的是( )
A、该过程属于物理变化 B、该过程可应用于海水淡化 C、“筛掉”氯化钠过程类似于过滤操作 D、“筛掉”氯化钠后的海水溶质质量分数增大2. 通过一步化学反应实现如图所示的X、Y、Z三种物质间转化,表格中X、Y、Z对应的物质不能实现这种转化的是( )
X
Y
Z
A
CO2
Na2CO3
CaCO3
B
CuO
Cu(NO3)2
Cu(OH)2
C
HCl
BaCl2
NaCl
D
Mg
MgO
MgCl2
A、A B、B C、C D、D3. 在试管中放入一根镁条(已除去氧化膜),往其中加入硝酸银溶液至浸没镁条,观察到如下现象:①镁条表面迅速覆盖一层疏松的固体物质,经检验发现生成的固体物质中单质银;
②镁条表面 有明显的气泡现象,经检验发现气泡中有氢气。
对于上述实验现象的分析错误的是( )
A、镁能从硝酸银溶液中置换出银 B、镁跟硝酸银溶液反应会生成氢气 C、镁投入硝酸银溶液中只发生2AgNO3+Mg=Mg(NO3)2+2Ag D、根据该实验可判断镁比银化学活动性强4. 工业上可用如下反应制取金属钡:2Al+4BaO 3Ba↑+Ba (AlO2)2。则下列说法正确的是( )A、反应物铝能被吸引 B、生成物Ba (AlO2)2属于氧化物 C、反应前后铝元素的化合价发生改变 D、该反应属于复分解反应5. 物质分类是重要的学习内容,下列物质属于氧化物的是( )A、O2 B、NaCl C、Fe2O3 D、C2H5OH6. 在柠檬中插入两种不同的金属可以制得水果电池。相同条件下,水果电池的电压与两种金属的活动性差异大小有关。下列柠檬电池的两种金属,活动性差异最大的是( )
A、 B、
B、 C、
C、 D、
D、 7.
7.往硝酸铜、硝酸银和硝酸亚铁的混合溶液中缓慢连续加入质量为m的锌粉,溶液中析出固体的质量与参加反应的锌粉质量关系如图所示,下列说法中正确的是( )
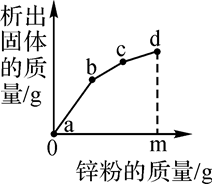 A、c点对应溶液中含有的金属离子为Zn2+和Cu2+ B、bc段(不含两端点)析出的金属是Fe C、ab段(不含两端点)对应溶液中含有的金属离子为Zn2+、Ag+、 Cu2+和Fe2+ D、若bc段和cd段中析出固体质量相等,参加反应的锌粉质量分别为m1和m2 , 则m1>m28. 近地面的臭氧是由于氮氧化物等在阳光照射下发生光化学反应产生的。下列说法错误的是( )
A、c点对应溶液中含有的金属离子为Zn2+和Cu2+ B、bc段(不含两端点)析出的金属是Fe C、ab段(不含两端点)对应溶液中含有的金属离子为Zn2+、Ag+、 Cu2+和Fe2+ D、若bc段和cd段中析出固体质量相等,参加反应的锌粉质量分别为m1和m2 , 则m1>m28. 近地面的臭氧是由于氮氧化物等在阳光照射下发生光化学反应产生的。下列说法错误的是( )
A、臭氧与氧气的化学性质不同 B、臭氧是空气质量指数的污染物之一 C、汽车尾气大量排放会导致臭氧污染 D、佩戴口罩能有效阻挡臭氧的吸入9.“浙中生态廊道”不仅是深化金华“五水共治”的新战场,也是一条集生态保护、休闲观光、文化体验于一体的“山水林田湖”生命共同体。下列关于“浙中生态廊道”的叙述不合理的是( )
 A、有利于治理水污染 B、可以杜绝酸雨的形成 C、有利于治理雾霾污染 D、有利于保护水域生态系统10.
A、有利于治理水污染 B、可以杜绝酸雨的形成 C、有利于治理雾霾污染 D、有利于保护水域生态系统10.如图为某文化衫图案,你的美(Mg)偷走我的心(Zn)能发生,是由于镁的( )
 A、延展性好 B、导电性好 C、导热性好 D、金属活动性比锌强11. 环境保护是我国的一项基本国策,下列做法不利于环境保护的是( )
A、延展性好 B、导电性好 C、导热性好 D、金属活动性比锌强11. 环境保护是我国的一项基本国策,下列做法不利于环境保护的是( )
A、生活污水未经处理就随意排放 B、农业生产中合理使用化肥 C、提倡使用节能技术和节能产品 D、尽量乘公交车或骑自行车出行二、填空题
-
12. 用溶质质量分数为98%、密度为1.84克/厘米3的浓硫酸配制溶质质量分数为10%的稀硫酸100毫升,计算时必须查阅的数据是。配制过程除使用量筒、玻璃棒和胶头滴管外,还需要的一种玻璃仪器是。
13.图甲为制取和收集二氧化碳的家庭实验装置,左边部分带小孔的眼药水瓶,下部可浸入和离开白醋,以控制反应进行与停止,它相当于乙图中的(选填字母)装置;该装置虚线框中应选用乙图中的(选填字母)装置来收集CO2气体;检验CO2气体是否集满的方法是。
 14. 以粗盐(含杂质Na2SO4、MgCl2、CaCl2、泥沙)为原料制备精盐。
14. 以粗盐(含杂质Na2SO4、MgCl2、CaCl2、泥沙)为原料制备精盐。
(1)、加水溶解后,用如图装置除去粗盐中的泥沙,玻璃棒的作用是。
 (2)、为除去Na2SO4、MgCl2、CaCl2 , 并得到中性的食盐溶液,下列所加试剂和操作:①加过量的Na2CO3溶液,②过滤,③加过量的NaOH溶液,④加适量的稀HCl,⑤加过量的BaCl2溶液,能达到目的的顺序是 。A、⑤③②①④ B、③⑤①④② C、③⑤①②④(3)、用pH试纸检验溶液是否呈中性的操作是。15.
(2)、为除去Na2SO4、MgCl2、CaCl2 , 并得到中性的食盐溶液,下列所加试剂和操作:①加过量的Na2CO3溶液,②过滤,③加过量的NaOH溶液,④加适量的稀HCl,⑤加过量的BaCl2溶液,能达到目的的顺序是 。A、⑤③②①④ B、③⑤①④② C、③⑤①②④(3)、用pH试纸检验溶液是否呈中性的操作是。15.为了研究可燃物的燃烧条件,某兴趣小组同学用如图所示装置进行了实验(白磷、红磷均不超过绿豆大小,锥形瓶中的白磷A与红磷C尽量拉开距离)。白磷的着火点为40℃,红磷的着火点为240℃。
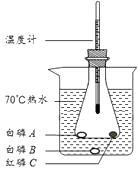 (1)、写出锥形瓶中发生的实验现象:。(2)、结合本实验目的,写出烧杯中70℃热水的作用:。
(1)、写出锥形瓶中发生的实验现象:。(2)、结合本实验目的,写出烧杯中70℃热水的作用:。
三、探究题
-
16.
许多科学发现从重视微小差异开始。科学家瑞利和拉姆塞正是重视氮气密度的微小差异,才最终发现了稀有气体氩气。
材料一:1892年瑞利发现,在相同条件下,由空气中除去氧气、二氧化碳、水蒸气和灰尘后获得的氮气,其密度为1.2572克/升;由含氮化合物反应并除去水蒸气后获得的氮气(NH4NO2==N2↑+2H2O),其密度为1.2505克/升,两者密度差值虽小;却完全超出了实验误差范围。
材料二:1894年4月瑞利和拉姆塞开始用如图装置进行“清除空气中氮气”的实验研究:在倒立圆底烧瓶内引入两根金属导线,通电使瓶中空气里的氧气和氮气生成氮的氧化物,用碱液来吸收生成的氮的氧化物和原有的二氧化碳气体。并从气体进口不断向瓶内补克氧气,使反应持续进行。

材料三:瑞利和拉姆塞又设计了另一实验装置,将上述实验所得的气体干燥后,通过红热的铜粉来除去其中的氧气,得到少量的剩余气体,对剩余气体做光谱分析得知,这是一种未知的气体,并测得其密度约是氮气的1.5倍。1894年8月13日他们共同宣布:发现了一种未知气体,并命名为氩气。
材料四:1898年拉姆塞等人利用不同的物质沸点不同,又发现了氪气、氖气、氙气。
根据上述材料,回答下列问题:
(1)、与纯净氮气密度值更接近的是由获得的氮气密度值(填“空气中”或“含氮化合物反应”);(2)、实验中不断向瓶内补充氧气的目的是;
(3)、在当时实验条件下,很难利用化学反应除去氩气,获知“未知气体”中还有其它气体存在,其理由是。
17.小峰和小刚阅读试剂标签后发现,市场销售的高锰酸钾晶体纯度高达99.5%,含水量可以忽略不计。为探究“试管放置方式对高锰酸钾制取氧气速度和体积的影响”,他俩设计了制取氧气的直立型装置(如图),并与斜卧型装置比较,在气密性良好的装置中分别加入5.0克高锰酸钾晶体,用同一酒精灯分别加热,用同一型号的集气瓶收集气体,每组实验进行五次,实验数据取平均值后记录如下表:
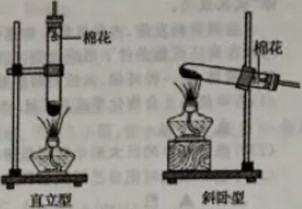
装置类型
直立型
斜卧型
收集1瓶氧气所需时间/秒
59
68
收集2瓶氧气所需时间/秒
95
108
收集氧气的总体积/毫升
525
476
(1)、收集2瓶氧气,所需时间较短的装置类型是;
(2)、等质量的高锰酸钾加热到不再产生气体,斜卧型装置收集到氧气的总体积比直立型少的原因是;(3)、根据2KMnO4 K2MnO4+MnO2+O2↑,算出5.0克高锰酸钾生成的氧气体积为理论值。实验中发现,斜卧型发生装置收集到的氧气体积明显大于理论值,他们对其原因进行了探究:【提出假设】
小峰假设:反应生成的二氧化锰在较高温度下受热分解放出氧气;
你的假设:。
【设计实验】要验证小峰的假设能否成立,请设计简明的实验方案。
18.在用氯酸钾和二氧化锰的混合物制取氧气实验后,为了进一步探究二氧化锰的用量对氯酸钾分解速度的影响,小明用如图装置,以及实验室提供的实验所需药品和器材进行实验。老师对实验的建议:①每组实验氯酸钾用量可取4克,二氧化锰质量不宜超过2克。②实验应设计4组。
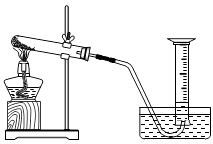 (1)、结合老师建议,补充完整实验步骤①之后的其它步骤。
(1)、结合老师建议,补充完整实验步骤①之后的其它步骤。①检查装置的气密性;
……
(2)、实验结束后,小明回收了二氧化锰。如果要证明二氧化锰是氯酸钾分解的催化剂,还需验证该二氧化锰的保持不变。
19. 整理实验器材时,小柯将还在反应的锌和稀硫酸的残留物,倒入有少量硫酸铜溶液的废液缸中,观察到锌粒表面产生气泡的速度大大加快。对此,他十分好奇:与硫酸铜溶液混合怎么会加快锌和稀硫酸的反应速度?查阅资料:①相互接触的两种活动性不同的金属,同时放入酸中,活动性较强的金属与酸反应产生氢气的速度会大大加快。 ②硫酸铜对锌和稀硫酸反应没有催化作用。
小柯根据下表进行实验,观察并记录现象。
组别
第一组
第二组
A
B
C
D
金属
锌片
绑有铜片的锌片
铁片
绑有铜片的铁片
30%硫酸溶液(mL)
20
?
20
20
产生气泡快慢
快
明显加快
慢
明显加快
(1)、第一组实验中“?”处的数据应为。(2)、为了定量比较产生气体的快慢,可以测量“收集相同体积的氢气所需的时间”或测量 , 然后进行比较。
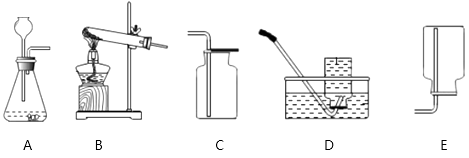
(3)、请推测与废液缸中少量硫酸铜溶液混合后,锌料与稀硫酸反应速度加快的原因。20.下面是实验室制取和收集气体的装置。如果用氯酸钾和二氧化锰来制取并收集一瓶干燥的氧气,应选择下列装置中的(用编号表示),检验这瓶氧气是否收集满的方法是 .
 21.
21.小金利用如图装置进行甲、乙对比实验,探究温度对CO和 Fe2O3反应的影响(固定装置略)
 (1)、从实验安全角度考虑,图示装置还应采取的改进措施是。(2)、完全反应后,两组的生成物均为黑色粉末(纯净物),分别用两组生成物进行以下实验:
(1)、从实验安全角度考虑,图示装置还应采取的改进措施是。(2)、完全反应后,两组的生成物均为黑色粉末(纯净物),分别用两组生成物进行以下实验:步骤
操作
甲组现象
乙组现象
1
称量黑色粉末质量/g
m1
m2
2
取黑色粉末,用磁铁吸引
能被吸引
能被吸引
3
取黑色粉末,加入稀盐酸
全部溶解,有大量气泡
无明显现象
4
取黑色粉末,加入足量硫酸铜溶液
有红色物质生成
无明显现象
①甲组的黑色粉末与稀盐酸反应的化学方程式是。
②小金查阅资料后发现Fe3O4在常温下不与稀盐酸、CuSO4溶液反应,故猜想乙组的生成物为Fe3O4。他又发现m2恰好g,这可成为支持上述猜想的新证据。
(3)、甲、乙两组实验说明温度对CO和Fe2O3反应有影响,且均体现出CO的(填写化学性质)。
四、解答题
-
22.
BaCl2是一种重金属盐,其水溶液具有很强的毒性。若误服了BaCl2溶液可立即服用MgSO4溶液解毒。为测定某BaCl2溶液的溶质质量分数,现取100克BaCl2溶液,不断加入MgSO4溶液,反应过程中溶液总质量与加入MgSO4溶液的质量关系如图所示,请回答:
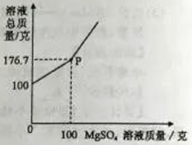 (1)、P点时溶液中的溶质名称是;
(1)、P点时溶液中的溶质名称是;
(2)、反应生成沉淀的最大质量为克;(3)、求原BaCl2溶液的溶质质量分数。