2020年中考科学一轮复习21.物质科学-酸和碱
试卷更新日期:2020-02-24 类型:一轮复习
一、单选题
-
1. 通过实验测得可乐、苏打水、食盐水、食醋的pH,图中表示苏打水的是( )
 A、A B、B C、C D、D2. 下列水果中,酸性最强的是( )A、柠檬pH=2.3 B、草莓pH=3 C、菠萝pH=4.1 D、木瓜pH=5.53. 在稀释浓硫酸时,一定要把浓硫酸沿着器壁慢慢注入水中,并不断搅拌,其主要原因是浓硫酸( )A、密度比水大 B、具有很强的腐蚀性 C、溶于水时放出大量的热 D、具有很强的吸水性4. 某品牌矿泉水做了如图所示广告:两个玻璃杯中分别盛有两种水样,水样中分别浸有pH试纸后,左侧一杯中的试纸呈现淡橘黄色(弱酸性),右侧一杯中的试纸呈现淡绿色(弱碱性)。广告宣称弱碱性的水对人体健康有利。下列有关叙述中错误的是( )
A、A B、B C、C D、D2. 下列水果中,酸性最强的是( )A、柠檬pH=2.3 B、草莓pH=3 C、菠萝pH=4.1 D、木瓜pH=5.53. 在稀释浓硫酸时,一定要把浓硫酸沿着器壁慢慢注入水中,并不断搅拌,其主要原因是浓硫酸( )A、密度比水大 B、具有很强的腐蚀性 C、溶于水时放出大量的热 D、具有很强的吸水性4. 某品牌矿泉水做了如图所示广告:两个玻璃杯中分别盛有两种水样,水样中分别浸有pH试纸后,左侧一杯中的试纸呈现淡橘黄色(弱酸性),右侧一杯中的试纸呈现淡绿色(弱碱性)。广告宣称弱碱性的水对人体健康有利。下列有关叙述中错误的是( ) A、右侧杯中的矿泉水能使无色酚酞变红色 B、右侧杯中的矿泉水一定含有氢氧根离子 C、将左侧杯中的pH试纸与标准比色卡对照,能读出水样的pH值为6.8 D、用pH试纸测定矿泉水的pH应该用洁净的玻璃棒蘸取后涂在试纸上5. 做完“二氧化碳的制取和性质”实验后,废液缸中盛有大量的盐酸与氯化钙的混合溶液(不考虑其他杂质)。某同学处理废液时做了如下实验:取废液缸中上层清液40mL于烧杯中,逐滴滴入Na2CO3溶液至过量。记录滴入Na2CO3溶液质量(x)与有关量的变化关系如图所示。下列判断正确的是( )
A、右侧杯中的矿泉水能使无色酚酞变红色 B、右侧杯中的矿泉水一定含有氢氧根离子 C、将左侧杯中的pH试纸与标准比色卡对照,能读出水样的pH值为6.8 D、用pH试纸测定矿泉水的pH应该用洁净的玻璃棒蘸取后涂在试纸上5. 做完“二氧化碳的制取和性质”实验后,废液缸中盛有大量的盐酸与氯化钙的混合溶液(不考虑其他杂质)。某同学处理废液时做了如下实验:取废液缸中上层清液40mL于烧杯中,逐滴滴入Na2CO3溶液至过量。记录滴入Na2CO3溶液质量(x)与有关量的变化关系如图所示。下列判断正确的是( ) A、C点溶液的pH=7 B、图中纵坐标(y)表示生成CO2的质量 C、反应进行到B点时,溶液中的溶质是NaCl D、OA段发生反应的化学方程式是Na2CO3+CaCl2=2NaCl+CaCO3↓6. 生活用品中厕所清洁剂的pH=1。厨房清洁剂的pH=12.下列说法不正确的是( )A、厕所清洁剂加水稀释,溶液pH升高 B、厨房清洁剂应该含有碱性物质 C、两者混合使用能提高清洁效果 D、厕所清洁剂会腐蚀铁制下水道7. 在氢氧化钠溶液与盐酸反应中。测得溶液的pH随滴入溶液体积变化情况如图。下列说法错误的是( )
A、C点溶液的pH=7 B、图中纵坐标(y)表示生成CO2的质量 C、反应进行到B点时,溶液中的溶质是NaCl D、OA段发生反应的化学方程式是Na2CO3+CaCl2=2NaCl+CaCO3↓6. 生活用品中厕所清洁剂的pH=1。厨房清洁剂的pH=12.下列说法不正确的是( )A、厕所清洁剂加水稀释,溶液pH升高 B、厨房清洁剂应该含有碱性物质 C、两者混合使用能提高清洁效果 D、厕所清洁剂会腐蚀铁制下水道7. 在氢氧化钠溶液与盐酸反应中。测得溶液的pH随滴入溶液体积变化情况如图。下列说法错误的是( ) A、随着滴入溶液体积增加,溶液钠离子个数增加 B、该实验是将盐酸逐滴加入一定量的氢氧化钠溶液中 C、当滴入溶液体积为5mL时,所得溶液中含有两种溶质 D、当滴入溶液体积为20mL时,所得溶液能使酚酞试液变红色8. 将20克10%的盐酸与20克10%的氢氧化钠溶液混合,下列物质中能跟该混合溶液发生反应的是( )A、氯化钡 B、氯化铁 C、硝酸钠 D、氢氧化钾9. 食盐、食醋、纯碱等均为家庭厨房中的常用物质,利用这些物质,你能做成功的家庭小实验是( )
A、随着滴入溶液体积增加,溶液钠离子个数增加 B、该实验是将盐酸逐滴加入一定量的氢氧化钠溶液中 C、当滴入溶液体积为5mL时,所得溶液中含有两种溶质 D、当滴入溶液体积为20mL时,所得溶液能使酚酞试液变红色8. 将20克10%的盐酸与20克10%的氢氧化钠溶液混合,下列物质中能跟该混合溶液发生反应的是( )A、氯化钡 B、氯化铁 C、硝酸钠 D、氢氧化钾9. 食盐、食醋、纯碱等均为家庭厨房中的常用物质,利用这些物质,你能做成功的家庭小实验是( )①检验自来水中的氯离子 ②鉴别食盐和纯碱
③探究鸡蛋壳是否含有碳酸盐 ④除去热水瓶中的水垢
A、①②③④ B、①③ C、②④ D、②③④10. 现有下列5种物质:①浓盐酸 ②石灰水 ③碳酸钠晶体 ④烧碱 ⑤浓硫酸,把他们长期露置在空气中,其中会发生化学变化且质量增加的是:( )A、①、② B、②、④ C、②、③ D、④、⑤11. 无论在工农业生产、生活中,还是科学研究中,都需要注意安全,下列关于氢氧化钠使用正确的是( )A、去除胃酸过多用氢氧化钠 B、浓硫酸不慎溅到皮肤上,最后用氢氧化钠溶液处理 C、中和酸性土壤用氢氧化钠 D、精炼石油时,用氢氧化钠去除过多的硫酸12. 氢氧化钠、氢氧化钙都是常见的碱,我们之所以认为它们是碱,是因为它们( )A、都能与酸反应 B、电离时生成的阴离子只有OH- C、遇紫色石蕊试液变蓝色 D、溶液的pH大于713. 已知氢氧化锂是一种可溶性碱,下列关于氢氧化锂溶液的描述错误的是( )A、氢氧化锂溶液可使酚酞溶液变红色 B、氢氧化锂溶液能与硫酸反应 C、氢氧化锂溶液能与SO2反应 D、氢氧化锂溶液能与碳酸钙反应14. 物质性质决定它的用途,还决定了它的保存方法。固体NaOH具有以下性质:①白色片状固体 ②有腐蚀性 ③易吸收水分而潮解 ④易溶于水,溶解放热 ⑤能与空气中的二氧化碳反应。实验室中必须将它密封保存的主要原因是( )A、①② B、①②③ C、②③④ D、③⑤二、填空题
-
15. 科学实验方案是根据特定实验目的而设计的。学习了“酸能使紫色石蕊试液变色”的知识后,进一步了解到“盐酸能电离产生H+和Cl- , 氯化钠能电离产生Na+和Cl-”。为深人研究某一问题,小科同学设计了如图所示的实验方案,请回答:
 (1)、往三支试管中分别滴人2滴紫色石蕊试液后,乙试管中的溶液将变为色;(2)、小科设计的实验方案研究的主要问题是。16. 有10mL稀盐酸(其中滴有少量紫色石蕊试剂)的烧杯中加入氢氧化钠溶液,用pH计(测pH的仪器)测定溶液的pH,所得数据如下。请分析并回答下列问题:
(1)、往三支试管中分别滴人2滴紫色石蕊试液后,乙试管中的溶液将变为色;(2)、小科设计的实验方案研究的主要问题是。16. 有10mL稀盐酸(其中滴有少量紫色石蕊试剂)的烧杯中加入氢氧化钠溶液,用pH计(测pH的仪器)测定溶液的pH,所得数据如下。请分析并回答下列问题:加入NaOH溶液的体积/mL
0
2
4
6
8
10
12
14
烧杯中溶液的pH
1.1
1.2
1.4
1.6
2.0
7.0
11.0
12.2
(1)、当加入氢氧化钠溶液的体积为 mL时,稀盐酸和氢氧化钠溶液恰好完全反应;(2)、当加入氢氧化钠溶液的体积为13mL时,溶液显色;(3)、当烧杯中溶液的pH=1.4时,溶液中的溶质有哪些?(填化学式表示)17. 中和反应在日常生活和工农业生产中有广泛应用。(1)、农业上可用来降低土壤的酸性,改良土壤结构的物质是。(填化学式)(2)、医疗上可用含氢氧化镁的药物来中和过多的胃酸(视为盐酸),有关反应的化学方程式为。(3)、取某硫酸厂排出的一定体积的废水与一定量的氢氧化钠溶液混合后,溶液恰好呈中性。若改用与该氢氧化钠溶液的质量和溶质质量分数均相同的氢氧化钾溶液与上述一定体积的废水混合,则所得溶液的pH7(填“>”、“<”或“=”)。18. “果导片”是一种常用缓泻剂,主要成分是酚酞。某同学欲将其作为酚酞指示剂的替代品,他将“果导片”研成粉末放入酒精中,搅拌、静置,取上清液滴入白醋,看到 , 滴入稀烧碱溶液发现 , 从而确定“果导片”可作酸碱指示剂使用。当他用饮料吸管向滴有“果导片”清液的澄清的石灰水吹气时,可观察到现象,该反应的方程式为。三、解答题
-
19. 为探究酸和碱反应,甲、乙两同学做了如下两个实验,如图所示:
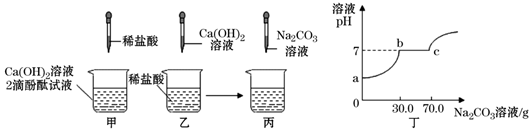 (1)、甲实验中当观察到时,表示酸和碱恰好完全反应。(2)、取乙反应后的溶液,滴加质量分数为26.5%的Na2CO3溶液,如图丙所示,反应过程中溶液的 pH变化如图丁所示,则曲线中 b点对应的溶液中所含的溶质有。(3)、计算丙实验中最终生成沉淀多少克?
(1)、甲实验中当观察到时,表示酸和碱恰好完全反应。(2)、取乙反应后的溶液,滴加质量分数为26.5%的Na2CO3溶液,如图丙所示,反应过程中溶液的 pH变化如图丁所示,则曲线中 b点对应的溶液中所含的溶质有。(3)、计算丙实验中最终生成沉淀多少克?