2017年广东省广州市南沙区中考化学模拟试卷
试卷更新日期:2017-08-15 类型:中考模拟
一、选择题
-
1. 下列变化属于物理变化的是( )A、鸡翅烤焦 B、烧碱潮解 C、食醋除水垢 D、肉类腐烂2. 胆矾是一种蓝色晶体,化学式是CuSO4•5H2O,胆矾受热时易失去结晶水,成为白色的无水CuSO4粉末,无水CuSO4易吸收水份又变成蓝色,在工业上精炼铜、镀铜等都要用胆矾.上述对胆矾的描述中,没有涉及到的是( )A、物理性质 B、用途 C、制法 D、化学性质3. 碳的单质中,质地较软,常用作电极的是( )A、金刚石 B、活性炭 C、炭黑 D、石墨4. 实验室制取气体选择收集方法时,对气体的下列性质不必考虑的是( )A、颜色 B、密度 C、溶解性 D、是否与水反应5. 已知A,B,C,D四种元素的化合价依次为+1、+3、﹣1、﹣2,则A,B,C,D四种元素中的某两种元素所组成的化合物的化学式正确的是( )A、CA B、AD C、B3C D、B2D36. 甲和乙可以合成清洁燃料丙,微观过程如图.下列说法错误的是( )
 A、丁的化学式为H2O2 B、丙中C,H,O的质量比为12:3:8 C、一定浓度的丙溶液可作消毒剂 D、该反应体现无机物可转化为有机物7. 化学与人类的衣、食、住、行密切相关.下列说法正确的是( )A、科学家用纳米线织出了碳纳米管布料,碳纳米管属于有机高分子材料 B、河南烩面美味营养,因为面条和瘦肉中富含蛋白质,蔬菜中富含维生素 C、郊游后的自行车经清洗后需要晾晒并在链条上涂油等,目的是防止自行车生锈 D、用石灰乳粉刷过的墙日久变硬,是因为水分的蒸发而留下固体氢氧化钙的缘故8. 为防冶酸雨,可将造纸厂回收的碱白泥(主要成分是碳酸钙和氢氧化钠)掺进煤中进行“固硫”.在该过程中不可能发生的化学反应有( )A、CaCO3 CaO+CO2↑ B、2NaOH+SO2=Na2SO3+H2O C、SO2+CaO CaSO3 D、CaCO3+2NaOH=Na2CO3+Ca(OH)29. 下列有关粒子结构示意图得出的结论中,正确的是( )
A、丁的化学式为H2O2 B、丙中C,H,O的质量比为12:3:8 C、一定浓度的丙溶液可作消毒剂 D、该反应体现无机物可转化为有机物7. 化学与人类的衣、食、住、行密切相关.下列说法正确的是( )A、科学家用纳米线织出了碳纳米管布料,碳纳米管属于有机高分子材料 B、河南烩面美味营养,因为面条和瘦肉中富含蛋白质,蔬菜中富含维生素 C、郊游后的自行车经清洗后需要晾晒并在链条上涂油等,目的是防止自行车生锈 D、用石灰乳粉刷过的墙日久变硬,是因为水分的蒸发而留下固体氢氧化钙的缘故8. 为防冶酸雨,可将造纸厂回收的碱白泥(主要成分是碳酸钙和氢氧化钠)掺进煤中进行“固硫”.在该过程中不可能发生的化学反应有( )A、CaCO3 CaO+CO2↑ B、2NaOH+SO2=Na2SO3+H2O C、SO2+CaO CaSO3 D、CaCO3+2NaOH=Na2CO3+Ca(OH)29. 下列有关粒子结构示意图得出的结论中,正确的是( )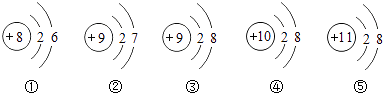 A、①②属于相对稳定结构 B、②③属于同种元素 C、③④⑤属于同种离子 D、①容易与④形成化合物10. 下列说法正确的是( )A、饱和溶液浓度一定比不饱和溶液浓度大 B、饱和溶液与不饱和溶液在一定条件下可相互转化 C、物质X的饱和溶液一定不能溶解Y物质 D、同一温度下,含有相同溶质的不饱和溶液的溶解度一定比饱和溶液的溶解度小11. 如图是探究铁锈蚀条件的装置.调节L端与R端的液面高度一致,塞紧木塞,一周后观察.下列推断正确的是( )
A、①②属于相对稳定结构 B、②③属于同种元素 C、③④⑤属于同种离子 D、①容易与④形成化合物10. 下列说法正确的是( )A、饱和溶液浓度一定比不饱和溶液浓度大 B、饱和溶液与不饱和溶液在一定条件下可相互转化 C、物质X的饱和溶液一定不能溶解Y物质 D、同一温度下,含有相同溶质的不饱和溶液的溶解度一定比饱和溶液的溶解度小11. 如图是探究铁锈蚀条件的装置.调节L端与R端的液面高度一致,塞紧木塞,一周后观察.下列推断正确的是( ) A、b管中铁钉一样会锈蚀 B、L端与R端液面高度仍然保持一致 C、该实验能说明铁锈蚀与空气、水都有关 D、若将a管中的水改为食盐水能加快铁的锈蚀12. 下列实验操作,能达到预期目的是( )
A、b管中铁钉一样会锈蚀 B、L端与R端液面高度仍然保持一致 C、该实验能说明铁锈蚀与空气、水都有关 D、若将a管中的水改为食盐水能加快铁的锈蚀12. 下列实验操作,能达到预期目的是( )①用托盘天平称取5.6gCuO粉末
②用10mL水和10mL酒精配制20mL酒精溶液
③将50g溶质质量分数为10%的稀盐酸加热蒸发掉25g水,得到溶质质量分数为20%的盐酸
④用10mL的量筒取8.2mL水.
A、①③④ B、①④ C、①②④ D、②③13. 取三种植物的花瓣分别放在研钵中,加入酒精研磨,得到花汁.各取少许花汁,用稀酸和稀碱进行检验,结果如下表所示:花的种类
花汁在酒精中的颜色
花汁在酸溶液中的颜色
花汁在碱溶液中的颜色
玫瑰
粉红色
粉红色
绿色
万寿菊
黄色
黄色
黄色
雏菊
无色
无色
黄色
则下列说法中正确的是( )
A、研磨花瓣过程中加入酒精是为了溶解其中的色素 B、25℃时,遇到pH=10的溶液,玫瑰花汁会变成粉红色 C、可用雏菊花汁来区别H2SO4和K2SO4溶液 D、上述三种花汁都能用作酸碱指示剂14. 如图,往容器内吹入一定量的空气,发生燃爆现象:硬纸板随热气流冲高,蜡烛熄灭.下列说法不正确的是( ) A、发生燃爆后体系的温度升高,氧气耗尽,蜡烛熄灭 B、蜡烛熄灭是因为蜡烛的着火点降低了 C、在有限的作业空间,要谨防可燃性粉尘发生燃爆事故 D、实验用的容器可用废旧矿泉水瓶,但不能用玻璃瓶15. 下列各组变化中,每一转化在一定条件下均能一步实现的是( )
A、发生燃爆后体系的温度升高,氧气耗尽,蜡烛熄灭 B、蜡烛熄灭是因为蜡烛的着火点降低了 C、在有限的作业空间,要谨防可燃性粉尘发生燃爆事故 D、实验用的容器可用废旧矿泉水瓶,但不能用玻璃瓶15. 下列各组变化中,每一转化在一定条件下均能一步实现的是( ) A、①和② B、②和③ C、①和④ D、③和④16. 推理是化学学习中常用的思维方法,下列推理正确的是( )A、酸溶液能使紫色石蕊试液变红,能使紫色石蕊试液变红的一定是酸 B、氢氧化钠能与二氧化碳反应生成盐和水,所以属于中和反应 C、碱溶液的pH>7,碳酸钠溶液的pH也大于7,所以它属于碱 D、氧化物有两种元素组成,其中一种元素为氧元素,所以水属于氧化物17. 如图所示,利用过量红磷进行空气中氧气含量的测定,下列图象能正确反映对应变化关系的是( )
A、①和② B、②和③ C、①和④ D、③和④16. 推理是化学学习中常用的思维方法,下列推理正确的是( )A、酸溶液能使紫色石蕊试液变红,能使紫色石蕊试液变红的一定是酸 B、氢氧化钠能与二氧化碳反应生成盐和水,所以属于中和反应 C、碱溶液的pH>7,碳酸钠溶液的pH也大于7,所以它属于碱 D、氧化物有两种元素组成,其中一种元素为氧元素,所以水属于氧化物17. 如图所示,利用过量红磷进行空气中氧气含量的测定,下列图象能正确反映对应变化关系的是( ) A、
A、 B、
B、 C、
C、 D、
D、 18. 现有一混合物的水溶液,只可能含有以下离子中的若干种:
18. 现有一混合物的水溶液,只可能含有以下离子中的若干种:Na+ , NH4+ , Ca2+ , Ba2+ , Cl﹣ , CO32﹣ , SO42﹣ , 现用三份该溶液进行如下实验:
①向第一份溶液加入硝酸银溶液,有白色沉淀;
②向第二份溶液加入氯化钡溶液,有白色沉淀生成,继续加入足量盐酸发现沉淀减少;
③向第三份溶液加入氢氧化钠溶液并加热,未观察到明显现象.
根据上述实验以下推断正确的是( )
A、该溶液中一定存在Cl﹣ B、该溶液中不一定存在Na+ C、该溶液中一定存在 Ba2+和 NH4+ D、该溶液中一定存在 SO42﹣和CO32﹣19. 有A、B两种混合粉末,质量分别为m1 , m2 . A由CaCO3和KHCO3组成,B由MgCO3和NaHCO3组成.将A、B分别与足量稀盐酸反应,生成二氧化碳气体的质量均为wg.下列说法正确的是( )①KHCO3的组成与NaHCO3相似,所以KHCO3+HCl=KCl+CO2↑+H2O
②21m1=25m2
③m1=m2
④混合物B中MgCO3和NaHCO3质量比可为任意比
⑤混合物A中CaCO3和KHCO3质量比一定为1:1.
A、①②④ B、①③⑤ C、②④⑤ D、①③④⑤20. 下列实验方案中,能达到实验目的是( )选项
实验目的
实验方案
A
分离碳酸钠和氢氧化钠的混合物
加入过量氢氧化钙溶液,过滤
B
除去氯化钠固体中的少量碳酸钠
加入适量稀盐酸,充分反应后,蒸发
C
检验二氧化碳气体中含有少量的一氧化碳
将混合气体依次通过灼热的氧化铁和澄清石灰水,观察澄清石灰水的变化
D
鉴别H2和CH4
分别点燃在火焰上方罩一干冷烧杯
A、A B、B C、C D、D二、非选择题
-
21. 化学广泛运用于生活生产上.请回答:(1)、“炉灶清洁剂”的主要成分是氢氧化钠,该清洁剂不能与皮肤直接接触的原因是 .(2)、生石灰常用于食品干燥剂,检验该干燥剂没有失效的方法是 .(3)、铁路工人在野外焊接钢轨时,点燃铝粉与三氧化二铁的混合物,在高温下发生置换反应生成氧化铝和;氮化铝(AlN)因耐高温、抗冲击、导热性好,被广泛用于大规模集成电路生产、陶瓷工业等,工业上是用氧化铝、氮气、单质碳在一定条件下反应生成AlN和CO,该反应的化学方程式为 .22. 请根据以下微粒图回答下列问题:(1)、图1表示反应的化学方程式为 .
 (2)、图2表示溶液A 和溶液B 混合后恰好完全反应的情况,请回答下列问题:
(2)、图2表示溶液A 和溶液B 混合后恰好完全反应的情况,请回答下列问题:①混合后观察到的实验现象是 .
②溶液B的溶质属于(填“氧化物”“酸”“碱”“盐”).
③当Cn﹣与Dm+的个数比为1:1时,请写出符合条件的任一反应的化学方程式 .
当Cn﹣与Dm+的个数比为2:1时,溶液B的溶质可能是(任写一种,填化学式).
当Cn﹣与Dm+的个数比为1:2时,则Cn﹣的离子符号为 .
 23. 如图是MgCl2、NaCl、MgSO4、KCl四种物质的溶解度曲线,请回答下列问题:
23. 如图是MgCl2、NaCl、MgSO4、KCl四种物质的溶解度曲线,请回答下列问题: (1)、20℃时,向两只盛有100g水的烧杯中,分别加入氯化钠、氯化镁两种物质,至不再溶解为止,所得溶液的溶质质量分数大的是溶液;(2)、卤水(提取食盐后的母液)含有MgCl2、NaCl、MgSO4、KCl.其中镁盐占70%以上,现需从卤水中提取KCl固体,采用下列方法:
(1)、20℃时,向两只盛有100g水的烧杯中,分别加入氯化钠、氯化镁两种物质,至不再溶解为止,所得溶液的溶质质量分数大的是溶液;(2)、卤水(提取食盐后的母液)含有MgCl2、NaCl、MgSO4、KCl.其中镁盐占70%以上,现需从卤水中提取KCl固体,采用下列方法:①将卤水加热蒸发水份就逐渐析出晶体A,滤出晶体得到母液R,根据右图所示溶解度曲线,晶体A中主要含有 , 理由是 .
②将母液R降温(降到30℃以下)析出晶体B,则晶体B主要含有 , 理由是 .
③将析出的晶体B,用一定量的冷水洗涤,就可以得到较纯的KCl固体,理由是 .
24. 某电镀厂排放的污水中含有CuSO4、FeSO4和ZnSO4 , 为减少水污染及节约成本,回收重要物质硫酸锌、金属铁和铜,设计如图所示流程:
回答下列问题:
(1)、固体b的成分是 .(2)、上述流程的四个操作中,有一个和其它三个不同,它是 .(3)、过程Ⅱ中可加入的物质有两种,它们是 . 过程Ⅲ中一定发生的化学反应方程式为 .(4)、上述物质中含有锌元素的是 .25.某校化学兴趣小组同学发现,长期使用的热水壶底部有一层水垢,水垢的主要成分是碳酸钙和氢氧化镁.他们为了测定水垢中碳酸钙的含量,将足量质量分数为10%的盐酸加入到10g水垢中,产生CO2气体的情况如图所示.
 (1)、水垢中碳酸钙的质量分数是多少?(2)、假设水垢中除碳酸钙和氢氧化镁外,不含有其它杂质,溶解10g水垢,至少需要质量分数为10%的盐酸的质量是(最后结果保留一位小数).26. 某校进行化学实验操作考查有以下四个考题:①粗盐提纯②酸的化学性质③二氧化碳的制取、收集和验满④氧气的制取、收集和验满.考查的方法是由考生抽签确定考题,小文同学抽签后被监考老师引导至准备了下列仪器和药品的实验台前:
(1)、水垢中碳酸钙的质量分数是多少?(2)、假设水垢中除碳酸钙和氢氧化镁外,不含有其它杂质,溶解10g水垢,至少需要质量分数为10%的盐酸的质量是(最后结果保留一位小数).26. 某校进行化学实验操作考查有以下四个考题:①粗盐提纯②酸的化学性质③二氧化碳的制取、收集和验满④氧气的制取、收集和验满.考查的方法是由考生抽签确定考题,小文同学抽签后被监考老师引导至准备了下列仪器和药品的实验台前:
请回答:
(1)、由实验台上提供的仪器和药品,你认为小文抽到的是第个考题.(2)、以下是小文完成该实验主要操作过程的示意图.按评分标准,每项操作正确得1分,满分5分,实验完毕后小文得了3分.请找出他失分的操作并说明原因:、 . (3)、上述仪器若增加(填一种玻璃仪器名称)还能组装成高锰酸钾制氧气的发生装置.该反应的化学方程式为 .27. 化学能转化为电能,在生产、生活中有重要的应用.
(3)、上述仪器若增加(填一种玻璃仪器名称)还能组装成高锰酸钾制氧气的发生装置.该反应的化学方程式为 .27. 化学能转化为电能,在生产、生活中有重要的应用.I.氢氧燃料电池是符合绿色化学理念的新型电池.
图1是氢氧燃料电池的示意图,要配制电池中100mL质量分数为30%的氢氧化钾溶液(密度约为1.290g/cm3),需称量 g固体氢氧化钾;电池工作时,H2和O2反应生成水,同时提供电能,溶液的pH(填“变大”“变小”“不变”).
Ⅱ.某学校研究小组对废干电池筒内的黑色物质(可能含有C、MnO2、ZnCl2、NH4Cl等)进行研究,实验过程如图2:

⑴操作①的玻璃棒的作用是 , 操作②的玻璃棒的作用是 .
⑵操作③灼烧滤渣发生反应的化学方程式为是 .
⑶操作④的试管中产生的气体能使带火星的木条复燃,产生该气体的化学方程式是 .
28. 众所周知,二氧化碳能使澄清的石灰水变浑浊(生成白色沉淀).但是,在分组实验中,向石灰水中通入二氧化碳(如图1所示),出现了意想不到的现象:有的石灰水未变浑浊;有的出现浑浊后又变澄清(沉淀消失).
【提出问题】分组实验中,出现意想不到现象的原因是什么呢?
(1)、【猜想与假设】I.石灰水未变浑浊,是因为二氧化碳中混有少量氯化氢气体.
Ⅱ.石灰水未变浑浊,是因为 .
Ⅲ.石灰水出现浑浊后又变澄清,与石灰水的浓度、通入二氧化碳的时间有关.
(2)、【进行实验】实验装置如图2所示.
提示:①实验中所用盐酸与分组实验所用盐酸相同;
②CO2在饱和NaHCO3溶液中的溶解度非常小.
步骤1:分别取一定体积的饱和澄清石灰水与一定体积的蒸馏水混合配制成50mL溶液.
步骤2:分别向50mL溶液中通入一段时间的二氧化碳,记录现象.
实验序号
V饱和石灰水/mL
V蒸馏水
/mL
出现现象所需时间/s
开始浑浊
明显浑浊
沉淀减少
是否澄清
①
50
0
19
56
366
持续通入CO28min以上,沉淀不能完全消失
②
40
10
24
51
245
③
30
20
25
44
128
④
20
30
27
35
67
89s后完全澄清
⑤
10
40
通3min以上,均无明显现象
【解释与结论】
⑴实验中,所用石灰水为饱和溶液的是(填序号).
⑵二氧化碳使澄清石灰水变浑浊原因是(用化学方程式表示).
⑶饱和NaHCO3溶液的作用是 .
⑷通过实验分析,猜想 I(填“成立”或“不成立”),猜想Ⅱ、Ⅲ成立.
【反思与评价】
⑸向澄清的石灰水中通入二氧化碳,为避免出现“意想不到的现象”,你的建议是 .
29. 某混合液中含有硝酸钠、硝酸钡和硝酸镁,现欲将三种物质逐一分离出来,请回答下列问题:限选试剂:蒸馏水、稀盐酸、稀硫酸、稀硝酸、氢氧化钾溶液、氢氧化钠溶液、澄清石灰水、
硫酸钾溶液、硫酸钠溶液、碳酸钾溶液、碳酸钠溶液、
(1)、要分离出硝酸钡溶液所需的试剂是 .(2)、请完成下列部分实验的实验报告实验步骤
实验现象
实验结论
① 取少量该混合液于试管中
加入溶液,振荡, ,
用蒸馏水洗涤滤渣;
②取洗涤后的滤渣加入 .
得到硝酸镁溶液
实验步骤①中洗涤后得到的洗涤液中含有的离子是(填离子符号).