四川省遂宁市2019-2020学年高一上学期化学期末考试试卷
试卷更新日期:2020-02-14 类型:期末考试
一、单选题
-
1. 中华民族有着光辉灿烂的发明史,下列发明创造不涉及氧化还原反应的是( )A、用胆矾炼铜 B、用铁矿石炼铁 C、黑火药的使用 D、打磨磁石制指南针2. 工业上所说的“液碱”,一般是指氢氧化钠的水溶液。以下是一些常用的危险品标志,装运“液碱”的包装箱应贴的图标是( )A、
 B、
B、 C、
C、 D、
D、 3. 下列试剂中,能用带玻璃塞的试剂瓶贮存的是( )A、氢氟酸 B、氢氧化钠 C、盐酸 D、水玻璃4. 下列叙述正确的是( )A、生铁的熔点高于纯铁 B、Na2O2、Mn2O7均属碱性氧化物 C、纯碱、明矾均属盐类 D、胶体能通过半透膜5. 今年11月18日射洪撤县设市,于当晚8点的焰火晚会也将庆祝活动推向了高潮。焰火与高中化学中“焰色反应”知识有关。下列有关“焰色反应”说法中正确的是( )A、焰色反应实验前铂丝应先用稀硫酸洗涤 B、NaCl与Na2SO4灼烧时火焰颜色相同 C、焰色反应均应透过蓝色钴玻璃观察 D、焰色反应属于复杂的化学变化6. 化学与生活密切相关,下列说法不正确的是( )A、高纯硅可用于制作光感电池 B、胃舒平(主要成分:氢氧化铝)可用于胃酸中和剂 C、铝合金大量用于高铁建设 D、生活中常用的玻璃、水泥和陶瓷材料均需用石灰石作工业原料生产7. 在水溶液中,下列电离方程式中正确的是( )A、NaHCO3=Na++H++CO32- B、Ca(OH)2=Ca2++(OH-)2 C、Ba(AlO2)2=Ba2++2AlO2- D、2Fe3++3SO42-=Fe2(SO4)38. 下列反应的离子方程式正确的是( )A、硫酸铜与Ba(OH)2溶液反应:Cu2++2OH-=Cu(OH)2↓ B、腐蚀法制作印刷线路板:2Fe3++Cu=2Fe2++Cu2+ C、向AlCl3溶液中加入足量的氨水:Al3++4OH-=AlO2-+2H2O D、将Na投入到CuSO4溶液中:2Na + Cu2+ =2Na+ + Cu9. 下列指定各组离子一定能大量共存的是( )A、无色透明溶液中:Na+、Fe3+、Cl-、SCN- B、与Al反应能放出H2的溶液中:K+、Ca2+、NO3-、HCO3- C、强碱性溶液中:Cu2+、Ba2+、SO42-、NO3- D、能使石蕊试液变红的溶液中:K+、Mg2+、Cl-、SO42-10. 下列实验方案设计合理的是( )A、用盐酸和硝酸银溶液来检验蒸馏水中是否存在氯离子 B、用饱和Na2CO3溶液除去CO2中的HCl气体 C、制取Fe(OH)2时需创造无Fe3+和无O2的环境 D、用氨水除去镁粉中的少量铝粉11. 下列说法中正确的是( )A、3S+6KOH=2K2S+K2SO3+3H2O中,被氧化和被还原的硫元素的质量之比为2∶1 B、在同温同压下,1体积A2(g)与3体积B2(g)反应生成2体积C(g),则C的组成为AB3 C、向海水中加入净水剂明矾可以使海水淡化 D、硫酸钡的水溶液不易导电,故硫酸钡是弱电解质12. 下列变化必须加入某种还原剂才能实现的是( )A、H2O2→H2O B、H2→HCl C、CaCl2→CaCO3 D、CO2→CO13. 下列各组中的两物质反应时,反应条件(温度、反应物用量比)改变,不会引起产物的种类改变的是( )A、Na和O2 B、Al2(SO4)3溶液和Ba(OH)2溶液 C、Na2O2和CO2 D、Ca(HCO3)2溶液和NaOH溶液14. NA表示阿伏加德罗常数的值,下列说法正确的是( )A、物质的量浓度为0.5mol·L-1的MgCl2溶液中,含有Cl-数为NA B、标准状况下,22.4LH2O中含有的分子数为NA C、常温常压下,4g氦气中含氦原子数为NA D、过氧化钠与水反应时,生成1mol氧气转移的电子数为4NA15. 用下图所示装置能达到有关实验目的是( )A、用
3. 下列试剂中,能用带玻璃塞的试剂瓶贮存的是( )A、氢氟酸 B、氢氧化钠 C、盐酸 D、水玻璃4. 下列叙述正确的是( )A、生铁的熔点高于纯铁 B、Na2O2、Mn2O7均属碱性氧化物 C、纯碱、明矾均属盐类 D、胶体能通过半透膜5. 今年11月18日射洪撤县设市,于当晚8点的焰火晚会也将庆祝活动推向了高潮。焰火与高中化学中“焰色反应”知识有关。下列有关“焰色反应”说法中正确的是( )A、焰色反应实验前铂丝应先用稀硫酸洗涤 B、NaCl与Na2SO4灼烧时火焰颜色相同 C、焰色反应均应透过蓝色钴玻璃观察 D、焰色反应属于复杂的化学变化6. 化学与生活密切相关,下列说法不正确的是( )A、高纯硅可用于制作光感电池 B、胃舒平(主要成分:氢氧化铝)可用于胃酸中和剂 C、铝合金大量用于高铁建设 D、生活中常用的玻璃、水泥和陶瓷材料均需用石灰石作工业原料生产7. 在水溶液中,下列电离方程式中正确的是( )A、NaHCO3=Na++H++CO32- B、Ca(OH)2=Ca2++(OH-)2 C、Ba(AlO2)2=Ba2++2AlO2- D、2Fe3++3SO42-=Fe2(SO4)38. 下列反应的离子方程式正确的是( )A、硫酸铜与Ba(OH)2溶液反应:Cu2++2OH-=Cu(OH)2↓ B、腐蚀法制作印刷线路板:2Fe3++Cu=2Fe2++Cu2+ C、向AlCl3溶液中加入足量的氨水:Al3++4OH-=AlO2-+2H2O D、将Na投入到CuSO4溶液中:2Na + Cu2+ =2Na+ + Cu9. 下列指定各组离子一定能大量共存的是( )A、无色透明溶液中:Na+、Fe3+、Cl-、SCN- B、与Al反应能放出H2的溶液中:K+、Ca2+、NO3-、HCO3- C、强碱性溶液中:Cu2+、Ba2+、SO42-、NO3- D、能使石蕊试液变红的溶液中:K+、Mg2+、Cl-、SO42-10. 下列实验方案设计合理的是( )A、用盐酸和硝酸银溶液来检验蒸馏水中是否存在氯离子 B、用饱和Na2CO3溶液除去CO2中的HCl气体 C、制取Fe(OH)2时需创造无Fe3+和无O2的环境 D、用氨水除去镁粉中的少量铝粉11. 下列说法中正确的是( )A、3S+6KOH=2K2S+K2SO3+3H2O中,被氧化和被还原的硫元素的质量之比为2∶1 B、在同温同压下,1体积A2(g)与3体积B2(g)反应生成2体积C(g),则C的组成为AB3 C、向海水中加入净水剂明矾可以使海水淡化 D、硫酸钡的水溶液不易导电,故硫酸钡是弱电解质12. 下列变化必须加入某种还原剂才能实现的是( )A、H2O2→H2O B、H2→HCl C、CaCl2→CaCO3 D、CO2→CO13. 下列各组中的两物质反应时,反应条件(温度、反应物用量比)改变,不会引起产物的种类改变的是( )A、Na和O2 B、Al2(SO4)3溶液和Ba(OH)2溶液 C、Na2O2和CO2 D、Ca(HCO3)2溶液和NaOH溶液14. NA表示阿伏加德罗常数的值,下列说法正确的是( )A、物质的量浓度为0.5mol·L-1的MgCl2溶液中,含有Cl-数为NA B、标准状况下,22.4LH2O中含有的分子数为NA C、常温常压下,4g氦气中含氦原子数为NA D、过氧化钠与水反应时,生成1mol氧气转移的电子数为4NA15. 用下图所示装置能达到有关实验目的是( )A、用 图装置证明密度ρ(苯)<ρ(钠)<ρ(水)
B、用
图装置证明密度ρ(苯)<ρ(钠)<ρ(水)
B、用 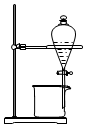 图装置分离酒精和四氯化碳
C、用
图装置分离酒精和四氯化碳
C、用 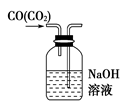 图装置除去CO气体中的CO2气体
D、用
图装置除去CO气体中的CO2气体
D、用 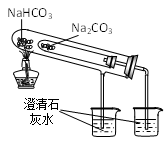 图装置比较NaHCO3和Na2CO3的热稳定性
16. 在下列各溶液中逐渐通入CO2气体直至过量,会出现沉淀先产生后消失现象的是( )
图装置比较NaHCO3和Na2CO3的热稳定性
16. 在下列各溶液中逐渐通入CO2气体直至过量,会出现沉淀先产生后消失现象的是( )①饱和Na2CO3溶液 ②澄清石灰水 ③BaCl2溶液 ④K2SiO3溶液 ⑤NaAlO2溶液
A、全部 B、只有③④ C、除①⑤ D、只有②17. 2V L Fe2(SO4)3溶液中含有a g SO42- , 取此溶液V L,用水稀释至2V L,则稀释后溶液中Fe3+的物质的量浓度为( )
A、 mol·L-1 B、 mol·L-1 C、 mol·L-1 D、 mol·L-118. 下列实验过程中出现异常情况,其可能原因分析不正确的是( )选项
异常情况
可能原因分析
A
萃取:液体静置不分层
加入萃取剂的量较多
B
分液:分液漏斗中的液体难以滴下
没有打开分液漏斗活塞,或玻璃塞上凹槽与漏斗口侧面的小孔没有对齐
C
蒸馏:温度计读数达到了馏分的沸点且历时10分钟,锥形瓶中却无液体
温度计位置不符合题意,或装置漏气,或冷凝水方向反了
D
检验Fe2+:加入KSCN溶液,溶液呈红色
Fe2+已部分被氧化成Fe3+
A、A B、B C、C D、D19. 在常温下发生下列几种反应:①16H++10Z−+2XO4-=2X2++5Z2+8H2O
②2A2++B2=2A3++2B−
③2B−+Z2=B2+2Z−
根据上述反应,判断下列结论不正确的是( )
A、①中X2+是还原产物 B、还原性强弱的顺序为:Z−>A2+ C、氧化性强弱的顺序为:XO4->B2 D、溶液中可发生:Z2+2A2+=2A3++2Z−20. 在密闭容器中充入CO2、CO、H2、CH4混合气体a g,若加入足量的Na2O2 , 充分振荡并不断用电火花引燃至反应完全,测得固体质量增加a g。则相同条件下,CO2与CH4的体积比为( )A、3:1 B、2:1 C、1:1 D、无法计算二、填空题
-
21. 现有下列六种物质:①Al②熔融KHSO4 ③Ba(OH)2固体④CO2 ⑤盐酸⑥Fe(OH)3胶体,请回答下列问题。(1)、上述物质中,属于强碱的是(填写物质的序号,下同),属于非电解质的是。在题中状态下既是电解质又能导电的是。(2)、①投入③的溶液中反应的离子方程式为。(3)、对物质⑥进行通电,观察到与电源负极相连的电极附近的现象是 , 可证明Fe(OH)3胶粒带电荷(填“ 正 ”或“ 负 ”) 。(4)、写出②在该状态下的电离方程式为。(5)、在③的水溶液中通入过量的④,请写出该反应的离子方程式为。
三、实验题
-
22. 实验室需要480mL1 mol·L-1 NaOH溶液,根据溶液配制情况回答下列问题:(1)、实验中除了托盘天平(砝码)、药匙、量筒、烧杯、玻璃棒外还需要的其他仪器有。(2)、下图是某同学在实验室配制该NaOH溶液的过程示意图,其中有不正确的是(填操作序号)。
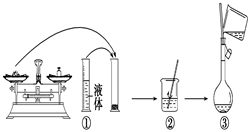
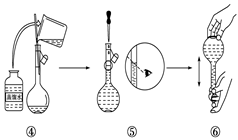 (3)、称取NaOH固体时,所需砝码的质量为____(填写字母)。A、19.2g B、20g C、19.2g ~20g D、大于20g(4)、在溶液的配制过程中,有以下基本实验步骤,其中只需进行一次的操作步骤的是(填写操作步骤的序号) 。
(3)、称取NaOH固体时,所需砝码的质量为____(填写字母)。A、19.2g B、20g C、19.2g ~20g D、大于20g(4)、在溶液的配制过程中,有以下基本实验步骤,其中只需进行一次的操作步骤的是(填写操作步骤的序号) 。①称量 ②溶解 ③转移 ④洗涤 ⑤定容 ⑥摇匀
(5)、下列操作会导致所配溶液的物质的量浓度偏高的是____。A、配制NaOH溶液时,NaOH固体中含有Na2O杂质 B、用蒸馏水溶解NaOH固体后,立即转入容量瓶中定容 C、定容后发现液面高于刻线,可用胶头滴管将多余的水吸出 D、定容时仰视刻度线 E、用托盘天平称量 NaOH 固体时,砝码生锈 F、配制前容量瓶中有少量水滴(6)、若某同学用密度为1.2g/cm3 , 质量分数为36.5%的浓盐酸配制100mL3mol/L的稀盐酸,需要用量筒量取浓盐酸的体积为mL。23.(1)、Ⅰ.我国的青海省有许多盐湖盛产食盐,人类与食盐关系密切,食盐在老百姓生活和现代社会的工农业生产中均有重要作用。粗盐中含Ca2+、Mg2+、SO42-以及泥沙等杂质,为了除去可溶性杂质,有以下实验步骤进行提纯: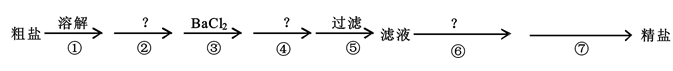
④步所加试剂是。
(2)、第⑥步发生反应的离子方程式为、。(3)、第⑦步的操作名称 , 需要的玻璃仪器有、。(4)、通过步骤⑤中过滤后的滤液,检验SO42-已除尽的操作方法是。(5)、Ⅱ.设阿伏加德罗常数为NA , 标准状况下,某O2和N2的混合气体m g含有b个分子,则n g该混合气体在相同状况下所占的体积是L。(6)、在xR2++yH++O2═mR3++nH2O的离子方程式中,对化学计量数m和R2+、R3+判断正确的是____。A、m=y,R3+是氧化产物 B、m=2y,R2+被氧化 C、m=2,R3+是氧化剂 D、m=4,R2+是还原剂(7)、用双线桥法标出下列反应的电子转移方向和数目。2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O四、推断题
-
24. 已知A是一种常见金属,部分反应物或生成物已略去。试根据图中转化关系,回答下列问题。
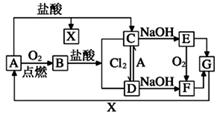 (1)、B的俗名为。(2)、保存C溶液时需加入少量A的原因是 , A与水蒸气反应的化学方程式为 , 该反应类型属于(填基本反应类型)(3)、E生成F可观察到的现象 , 化学方程式为。(4)、写出B→C化学方程式为 , C→D的离子方程式为。
(1)、B的俗名为。(2)、保存C溶液时需加入少量A的原因是 , A与水蒸气反应的化学方程式为 , 该反应类型属于(填基本反应类型)(3)、E生成F可观察到的现象 , 化学方程式为。(4)、写出B→C化学方程式为 , C→D的离子方程式为。
-