吉林省长春市榆树市2019-2020学年高一上学期化学期末考试试卷
试卷更新日期:2020-02-14 类型:期末考试
一、单选题
-
1. 下列化学用语①过滤 ②蒸馏 ③丁达尔效应 ④渗析 ⑤电泳 ⑥分液,适用混合物分离提纯的是( )A、①②③ B、①②④⑥ C、①②③④⑥ D、全部2. 下列试剂能贮存在磨口玻璃塞的试剂瓶里的是( )A、HF溶液 B、KOH溶液 C、盐酸 D、水玻璃3. 下列物质中既能跟稀H2SO4反应,又能跟氢氧化钠溶液反应的是( )
①NaHCO3②Al2O3③Al(OH)3 ④Al.
A、③④ B、②③④ C、①③④ D、全部4. 用NA表示阿伏加德罗常数,下列叙述正确的是( )A、标准状况下,22.4L H2O含有的分子数为1NA B、常温常压下,1.06g Na2CO3含有的Na+离子数为0.02NA C、通常状况下,1NA个CO2分子占有的体积为22.4L D、物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为1NA5. 下列各组物质与其用途的关系不正确的是( )A、过氧化钠:供氧剂 B、碳酸钠:治疗胃酸过多的一种泻药 C、氧化铝:耐火坩埚 D、明矾:净水剂6. 用4mol/L的硫酸溶液配制450mL0.2mol/L的硫酸溶液,用不到的仪器是( )A、托盘天平 B、胶头滴管 C、烧杯 D、500mL容量瓶7. 下列反应类型一定是氧化还原反应的是( )A、分解反应 B、置换反应 C、复分解反应 D、化合反应8. 将过量的CO2通入下列溶液中,一定能产生沉淀的是( )A、氢氧化钡溶液 B、氯化钙溶液 C、硅酸钠溶液 D、次氯酸钠溶液9. 下列叙述正确的是( )A、胶体的本质特征是丁达尔效应 B、焰色反应是元素的性质,属于化学变化 C、密度为1.84g/mL、98%的硫酸,其物质的量浓度为1.84mol/L D、NA个HCl分子的质量(以克为单位)与其相对分子质量在数值上相等10. 将铁的化合物溶于盐酸,滴加KSCN溶液不发生颜色变化,再加入适量氯水,溶液立即呈红色的是( )A、Fe2O3 B、FeCl3 C、Fe2(SO4)3 D、FeO11. 某同学配制一定浓度的NaOH溶液时,造成所配溶液浓度偏高的原因是( )A、所用NaOH已潮解 B、向容量瓶中加水未至刻度线 C、有少量NaOH溶液残留在烧杯里 D、移液前容量瓶中有少量蒸馏水12. 有NaCl、FeCl2、FeCl3、MgCl2、AlCl3这五种溶液,只用一种试剂就可以把它们鉴别出来,这种试剂是( )A、烧碱溶液 B、KSCN试剂 C、氨水 D、盐酸13. 反应KIO3+6KI=3I2+KI+3 H2O,氧化剂与还原剂的物质的量之比为( )A、1:1 B、1:6 C、1:5 D、5:114. 将固体X投入过量的Y中,能生成白色沉淀并放出一种无色气体,该气体能燃烧,不易溶于水,则X和Y分别可能是( )A、钠和氯化铝溶液 B、铝和烧碱溶液 C、氢氧化钠和氯化铁 D、锌和稀硫酸15. 某溶液中加入铝粉有氢气产生,该溶液中一定不能大量共存的离子组是( )A、Na+ NO3- CO32- Cl- B、ClO- Ba2+ Na+ AlO2- C、K+ Fe2+ NO3- Cl- D、Cl- Na+ K+ SO42-16. 已知在碱性溶液中可发生如下反应:2R(OH)3+3ClO-+4OH-=2RO4n-+3Cl-+5H2O。则RO4n-中R的化合价是( )A、3 B、4 C、5 D、617. CO2和氢氧化钠溶液反应,所得产物中Na2CO3和NaHCO3物质的量之比为3 :5 ,则参加反应的CO2和NaOH 的物质的量之比为( )A、3 :5 B、1 : 2 C、8 : 11 D、18 : 818. 已知还原性由强到弱的顺序为SO32-> I->Br- , 向NaBr、NaI、Na2SO3的混合溶液中通入一定量的氯气后,将溶液蒸干并充分灼烧,得到的剩余固体物质的组成可能是( )A、NaCl B、NaCl、Na2SO4、NaI C、NaCl、Na2SO4、I2 D、NaCl、NaBr、Na2SO4二、计算题
-
19.(1)、有①分液漏斗②量筒③容量瓶,使用前需检查是否漏液的是(填序号)(2)、molH2O中含有的氧原子数与1.5molCO2中含有的氧原子数相等。(3)、标准状况下的四种气体:①6.72LCH4②3.01×1023个HCl分子③13.6gH2S④0.2molNH3 , 密度最大的是(填序号)(4)、10mL的CaCl2溶液里含2gCa2+ , 从中取出一半的溶液中Cl-的物质的量浓度是。(5)、在Na2SO4和K2SO4的混合溶液中c(Na+)=0.2mol/L,c(SO42-)= amol/L,c(K+)=bmol/L时,a和b的关系是。(6)、某物质A加热时按化学方程式2A=2B+C+3D分解,产物均为气体,测得由生成物组成的混合气体对H2的相对密度为20,则反应物A的摩尔质量为。(7)、下列物质中:①铜 ②碳酸钙 ③氨气 ④氯气 ⑤空气 ⑥二氧化碳 ⑦氯化钠晶体 ⑧熔融硫酸钠。
属于电解质的是 , 非电解质的是。
三、实验题
-
20. 兴趣小组探究实验室中制备Cl2的过程,为证明过程中有水蒸气和HCl挥发出来,同时证明Cl2的某些性质,甲同学设计了如图所示的实验装置,按要求回答问题:
 (1)、若用浓盐酸与足量的MnO2反应制Cl2。MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O。
(1)、若用浓盐酸与足量的MnO2反应制Cl2。MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O。①用双线桥表示该反应的电子转移。
②作氧化剂 ,作还原产物。
(2)、①装置B中盛放的试剂名称为 , 作用是。②装置D和E中出现的不同现象说明的问题是。
③写出装置G中发生反应的离子方程式:。
四、推断题
-
21. 已知A是一种常见的一种金属,F是一种红褐色的沉淀。试根据图中转化关系,回答下列问题。
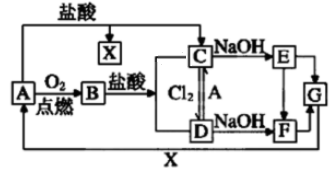 (1)、写出A,B,D,E的化学式:A、B、D、E。(2)、检验D中阳离子的方法:。(3)、保存C溶液时为什么加固体A。(4)、写出下列转化的离子方程式
(1)、写出A,B,D,E的化学式:A、B、D、E。(2)、检验D中阳离子的方法:。(3)、保存C溶液时为什么加固体A。(4)、写出下列转化的离子方程式①C→E。
②A→C。
22. 1L某混合溶液,可能含有的离子如下表:可能大量含有的阳离子
H+、Mg2+、Al3+、NH4+
可能大量含有的阴离子
Cl-、CO32-
往该溶液中逐滴加入NaOH溶液,产生沉淀的物质的量(n)与加入NaOH溶液的体积(V)的关系如图所示。(NH4++OH- =NH3·H2O)
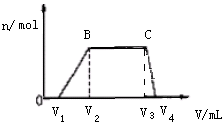 (1)、该溶液中一定不含有的离子是。(2)、V1、V2、V3、V4之间的关系。(3)、V3V4段离子方程式为。
(1)、该溶液中一定不含有的离子是。(2)、V1、V2、V3、V4之间的关系。(3)、V3V4段离子方程式为。
-
-