湖南省常德市2019-2020学年高一上学期化学期末考试试卷
试卷更新日期:2020-02-14 类型:期末考试
一、单选题
-
1. 《本草纲目》中“烧酒”条目写道:“自元时始创其法,用浓酒和糟人甑,蒸令气上……其清如水,味极浓烈,盖酒露也。”文中所用之“法”是指 ( )A、蒸馏 B、渗析 C、萃取 D、过滤2. 朱自清在《荷塘月色》冲写道:“薄薄的青雾浮起在荷塘里……月光是隔了树照过来的,高处丛生的灌木,落下参差的班驳的黑影……”月光穿过薄雾形成的种种美景本质原因是( )A、空气中的小水滴颗粒直径大小约为1nm-100nm B、空气中的小水滴颗粒的布朗运动 C、雾是一种胶体,胶粒带相同电荷 D、发生丁达尔效应3. 化学与生活密切相关,下列有关说法正确的是( )A、含碳量越低,钢铁的性能越好 B、纯净的二氧化硅是制备光导纤维的原料 C、燃放烟花呈现出多种颜色是由于烟花中添加了Na、Cu、Fe、Pt等金属的单质 D、合金材料的组成元素一定全部是金属元素4. 我国具有独立知识产权的电脑芯片“龙芯一号”的问世,填补了我国计算机制造史上的一项空白。下列对晶体硅的有关叙述正确的是( )A、晶体硅的结构与金刚石类似 B、晶体硅的化学性质不活泼,常温下不与任何物质发生反应 C、晶体硅是一种良好的半导体材料,但是它提炼工艺复杂,价格昂贵 D、晶体硅具有金属光泽,故它属于金属材料,可以导电5. 下列操作中正确的是( )A、蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 B、蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的底部 C、萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 D、分液操作时,分液漏斗下端紧靠烧杯内壁6. 下列各组物质按照单质、化合物、混合物顺序排列的是( )A、石墨 Fe(OH)3胶体 澄清石灰水 B、氮气 干冰 冰水混合物 C、液态氧 CuSO4·5H2O 浓硫酸 D、硫粉 碘酒 含氧40%的氧化镁7. 下列叙述中正确的是( )A、置换反应不一定属于氧化还原反应 B、失电子数目越多,则还原剂的还原性就越强 C、反应前后元素化合价没有变化的反应一定不是氧化还原反应 D、氧化还原反应中,一种物质被氧化,另一种物质必被还原8. 下列各组中的离子在强酸性水溶液里能大量共存的是( )A、Ba2+、Na+、CO32-、NO3- B、K+、 CH3COO-、I-、Fe3+ C、Cu2+、Fe2+、SO42-、Cl- D、K+、Cl-、NO3-、HCO3-9. 下列对离子的检验及结论一定正确的是( )A、加入稀盐酸有气体生成,将气体通入澄清石灰水中溶液变浑浊,则溶液中一定有CO32- B、某无色溶液滴入无色酚酞试液显红色,该溶液一定显碱性 C、某溶液中滴加BaCl2溶液,生成不溶于稀硝酸的白色沉淀,该溶液中一定含SO42- D、验证烧碱溶液中是否含有Cl- , 先加稀盐酸除去OH- , 再加硝酸银溶液,有白色沉淀出现,证明含Cl-10. 在下列变化中,必须加入合适的氧化剂才能实现的是( )A、CuO→Cu B、H2O2→O2 C、CaCO3→CO2 D、FeCl2→FeCl311. 用NA表示阿伏加德罗常数的值,下列叙述正确的是( )A、常温下,0.5L 1.0 mol·L-1Na2SO4溶液中含有的氧原子数为2NA B、标况下,11.2 L H2O所含电子数为5NA C、2.4 g镁变为镁离子时失去的电子数为0.1NA D、常温常压下,32g氧气和臭氧的混合物中所含氧原子总数为2NA12. 已知5KCl+KClO3+3H2SO4=3Cl2↑+3K2SO4+3H2O,下列说法不正确的是( )A、KClO3是氧化剂 B、被氧化与被还原的氯元素的质量比为5:1 C、H2SO4既不是氧化剂又不是还原剂 D、1mol KClO3参加反应时有10mol电子转移13. 某学生利用如图装置对电解质溶液导电性进行实验探究。下列说法中正确的是( )
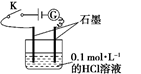 A、闭合开关K,电流计指针发生偏转,证明HCl溶液是电解质 B、闭合开关K,向烧杯中加入NaCl固体,由于HCl与NaCl不反应,故电流计指针不发生变化 C、闭合开关K,向溶液中加入CaCO3固体,电流计示数不变 D、选取相同浓度的硫酸替换0.1 mol·L-1的HCl溶液,电流计的示数相同14. 下列各组的两种物质在溶液中的反应,可用同一离子方程式表示的是( )A、氢氧化钠与硫酸;氢氧化钾与醋酸 B、BaCl2溶液与Na2SO4溶液;Ba(OH)2溶液与CuSO4溶液 C、氢氧化钠与硝酸;氢氧化钡与盐酸 D、Na2CO3溶液与硝酸溶液;NaHCO3溶液与硝酸溶液15. 在AlCl3、MgCl2、MgSO4的混合溶液中,c(Al3+)=0.10mol/L,c(Mg2+)=0.25mol/L,c(Cl-)=0.50mol/L,则c(SO42-)为A、0.10mol/L B、0.15mol/L C、0.20mol/L D、0.30mol/L16. 金属及其化合物的转化关系是化学学习的重要内容之一。下列各组物质的各步转化关系中不能通过一步反应完成的是( )A、Na→NaOH→Na2CO3 B、Fe→Fe(NO3)3→Fe(OH)3 C、Al→Al2O3→Al(OH)3 D、Mg→MgCl2→Mg(OH)217. 已知钡的活动性处于Na、K之间,则下列说法中可能实现的是( )A、Ba可从KCl溶液中置换出钾 B、Ba可从冷水中置换出氢 C、在溶液中Zn可还原Ba2+生成Ba D、Ba投入到NaOH溶液中,没有明显的现象18. 将下列四种化合物溶于稀盐酸,滴加硫氰化钾溶液,没有颜色变化,再加氯水即呈现红色的是( )A、FeO B、Fe2O3 C、Fe3O4 D、Fe2(SO4)319. 胆矾(CuSO4•5H2O)高温时发生反应:2CuSO4•5H2O
A、闭合开关K,电流计指针发生偏转,证明HCl溶液是电解质 B、闭合开关K,向烧杯中加入NaCl固体,由于HCl与NaCl不反应,故电流计指针不发生变化 C、闭合开关K,向溶液中加入CaCO3固体,电流计示数不变 D、选取相同浓度的硫酸替换0.1 mol·L-1的HCl溶液,电流计的示数相同14. 下列各组的两种物质在溶液中的反应,可用同一离子方程式表示的是( )A、氢氧化钠与硫酸;氢氧化钾与醋酸 B、BaCl2溶液与Na2SO4溶液;Ba(OH)2溶液与CuSO4溶液 C、氢氧化钠与硝酸;氢氧化钡与盐酸 D、Na2CO3溶液与硝酸溶液;NaHCO3溶液与硝酸溶液15. 在AlCl3、MgCl2、MgSO4的混合溶液中,c(Al3+)=0.10mol/L,c(Mg2+)=0.25mol/L,c(Cl-)=0.50mol/L,则c(SO42-)为A、0.10mol/L B、0.15mol/L C、0.20mol/L D、0.30mol/L16. 金属及其化合物的转化关系是化学学习的重要内容之一。下列各组物质的各步转化关系中不能通过一步反应完成的是( )A、Na→NaOH→Na2CO3 B、Fe→Fe(NO3)3→Fe(OH)3 C、Al→Al2O3→Al(OH)3 D、Mg→MgCl2→Mg(OH)217. 已知钡的活动性处于Na、K之间,则下列说法中可能实现的是( )A、Ba可从KCl溶液中置换出钾 B、Ba可从冷水中置换出氢 C、在溶液中Zn可还原Ba2+生成Ba D、Ba投入到NaOH溶液中,没有明显的现象18. 将下列四种化合物溶于稀盐酸,滴加硫氰化钾溶液,没有颜色变化,再加氯水即呈现红色的是( )A、FeO B、Fe2O3 C、Fe3O4 D、Fe2(SO4)319. 胆矾(CuSO4•5H2O)高温时发生反应:2CuSO4•5H2O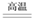 2CuO + 2SO2↑+ O2↑+ 10H2O。下列装置能达到实验目的的是( ) A、
2CuO + 2SO2↑+ O2↑+ 10H2O。下列装置能达到实验目的的是( ) A、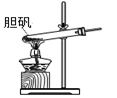 可用于胆矾分解
B、
可用于胆矾分解
B、 可用于检验产物是否含H2O
C、
可用于检验产物是否含H2O
C、 可用于收集SO2
D、
可用于收集SO2
D、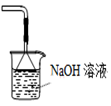 可用于吸收胆矾分解的SO2
20. 实验室中,要使AlCl3溶液中的Al3+离子全部沉淀出来,适宜的试剂是( )A、NaOH溶液 B、氨水 C、盐酸 D、Ba(OH)2溶液21. 有BaCl2和NaCl的混合溶液VL,将它分成两等份。一份滴加稀硫酸,使Ba2+完全沉淀;另一份滴加AgNO3溶液,使Cl-完全沉淀。反应中消耗amolH2SO4、bmolAgNO3。则原混合溶液中的c(Na+)为( )A、 mol/L B、 mol/L C、 mol/L D、 mol/L22. 在某体系内有反应物和生成物5种物质:H2S、S、FeCl3、FeCl2、HCl.已知H2S为反应物,则另一反应物是( )A、S B、FeCl2 C、FeCl3 D、HCl23. 根据下列反应的化学方程式:I2+SO2+2H2O=H2SO4+2HI,2FeCl2+Cl2=2FeCl3 , 2FeCl3+2HI=2FeCl2+2HCl+I2 , 判断有关物质的还原性强弱顺序是( )A、I->Fe2+>Cl->SO2 B、Cl->Fe2+>SO2>I- C、Fe2+>I->Cl->SO2 D、SO2>I->Fe2+>Cl-24. 在标准状况下把4.48 L CO2通过足量的Na2O2固体后,固体增加的质量是( )A、8.8 g B、5.6 g C、3.2 g D、2.4 g25. 下图是物质间发生化学反应的颜色变化,下表选项物质对应正确的是( )
可用于吸收胆矾分解的SO2
20. 实验室中,要使AlCl3溶液中的Al3+离子全部沉淀出来,适宜的试剂是( )A、NaOH溶液 B、氨水 C、盐酸 D、Ba(OH)2溶液21. 有BaCl2和NaCl的混合溶液VL,将它分成两等份。一份滴加稀硫酸,使Ba2+完全沉淀;另一份滴加AgNO3溶液,使Cl-完全沉淀。反应中消耗amolH2SO4、bmolAgNO3。则原混合溶液中的c(Na+)为( )A、 mol/L B、 mol/L C、 mol/L D、 mol/L22. 在某体系内有反应物和生成物5种物质:H2S、S、FeCl3、FeCl2、HCl.已知H2S为反应物,则另一反应物是( )A、S B、FeCl2 C、FeCl3 D、HCl23. 根据下列反应的化学方程式:I2+SO2+2H2O=H2SO4+2HI,2FeCl2+Cl2=2FeCl3 , 2FeCl3+2HI=2FeCl2+2HCl+I2 , 判断有关物质的还原性强弱顺序是( )A、I->Fe2+>Cl->SO2 B、Cl->Fe2+>SO2>I- C、Fe2+>I->Cl->SO2 D、SO2>I->Fe2+>Cl-24. 在标准状况下把4.48 L CO2通过足量的Na2O2固体后,固体增加的质量是( )A、8.8 g B、5.6 g C、3.2 g D、2.4 g25. 下图是物质间发生化学反应的颜色变化,下表选项物质对应正确的是( )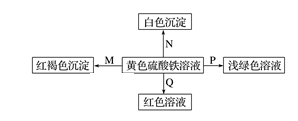
选项
M
N
P
Q
A
NH3·H2O
Ba(OH)2
铜
KSCN
B
Na
BaCl2
FeO
KSCN
C
NaOH
Ba(NO3)2
锌粉
KSCN
D
Na2O2
MgCl2
Fe
KSCN
A、A B、B C、C D、D二、填空题
-
26. 下列是五种物质的化学式,请按要求选择合适的序号填空:
A.NaHCO3 B.Na2CO3 C.Fe2O3 D.Ca(ClO)2 E. KAl(SO4)2·12H2O
(1)、俗称铁红的物质;(2)、一种常见净水剂;(3)、常用于焙制糕点的小苏打;(4)、制普通玻璃的原料是石英、石灰石和。27.(1)、按要求写出方程式:①HNO3(电离方程式) 。
②Fe2(SO4)3(电离方程式) 。
③硫酸钠和氯化钡溶液反应(离子方程式) 。
④二氧化碳通入足量氢氧化钠溶液(离子方程式)。
(2)、以下为中学化学中常见的几种物质:①二氧化碳 ②熔融KCl ③NaHSO4固体 ④铜 ⑤稀硫酸 ⑥澄清石灰水,其中属于电解质的有 , 属于非电解质的有(填序号)。三、实验题
-
28. 某研究小组同学欲探究某袋敞口放置一段时间的名为“硫酸亚铁家庭园艺精品肥料”的化肥的主要成分及相关性质。首先对该化肥的成分进行了如下假设:
a.只含有FeSO4
b.含有FeSO4和Fe2(SO4)3
c.只含有Fe2(SO4)3
将化肥固体粉末溶于水中得到溶液(记为X),进行如下实验:
实验序号
操作
现象
ⅰ
取2 mL溶液X,加入1 mL 1 mol·L-1 NaOH溶液
产生红褐色沉淀
ⅱ
取2 mL溶液X,加入1滴KSCN
溶液显红色
(1)、请用文字表述做出假设b的依据是。(2)、对实验ⅰ的预期现象是产生白色沉淀、变为灰绿色、最后出现红褐色沉淀,预期产生该现象的依据是(用化学方程式或离子方程式表达)、。(3)、由实验ⅱ得出的结论是。结合实验ⅰ、ⅱ,推测实验ⅰ实际现象与预期现象不符的原因可能是。为进一步验证假设,小组同学进行了以下实验:实验序号
操作
现象
ⅲ
取2 mL溶液X,加入1滴KSCN,再加入1 mL水
溶液显红色
ⅳ
取2 mL溶液X,加入1滴KSCN,再加入1 mL氯水
溶液显红色,颜色比ⅲ深
(4)、实验ⅳ中氯水参加反应的离子方程式是。(5)、通过以上实验,可得到的结论是 , 请完整表达该结论是如何得出的。四、推断题
-
29. 有一包白色固体,可能含有Na2CO3、KNO3、KCl、BaCl2和CuSO4 , 按下列步骤实验。
①将该固体溶于水得无色溶液。
②向溶液中加入AgNO3溶液,得到白色沉淀,再加足量的稀HNO3 , 白色沉淀部分溶解并有气泡产生,把气体通入澄清石灰水,石灰水变浑浊。根据上述现象判断:
(1)、一定存在的物质是;一定不存在的物质是;可能存在的物质是;(2)、请写出白色沉淀部分溶解的化学方程式五、计算题
-
30. 把5.1g镁铝合金的粉末放入500mL1mol·L-1盐酸中,恰好完全反应。试计算:(1)、该合金中镁和铝的物质的量。(2)、将等质量的该合金投入到足量的氢氧化钠溶液中,求标况下放出气体的体积。
-
-