陕西省西安市2019-2020学年高一上学期化学期末考试试卷
试卷更新日期:2020-02-13 类型:期末考试
一、选择题
-
1. 下列行为不符合安全要求的是( )A、做实验剩余的金属钠直接丢弃在废液缸中 B、闻气体时用手轻轻扇动,使少量气体飘进鼻孔 C、配制稀硫酸时将浓硫酸慢慢倒入水中并不断搅拌 D、不慎洒出的酒精在桌上着火时,立即用湿毛巾盖火2. 设NA表示阿伏加德岁常数,下列叙述中正确的是( )A、常温常压下,11.2L二氧化碳含有的原子数等于1.5NA B、标准状况下,22.4L酒精中所含分了数为NA C、标准状况下,18g水所含原子数为NA D、常温常压下,48gO2与O3混合物含有的氧原子数为3NA3. 实验室里需用480mL 0.1mol·L-1的碳酸钠溶液,选取500mL容量瓶进行配制正确的是( )A、称取5.1 g Na2CO3 , 加入500mL水 B、称取13.7g Na2CO3·10H2O,配成500mL溶液 C、称取5.3 gNa2CO3 , 加入500mL水 D、称取14.3 g Na2CO3·10H2O,配成500mL溶液4. 在碱性溶液中能大量共存且溶液为无色透明的一组离子是( )A、K+、Na+、Cl-、CO32- B、NH4+、Na+、Cl-、SO42- C、Na+、HCO3-、NO3-、SO42- D、K+、MnO42-、Na+、Cl-5. 有关焰色反应的说法正确的是( )A、焰色反应是金属单质表现的性质 B、焰色反应是因为发生了化学变化而产生的 C、焰色反应看到黄色火焰并不能确定该物质一定不含钾元素 D、洗涤焰色反应中用到的铂丝可用稀硫酸代替稀盐酸6. 实验室里也可以利用以下反应制取少量氯气:2KMnO4+16HCl(浓)=2KCl+2MnCl2+8H2O+5Cl2↑,关于该反应的说法正确的是( )A、KMnO4中的锰元素被氧化 B、Cl2既是氧化产物,又是还原产物 C、HCl在反应中只表现还原性 D、每生成1 molCl2转移电子的物质的量为2mol7. 下列说法正确的是( )A、钠与CuSO4溶液反应:2Na+Cu2+=Cu↓+2Na+ B、Na2O2与水反应时,生成0.1molO2 , 转移的电子数为0.2NA C、Na2O2遇到湿润的紫色石蕊试纸后,石蕊试纸最终变成蓝色 D、在酒精灯加热条件下,Na2CO3和 NaHCO3固体都能发生分解8. 等物质的量且足量的两份铝分别与等浓度等体积的HCl与NaOH溶液充分反应后所得相同条件气体的体积比( )A、1:1 B、1:3 C、3:1 D、1:29. 下列有关铁及其化合物的说法中正确的是( )A、除去FeCl3溶液中的FeCl2杂质可以向溶液中通入氯气 B、铁与水蒸气在高温下的反应产物为Fe2O3和H2 C、Fe3O4为红棕色晶体 D、Fe(OH)2和Fe(OH)3都能在空气中稳定存在10. 下列试剂能盛装在玻璃塞试剂瓶中的是( )A、盐酸 B、氢氟酸 C、水玻璃 D、KOH溶液11. 硅及其化合物应用广泛,下列叙述正确的是( )A、硅酸钠可用于制备木材防火剂 B、SiO2既能和氢氧化钠溶液反应,也能和氢氟酸反应,是两性氧化物 C、光导纤维的主要成分是晶体硅 D、将CO2通入Na2SiO3溶液中有胶状沉淀生成,说明碳酸酸性比硅酸弱12. 氯气是一种很活泼的非金属单质,它具有较强的氧化性,下列叙述中不正确的是( )A、红热的铜丝在氯气里剧烈燃烧,生成棕黄色的烟 B、氯气能与水反应生成HClO和HCl,久置氯水最终变为稀盐酸 C、纯净的H2在Cl2中安静地燃烧,发出苍白色火焰,集气瓶口呈现雾状;光照H2和Cl2的混合气体时,因迅速化合而爆炸 D、通常状况下,干燥的氯气能和Fe反应13. 为除去CO2气体中混有的少量SO2气体杂质,可以采用的方法是( )A、通过酸性高锰酸钾溶液 B、通过澄清石灰水 C、通过饱和Na2CO3溶液 D、通过氢氧化钠溶液14. 关于氮的变化关系如图:则下列说法不正确的是( )
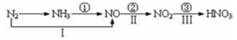 A、路线①②③是工业生产硝酸的主要途径 B、路线Ⅰ、Ⅱ、Ⅲ是雷电固氮生成硝酸的主要途径 C、上述所有反应都是氧化还原反应 D、上述反应中只有③属于氮的固定15. 下列气体只能用排水法收集的是( )A、NH3 B、SO2 C、NO2 D、NO16. 下列有关H2SO4的说法中正确的是( )A、将过量的Zn投入一定量的浓H2SO4中,最终生成的气体只有SO2 B、向装有Fe(NO3)2溶液的试管中加入稀H2SO4 , 在管口观察到红棕色气体 C、运输保存浓硫酸的槽罐车一旦泄露后应立即用大量水冲洗 D、向5mL18mol·L-1的硫酸中加入足量铜片并加热使其充分反应,生成0.045 mol SO217. 下列反应中的氨与反应4NH3+5O2 4NO+6H2O中的氨作用相同的是( )A、2Na+2NH3=2NaNH2+H2↑ B、2NH3+3CuO 3Cu+ N2+3H2O C、NH3+ HNO3=NH4NO3 D、3SiH4 +4NH3 =Si3 N4+12H218. 下列各组反应中,硝酸既表现了氧化性,又表现了酸性的是( )A、C+HNO3 B、H2S+HNO3 C、Fe(OH)3+HNO3 D、Cu+HNO319. 下列实验能达到目的的是( )
A、路线①②③是工业生产硝酸的主要途径 B、路线Ⅰ、Ⅱ、Ⅲ是雷电固氮生成硝酸的主要途径 C、上述所有反应都是氧化还原反应 D、上述反应中只有③属于氮的固定15. 下列气体只能用排水法收集的是( )A、NH3 B、SO2 C、NO2 D、NO16. 下列有关H2SO4的说法中正确的是( )A、将过量的Zn投入一定量的浓H2SO4中,最终生成的气体只有SO2 B、向装有Fe(NO3)2溶液的试管中加入稀H2SO4 , 在管口观察到红棕色气体 C、运输保存浓硫酸的槽罐车一旦泄露后应立即用大量水冲洗 D、向5mL18mol·L-1的硫酸中加入足量铜片并加热使其充分反应,生成0.045 mol SO217. 下列反应中的氨与反应4NH3+5O2 4NO+6H2O中的氨作用相同的是( )A、2Na+2NH3=2NaNH2+H2↑ B、2NH3+3CuO 3Cu+ N2+3H2O C、NH3+ HNO3=NH4NO3 D、3SiH4 +4NH3 =Si3 N4+12H218. 下列各组反应中,硝酸既表现了氧化性,又表现了酸性的是( )A、C+HNO3 B、H2S+HNO3 C、Fe(OH)3+HNO3 D、Cu+HNO319. 下列实验能达到目的的是( )A
B
C
D
实验室制备Fe(OH)2
实验室制氨气
制过氧化钠
验证浓H2SO4的脱水性、强氧化性


 A、A B、B C、C D、D20. 滴有酚酞的Ba(OH)2溶液显红色,在该溶液中分别滴加Ⅹ溶液后有下列现象下列说法不正确的是( )
A、A B、B C、C D、D20. 滴有酚酞的Ba(OH)2溶液显红色,在该溶液中分别滴加Ⅹ溶液后有下列现象下列说法不正确的是( )序号
装置
X溶液
现象
Ⅰ

盐酸
溶液红色褪去,无沉淀,灯泡亮度没有明显变化
Ⅱ
Na2SO4
溶液红色不变,有白色沉淀生成,灯泡亮度没有明显变化
Ⅲ
H2SO4
溶液红色褪去,有白色沉淀生成,灯泡逐渐变暗
A、实验Ⅰ中溶液红色褪去,说明发生了反应H++OH-=H2O B、实验Ⅱ中溶液红色不变,且灯泡亮度没有明显变化 C、实验Ⅲ中溶液红色褪去,有白色沉淀生成,灯泡逐渐变暗,说明发生了反应Ba2++ 2OH++2H++SO42- =BaSO4↓ +2H2O D、将实验Ⅱ中Na2SO4溶液换成CuSO4溶液,现象与原实验Ⅱ中的现象相同二、非选择题(本大题共5题,共50分)
-
21. 现有下列十种物质:①液态氯化氢;②小苏打;③固体纯碱:④二氧化碳;⑤葡萄糖:⑥氢氧化钾;⑦氢氧化铁胶体;⑧氨水;⑨空气;⑩硫酸铁溶液(1)、上述十种物质中,属于电解质的有 (填序号),属于非电解质的有(填序号)(2)、除去③中少量②的操作是 , 化学方程式为;(3)、现有100mL溶液中含Fe3+5.6g,则溶液中SO42-的物质的量浓度是;(4)、若在⑦中缓慢加入①的水溶液,产生的现象是 。22. 有关物质的转化关系如下图所示(部分物质和条件已略去)。B、C、E是常见气体;A、Ⅹ、Y是常见金属单质,其中Y既能与强酸反应,又能与强碱反应;G的焰色反应显黄色;I的溶液呈黄色。

请回答下列问题:
(1)、A的原子结构示意图为;(2)、写出气体C的一种用途;(3)、Y和D溶液反应的离子方程式为;(4)、实验室检验Ⅰ中所含的金属阳离子的试剂是(填化学式);(5)、Ⅰ溶液常用于腐蚀印刷电路铜板,请写出相关的离子方程式。23. 绿矾(FeSO4·7H2O)是治疗缺铁性贫血药品的重要成分。在隔绝空气条件下,绿矾高温分解的反应为:FeSO4·7H2O Fe2O3+SO2↑+SO3↑+H2O(未配平)。回答下列问题:
(1)、缺铁性贫血患者应补充Fe2+。用绿矾制成的补铁剂药片外表包有一层特殊的糖衣,试推测糖衣的作用是 ;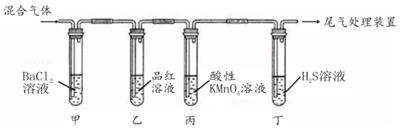 (2)、将绿矾分解产生的气体,依次通过下图装置,观察到试管甲中有白色沉淀产生,该白色沉淀是 (填化学式):试管乙中的现象是;试管丙中溶液褪色,体现了SO2的性;试管丁中溶液变浑浊,写出发生反应的化学方程式 。24. 将某质量的镁铝合金溶解在500mL盐酸中,向反应后的溶液中逐滴加入2mol/ LNaOH溶液,产生沉淀质量与碱溶液体积的关系如图所示。
(2)、将绿矾分解产生的气体,依次通过下图装置,观察到试管甲中有白色沉淀产生,该白色沉淀是 (填化学式):试管乙中的现象是;试管丙中溶液褪色,体现了SO2的性;试管丁中溶液变浑浊,写出发生反应的化学方程式 。24. 将某质量的镁铝合金溶解在500mL盐酸中,向反应后的溶液中逐滴加入2mol/ LNaOH溶液,产生沉淀质量与碱溶液体积的关系如图所示。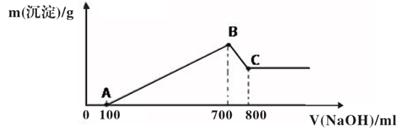
请填写下列空白:
(1)、图中B点沉淀的成分(填化学式)(2)、写出AB段发生反应的离子方程式 , ;(3)、写出BC段发生反应的离子方程式;(4)、合金中铝的质量为;(5)、盐酸的物质的量浓度(假设反应后溶液体积不变)是 。25. 将6.4g铜与足量的浓硝酸充分反应,铜没有剩余。试计算:(1)、参加反应的硝酸的物质的量(2)、生成的NO2的体积(标准状况下);(3)、将反应后的溶液用水稀释到100mL,计算溶液中硝酸铜的物质的量浓度。