安徽省芜湖市2018-2019学年九年级下学期化学第二次月考试卷
试卷更新日期:2020-02-10 类型:月考试卷
一、单选题
-
1. 下列质量增加的变化有一种与其它三种存在本质的区别,这种变化是( )A、长期放置在空气中的氢氧化钠质量增加 B、久置的生石灰质量增加 C、长期敞口放置的浓硫酸质量增加 D、久置的铁钉生锈质量增加2. 人体中一些体液或排泄物的pH范围如下,其中酸性最强的是( )A、胃液0.9~1.5 B、唾液6.6~7.1 C、尿液4.7~8.4 D、胰液7.5~8.03. 下列溶液在空气中敞口放置后,溶液质量因发生化学反应而减小的是( )A、石灰水 B、浓硫酸 C、浓盐酸 D、烧碱溶液4. 下列反应的化学方程式书写不正确的是()A、Fe与稀HCl:2Fe+6HCl=2FeCl3+3H2↑ B、CO2使澄清石灰水变浑浊:CO2+Ca(OH)2=CaCO3↓+H2O C、Ba(OH)2溶液与稀H2SO4:Ba(OH)2+H2SO4=BaSO4↓+2H2O D、AgNO3溶液与稀HCl:AgNO3+HCl=AgCl↓+HNO35. 按下列方法配制的溶液,其溶质质量分数为5%的是( )A、称取5.0g氯化钾,溶解在95mL水中,充分搅拌 B、称取5.0g生石灰,放入95mL水中,充分搅拌 C、量取5.0mL浓盐酸,倒入95mL水中,充分搅拌 D、称取5.0g二氧化锰,放入95mL水中,充分搅拌6. 在A+ B→盐+水的反应中,A和B不可能是( )A、HCl和NaOH B、CO2和NaOH C、H2SO4和Fe2O3 D、H2SO4和BaCl27. 现有100 g溶质质量分数为10%的NaCl溶液,要使溶液的溶质质量分数增大一倍,下列操作中正确的是()A、加入10gNaCl B、加入水5g C、蒸发掉50g水 D、加入100g10%NaCl溶液8. 为了探究镁、锌、铜三种金属的活动性强弱,将形状、大小相同的三种金属分别放入装有X溶液的试管中,通过观察现象即能得出实验结论.则X溶液是( )A、稀硫酸 B、硝酸银溶液 C、氯化铜溶液 D、氯化镁溶液9. 下列环境中,铁钉表面最容易生锈的是的是( )A、在稀盐酸中 B、在潮湿空气中 C、在干燥空气中 D、浸没在植物油中10. 据报道,某经营宾馆的不法商人用氢氧化钠溶液浸泡、洗涤床单和被套,导致它们显碱性,引起顾客皮肤不适,氢氧化钠溶液的pH可能是( )A、3 B、7 C、13 D、511. 工业生产中,可用盐酸洗去铁材表面上的致密氧化层,但冬天反应变缓而影响生产,为提高酸洗液的浓度或温度以加快反应保证生产,可在酸洗液中加入( )A、食盐 B、生石灰 C、浓硫酸 D、固体氢氧化钠12. 除去下列各物质中混有的少量杂质,所用试剂及操作方法均正确的是( )
选项
物质(括号内的为杂质)
试剂
操作方法
A
稀盐酸(稀硝酸)
过量 硝酸银溶液
过滤
B
H2(HCl)
浓 H2SO4
洗气
C
Cu(CuO)
过量稀盐酸
过滤、洗涤、干燥
D
ZnSO4(FeSO4)
过量 Zn 粉
过滤、洗涤、干燥
A、A B、B C、C D、D13. 除去下列物质中的杂质(括号内为杂质),所选用的试剂与方法正确的是( )A、CO(水蒸气):通过浓硫酸洗气 B、CaO(CaCO3):滴加稀盐酸后过滤 C、NaCl固体(沙子):溶于水、过滤、洗涤、干燥 D、铁粉(锌粉):加入稀H2SO4溶液充分反应后过滤14. 将质量为4g的铁片放入200g质量分数为20%的硫酸铜溶液中,片刻后取出附有铜的铁片,洗涤干燥后称得质量为4.4g,这表明反应中()A、析出了0.4g铜 B、有4g铁参加了反应 C、析出了3.2g铜 D、有20g硫酸铜参加了反应15. 某气体可能含有H2、CO2、CO、HCl中的一种或几种,把该气体依次通过澄清石灰水、饱和碳酸氢钠溶液、浓硫酸、灼热的氧化铜、无水硫酸铜、澄清石灰水,观察到的现象是:前面的一瓶澄清石灰水无明显变化,灼热的氧化铜变红色,无水硫酸铜变蓝(无水硫酸铜遇水变蓝),后面的一瓶澄清石灰水变浑浊,下列关于该气体说法不正确的是( )A、一定含有H2 B、一定含有CO C、可能含有HCl D、一定不含CO2二、填空题
-
16. 化学用语是学习化学的基础,请从O,H,N,K中选择适当的元素符号,写出符合下列要求的化学式各一个:(1)、能提供呼吸的单质:;(2)、酸:;(3)、碱:;(4)、不含金属元素的盐:。17. 金属材料在人类的生产、生活中有着十分重要的作用。(1)、多种金属可以压成薄片、抽成细丝,说明金属具有性。(2)、实验室有打磨过的铝片、铁片和硫酸铜溶液。兴趣小组同学欲验证铝、铁和铜的活泼性顺序,进行如下操作:
①取少量硫酸铜溶液于试管A中,将铁片(足量)插入硫酸铜溶液中,充分反应后将铁片取出,观察到的实验现象是。
②(请补充实验具体操作)
③取少量硫酸铜溶液于试管B中,将铝片插入硫酸铜溶液中,充分反应。写出该反应的化学方程式。
结论:三种金属的活泼性由强到弱顺序是。
(3)、金属腐蚀造成的损失巨大,对金属腐蚀的控制尤为重要。下列对金属的防护措施不合理的是(填序号)。a.齿轮表面涂油 b.将钢材深埋保存
c.将钢刀浸泡在盐水中 d.车圈镀铬
18. 下表是A、B、C三种固体物质在不同温度时的溶解度。温度/℃
0
20
40
60
80
100
溶解度/g
A
13.3
31.6
63.9
110
169
246
B
35.7
36.0
36.6
37.3
38.4
39.8
C
0.18
0.16
0.14
0.11
0.09
0.07
(1)、从表中数据可以看出的溶解度随温度升高而增大。(2)、若A中混有少量B,提纯A所采用的方法是。(3)、20℃时,100gB饱和溶液中含B物质的质量(填“>”“=”“<”)36.0g。(4)、将40℃时,A,B,C三种物质的饱和溶液降温至20℃,溶液中溶质的质量分数保持不变的是。三、推断题
-
19. 已知奥运五环中A、B、C、D、E为稀硫酸、氢氧化钠溶液、二氧化碳、氧化铁、水中的一种,且相连环内的两种物质能发生化学反应,E是常见的溶剂。请回答:
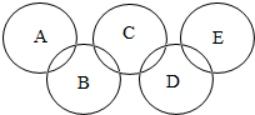 (1)、B物质是。(2)、A与B反应的实验现象是。(3)、写出C与D反应的化学方程式:。(4)、写出A和B反应的化学方程式:。20. 已知A~H均为初中化学常见的物质,其中A、C常温下是气体,且组成元素相同,C的固体俗名叫“干冰”,B是赤铁矿的主要成分,E能用于改良酸性土壤,H是紫红色金属。他们的相互转化关系如图(图中反应条件均已略去):
(1)、B物质是。(2)、A与B反应的实验现象是。(3)、写出C与D反应的化学方程式:。(4)、写出A和B反应的化学方程式:。20. 已知A~H均为初中化学常见的物质,其中A、C常温下是气体,且组成元素相同,C的固体俗名叫“干冰”,B是赤铁矿的主要成分,E能用于改良酸性土壤,H是紫红色金属。他们的相互转化关系如图(图中反应条件均已略去):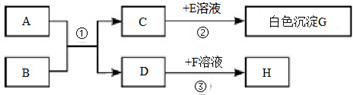
请回答下列问题:
(1)、写出E物质的化学式:。(2)、写出反应①的化学方程式:。(3)、反应③的基本反应类型是。四、实验题
-
21. 用氢氧化钠溶液、稀盐酸和酚酞溶液按下图步骤进行实验。

回答下列问题:
(1)、无色溶液A是 , 仪器C的名称是;(2)、实验中滴入酚酞溶液的目的是;(3)、实验中反应的化学方程式是;(4)、步骤⑤的操作名称是 , 当出现较多量固体时应;(5)、实验步骤②和③两次使用了滴管,用完后需要洗涤的是(填“②”或“③”)。五、科学探究题
-
22. 蚊虫叮咬时能在人体皮肤内分泌出蚁酸,让人痛痒不止,某课外兴趣小组在老师的带领下决定对蚁酸进行探究。
(提出问题)蚁酸的成分是什么?它有什么性质?
(查阅资料)蚁酸是一种有机酸,化学名称叫做甲酸,化学式为HCOOH,蚁酸在一定条件下会分解成两种氧化物。
(1)、(实验探究1)向盛有蚁酸溶液的试管中滴加紫色石蕊溶液,观察到溶液颜色变成红色,说明蚁酸溶液显性。(2)、(实验探究2)小明同学根据蚁酸中含有氢元素,推测出生成物中含有水;
另一种生成物是气体,小刚提出两种猜想:
猜想①:该气体是;猜想②:该气体是一氧化碳。
为了证明自己的猜想,他们将蚁酸分解产生的气体通过如图所示的装置(铁架台已略去)。观察现象。
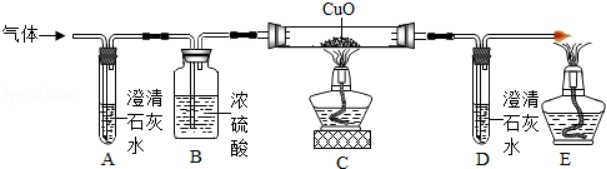
Ⅰ.实验是装置A中无明显变化,则猜想①(选填“成立”或“不成立”)。
Ⅱ.实验时装置C中的实验现象 , 由上述实验现象,得出猜想②成立,该反应的化学方程式为。
(评价与反思)E处酒精灯的作用是。
六、计算题
-
23. 请你仔细分析下图所示的实验过程和提供的数据,并进行计算。
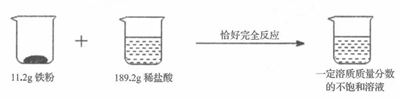 (1)、生成氢气g。(2)、反应后所得溶液中溶质的质量分数是? (写出计算过程,精确到0.1%)。
(1)、生成氢气g。(2)、反应后所得溶液中溶质的质量分数是? (写出计算过程,精确到0.1%)。
-
-