2017年江苏省苏州市张家港市中考化学模拟试卷
试卷更新日期:2017-08-10 类型:中考模拟
一、单项选择题
-
1. 下列有关生活、环境、能源、资源问题叙述错误的是( )A、加速石油、煤炭的开采,快速提高人类的生活质量 B、pH<5.6的雨水称为酸雨 C、“温室效应”主要是由CO2等气体引起的 D、PM2.5专用口罩中使用了活性炭,是利用了活性炭的吸附性2. 下列物质的分类正确的是( )A、蒸馏水和矿泉水:硬水 B、空气和钢铁:纯净物 C、金刚石和金属铜:单质 D、氧化钾和碳酸钾:盐类3. 材料与人类生活紧密相关.下列物质属于金属材料的是( )A、用于炼钢的赤铁矿 B、用于制造人造骨的钦合金 C、钻探机钻头上的金刚石 D、用于制造船舶外壳的玻璃钢4. 下列实验操作正确的是( )A、
 用纸槽将固体粉末送入试管
B、
用纸槽将固体粉末送入试管
B、 倾倒液体
C、
倾倒液体
C、 加热试管内液体
D、
加热试管内液体
D、 熄灭酒精灯
5. 某外控型食品保鲜剂以淀粉、二氧化硅(SiO2)为载体,吸附酒精制作而成.保鲜原理是酒精缓缓挥发,在食品周围形成一定浓度的气体保护层.下列说法错误的是( )A、淀粉是一种有机物 B、起保鲜作用的物质是酒精 C、该保鲜剂不能与明火接触 D、酒精挥发时分子体积变大6. 下列有关实验现象的描述正确的是( )A、红磷在空气中燃烧产生大量白雾 B、点燃羊毛纤维能闻到烧焦羽毛的气味 C、碳在空气中燃烧生成CO2 D、将SO2通入稀高锰酸钾溶液中,溶液由浅绿色褪为无色7. 下列过程中,有一个去污原理与其他三个不同的是( )A、用汽油除去衣服上的油污 B、用酒精除去附着在试管内壁的碘 C、用洗涤剂洗去餐具上的油脂 D、用热水洗去附着在烧杯底部的硝酸钾8. 下列关于中和反应的说法,正确的是( )A、纯碱和稀盐酸混合后发生中和反应 B、有盐和水生成的反应一定是中和反应 C、工厂废水中含有的硫酸可以用氨水中和 D、中和反应的发生必须借助酸碱指示剂进行判断9. 在粗盐提纯的实验中,下列说法错误的是( )A、溶解过程中玻璃棒的作用是搅拌,以加快氯化钠的溶解速度 B、用药匙将蒸发皿中的白色固体直接转移到纸上 C、蒸发操作结束后,将蒸发皿放在石棉网上 D、实验结束后所得到的氯化钠固体还是混合物10. 运用分类思想认识物质,下列说法正确的是( )A、柠檬酸、碳酸均属于酸,它们都能使石蕊溶液变红 B、氮气、氢气均属于非金属单质,它们都能在氧气中燃烧 C、氧化钙、氧化铝均属于金属氧化物,它们都易溶解于水 D、硝酸铵、氯化铵均属于铵盐,它们都能跟碱性肥料混合使用11. 有X、Y、Z三种金属,只有Y在自然界主要以单质形式存在,如果将三种金属分别加入稀盐酸中,只有X表面产生氢气.据此判断这三种金属的活动性由强到弱的顺序为( )A、X、Z、Y B、Z、X、Y C、Y、Z、X D、Y、X、Z12. 下列各组离子在水中能大量共存的是( )A、H+、Na+、Cl﹣、HCO3﹣ B、H+、K+、Cl﹣、OH﹣ C、Cu2+、Ba2+、Cl﹣、SO42﹣ D、K+、NH4+、Cl﹣、NO3﹣13. 除去下列各组物质中的杂质,所用试剂和方法均正确的是( )
熄灭酒精灯
5. 某外控型食品保鲜剂以淀粉、二氧化硅(SiO2)为载体,吸附酒精制作而成.保鲜原理是酒精缓缓挥发,在食品周围形成一定浓度的气体保护层.下列说法错误的是( )A、淀粉是一种有机物 B、起保鲜作用的物质是酒精 C、该保鲜剂不能与明火接触 D、酒精挥发时分子体积变大6. 下列有关实验现象的描述正确的是( )A、红磷在空气中燃烧产生大量白雾 B、点燃羊毛纤维能闻到烧焦羽毛的气味 C、碳在空气中燃烧生成CO2 D、将SO2通入稀高锰酸钾溶液中,溶液由浅绿色褪为无色7. 下列过程中,有一个去污原理与其他三个不同的是( )A、用汽油除去衣服上的油污 B、用酒精除去附着在试管内壁的碘 C、用洗涤剂洗去餐具上的油脂 D、用热水洗去附着在烧杯底部的硝酸钾8. 下列关于中和反应的说法,正确的是( )A、纯碱和稀盐酸混合后发生中和反应 B、有盐和水生成的反应一定是中和反应 C、工厂废水中含有的硫酸可以用氨水中和 D、中和反应的发生必须借助酸碱指示剂进行判断9. 在粗盐提纯的实验中,下列说法错误的是( )A、溶解过程中玻璃棒的作用是搅拌,以加快氯化钠的溶解速度 B、用药匙将蒸发皿中的白色固体直接转移到纸上 C、蒸发操作结束后,将蒸发皿放在石棉网上 D、实验结束后所得到的氯化钠固体还是混合物10. 运用分类思想认识物质,下列说法正确的是( )A、柠檬酸、碳酸均属于酸,它们都能使石蕊溶液变红 B、氮气、氢气均属于非金属单质,它们都能在氧气中燃烧 C、氧化钙、氧化铝均属于金属氧化物,它们都易溶解于水 D、硝酸铵、氯化铵均属于铵盐,它们都能跟碱性肥料混合使用11. 有X、Y、Z三种金属,只有Y在自然界主要以单质形式存在,如果将三种金属分别加入稀盐酸中,只有X表面产生氢气.据此判断这三种金属的活动性由强到弱的顺序为( )A、X、Z、Y B、Z、X、Y C、Y、Z、X D、Y、X、Z12. 下列各组离子在水中能大量共存的是( )A、H+、Na+、Cl﹣、HCO3﹣ B、H+、K+、Cl﹣、OH﹣ C、Cu2+、Ba2+、Cl﹣、SO42﹣ D、K+、NH4+、Cl﹣、NO3﹣13. 除去下列各组物质中的杂质,所用试剂和方法均正确的是( )物质
杂质
除杂所用的试剂和方法
A
CO2气体
HCl气体
先通过NaOH溶液,再通过浓硫酸
B
KCl晶体
K2CO3晶体
加入稍过量的稀盐酸,蒸发结晶
C
CO2气体
CO气体
点燃气体
D
铁粉
铜粉
加入足量的稀硫酸,过滤
A、A B、B C、C D、D14. 下列叙述不正确的是( )A、用互相刻画的方法,可比较硬铝和铝的硬度 B、用灼烧闻气味的方法,可区分棉纤维和蚕丝 C、加熟石灰粉末研磨,可鉴别硫酸铵和氯化铵 D、将冷碟子放在蜡烛火焰的上方,可得到炭黑15. 甲和乙可以合成清洁燃料丙,微观过程如图.下列说法错误的是( ) A、丁的化学式为H2O2 B、丙中C,H,O的质量比为12:3:8 C、一定浓度的丙溶液可作消毒剂 D、该反应体现无机物可转化为有机物16. 下列排列顺序正确的是( )A、 B、 C、 D、17. 下列有关营养素的说法错误的是( )A、蛋白质是一切生命活动的基础 B、人摄入的碳水化合物过多,剩余部分可以转化为脂肪 C、大多数维生素不能在体内合成,需要从食物中摄取 D、纤维素在人体中能够转化为葡萄糖18. 下列有关微粒的说法正确的是( )A、原子通过得失电子形成离子,但离子不能形成原子 B、由分子构成的物质发生化学变化时,分子本身没有改变 C、过氧化氢是由氢原子和氧原子构成的,它与水的组成元素相同 D、原子、分子、离子都是构成物质的微粒,构成物质的微粒在不停地运动19. 分析下面的实验内容和结论,正确的一组是( )A、带有火星的木条置于氧气瓶中,木条复燃,说明氧气有可燃性 B、CO2气体通入紫色石蕊溶液中,溶液变红色,说明CO2有酸性 C、稀盐酸滴入氢氧化钠溶液中,未观察到明显现象,说明二者没有发生化学变化 D、氯化钙溶液滴入某溶液中,出现白色沉淀,说明溶液中可能含有CO32﹣20. 铜锈的主要成分是碱式碳酸铜.碱式碳酸铜受热分解,发生反应的化学方程式为Cu2(OH)2CO3 2CuO+X+CO2↑.下列说法正确的是( )A、反应前后固体物质中铜元素的质量分数不变 B、碱式碳酸铜中铜原子和氧原子的个数比为2:3 C、X是相对分子质量最小的氧化物 D、加热碱式碳酸铜的实验装置和实验室制取CO2发生装置相同21. 下列有关熟石灰的说法错误的是( )A、熟石灰的溶液俗称石灰水,呈碱性 B、熟石灰可由生石灰与水反应而制得 C、熟石灰的溶解度随温度的升高而增大 D、熟石灰可以和硫酸铜溶液按一定的配比配制农药波尔多液22. 化学课本中提供的图表资料,可以为我们提供很多信息.其中叙述错误的是( )A、根据溶解度曲线图,可以判断从溶液中获得晶体的方法 B、根据酸、碱、盐的溶解性表,可以判断某些复分解反应能否发生 C、根据元素周期表中元素的相对原子质量,可以判断元素的化学性质 D、根据金属活动顺序表,可以判断金属能否置换某些盐溶液中的金属元素23. 为从废铜屑中得到较纯的单质铜,某探究小组设计了如下方案.有关说法正确的是( )
A、丁的化学式为H2O2 B、丙中C,H,O的质量比为12:3:8 C、一定浓度的丙溶液可作消毒剂 D、该反应体现无机物可转化为有机物16. 下列排列顺序正确的是( )A、 B、 C、 D、17. 下列有关营养素的说法错误的是( )A、蛋白质是一切生命活动的基础 B、人摄入的碳水化合物过多,剩余部分可以转化为脂肪 C、大多数维生素不能在体内合成,需要从食物中摄取 D、纤维素在人体中能够转化为葡萄糖18. 下列有关微粒的说法正确的是( )A、原子通过得失电子形成离子,但离子不能形成原子 B、由分子构成的物质发生化学变化时,分子本身没有改变 C、过氧化氢是由氢原子和氧原子构成的,它与水的组成元素相同 D、原子、分子、离子都是构成物质的微粒,构成物质的微粒在不停地运动19. 分析下面的实验内容和结论,正确的一组是( )A、带有火星的木条置于氧气瓶中,木条复燃,说明氧气有可燃性 B、CO2气体通入紫色石蕊溶液中,溶液变红色,说明CO2有酸性 C、稀盐酸滴入氢氧化钠溶液中,未观察到明显现象,说明二者没有发生化学变化 D、氯化钙溶液滴入某溶液中,出现白色沉淀,说明溶液中可能含有CO32﹣20. 铜锈的主要成分是碱式碳酸铜.碱式碳酸铜受热分解,发生反应的化学方程式为Cu2(OH)2CO3 2CuO+X+CO2↑.下列说法正确的是( )A、反应前后固体物质中铜元素的质量分数不变 B、碱式碳酸铜中铜原子和氧原子的个数比为2:3 C、X是相对分子质量最小的氧化物 D、加热碱式碳酸铜的实验装置和实验室制取CO2发生装置相同21. 下列有关熟石灰的说法错误的是( )A、熟石灰的溶液俗称石灰水,呈碱性 B、熟石灰可由生石灰与水反应而制得 C、熟石灰的溶解度随温度的升高而增大 D、熟石灰可以和硫酸铜溶液按一定的配比配制农药波尔多液22. 化学课本中提供的图表资料,可以为我们提供很多信息.其中叙述错误的是( )A、根据溶解度曲线图,可以判断从溶液中获得晶体的方法 B、根据酸、碱、盐的溶解性表,可以判断某些复分解反应能否发生 C、根据元素周期表中元素的相对原子质量,可以判断元素的化学性质 D、根据金属活动顺序表,可以判断金属能否置换某些盐溶液中的金属元素23. 为从废铜屑中得到较纯的单质铜,某探究小组设计了如下方案.有关说法正确的是( ) A、若X是铁,第③步反应还会生成氯化铁 B、X还可以是Zn,但不能是Ag C、仅用第②③步操作也能达到实验目的 D、向第②步反应后的溶液中加入硝酸银溶液,若产生白色沉淀即证明稀盐酸过量24. 如图各组转化中,一定条件下均能一步实现的组合是( )
A、若X是铁,第③步反应还会生成氯化铁 B、X还可以是Zn,但不能是Ag C、仅用第②③步操作也能达到实验目的 D、向第②步反应后的溶液中加入硝酸银溶液,若产生白色沉淀即证明稀盐酸过量24. 如图各组转化中,一定条件下均能一步实现的组合是( ) A、①② B、②③ C、①③ D、①②③25. 下列图象与对应选项关系合理的是( )A、
A、①② B、②③ C、①③ D、①②③25. 下列图象与对应选项关系合理的是( )A、 向pH=13的氢氧化钠溶液中加水稀释
B、
向pH=13的氢氧化钠溶液中加水稀释
B、 用相同质量的氯酸钾固体加热分解来制取氧气
C、
用相同质量的氯酸钾固体加热分解来制取氧气
C、 向一定体积的氢氧化钠溶液中逐滴加入稀盐酸
D、
向一定体积的氢氧化钠溶液中逐滴加入稀盐酸
D、 向一定质量一定质量分数的稀盐酸中加入铁粉
向一定质量一定质量分数的稀盐酸中加入铁粉
二、非选择题
-
26. 写出下列化学方程式,并回答相关问题.(1)、天然气燃烧: , 该反应(填写“放热”或“吸热”).(2)、稀硫酸除铁锈: , 溶液由无色变为 .(3)、少量硫酸铵固体与熟石灰混合研磨:;检验该气体可用试纸.(4)、将光亮的铁丝插入装有硫酸铜溶液中: , 反应所得溶液的质量(填“大于”或“等于”或“小于”)反应前溶液的质量.(5)、若不慎将浓硫酸沾到皮肤或衣服上,应立即用大量的水冲洗,然后涂上3%~5%的NaHCO3溶液;该反应的基本类型是 .27. 化学与人类生活息息相关.请回答下列问题.(1)、烧水的锅底有一层水垢,可用厨房中的将其除去.(2)、氢气作为一种新能源,普遍被人们重视并加以研究.但氢气作为燃料也有它的缺点.请写出一条 .(3)、生活中常讲的“烧开水”,是指利用的方法,获得可以饮用的水,这样既可以降低水的硬度,又可以除去水中的细菌.(4)、要将石油液化气(主要成分C4H10)灶改为天然气(主要成分是CH4)灶,对灶具改进的操作是 .28. 硝酸钾与氯化钾的溶解度曲线如图所示,回答下列问题:

①t1℃时,两物质中溶解度较大的是 .
②t2℃时,两物质的等质量饱和溶液降温至t1℃,析出固体质量较大的是的溶液.
③t2℃时,将100g水加入盛有50g氯化钾的烧杯中,充分溶解后,得到氯化钾的(填“饱和”或“不饱和”)溶液.保持温度不变,往该烧杯中再加入10g水,充分搅拌后,氯化钾溶液的溶质的质量分数(填“变大”、“不变”或“变小”).
④欲配制溶质的质量分数为20%的硝酸钾溶液,应满足的温度范围是 .
29. 氯化钠是重要的调味品,是舌尖上最不可缺少的味道.下面三幅示意图分别表示不同的化学反应,但生成物中都有氯化钠.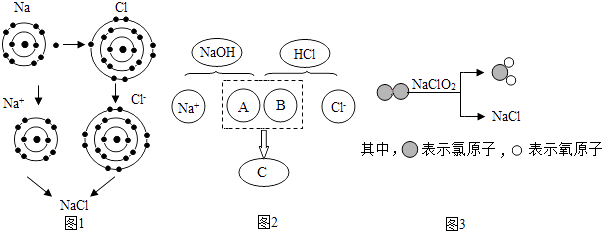 (1)、图1是金属钠与氯气反应生成氯化钠的微观示意图,氯化钠由构成(填微粒符号).由图1可知,元素的化学性质与原子结构中的(填字母序号)有密切的关系.
(1)、图1是金属钠与氯气反应生成氯化钠的微观示意图,氯化钠由构成(填微粒符号).由图1可知,元素的化学性质与原子结构中的(填字母序号)有密切的关系.A.最外层电子数 B.内层电子数 C.质子数
(2)、图2描述了NaOH溶液与盐酸反应的微观实质,图中A、B、C处应填入的化学符号依次为 .(3)、图3所示的四种物质中属于氧化物的是(填化学式).30. 从海水中提取出的粗盐中除了NaCl外,还含有泥沙等杂质.请完善下列实验室中除去泥沙等杂质的实验步骤,并回答相关问题: (1)、其中操作1的名称是;在过滤操作中要用到的玻璃仪器有烧杯、玻璃棒、(填仪器名称);在加热蒸发过程中,当蒸发皿中时,停止加热.(2)、海水提取出粗盐后的母液中,还含有较多的氯化镁,用氯化镁可制得金属镁.其示意图如下:
(1)、其中操作1的名称是;在过滤操作中要用到的玻璃仪器有烧杯、玻璃棒、(填仪器名称);在加热蒸发过程中,当蒸发皿中时,停止加热.(2)、海水提取出粗盐后的母液中,还含有较多的氯化镁,用氯化镁可制得金属镁.其示意图如下:
①物质X是(填名称).
②写出反应I中发生反应的分步的化学方程式、 .
③上述一系列转化过程中,没有涉及的基本反应类型是 .
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
(3)、工业上可用电解饱和NaCl溶液的方法制得烧碱、氯气和氢气,请写出该反应的化学方程式 .31. 盐酸是重要的无机化工产品,广泛用于染料、医药、食品、冶金等行业.(1)、实验室使用的稀盐酸通常都是将浓盐酸用水稀释而成的.现欲用溶质质量分数为37%的浓盐酸(密度为1.18g•mL﹣1)配制14.6%的稀盐酸100g.步骤为:计算、、稀释.经过计算可知需要浓盐酸的体积为mL,量取水时应选用规格(从10mL、50mL、100mL中选取)为mL的量筒.最后将稀盐酸转移到试剂瓶中,贴上标签备用,在标签上可以不必注明的是(填字母序号).
A.100g B.14.6% C.稀盐酸
(2)、该稀盐酸还可用来测定镀锌铁皮锌镀层的质量.将该铁皮与足量稀盐酸反应,待产生的气泡明显减少时取出(此时可认为锌己反应完全,铁还未参与反应),洗涤,烘干,称量,减少的质量即为锌镀层的质量.下列实验操作对测定结果的影响,判断错误的是 (填字母序号).A、铁皮未及时取出,会导致测定结果偏小 B、铁皮未洗涤干净,会导致测定结果偏大 C、烘干时间过长,会导致测定结果偏小 D、把稀盐酸换成稀硫酸,会导致测定结果偏大(3)、取用上述所配稀盐酸25g与56g溶质质量分数为10%的氢氧化钾溶液相混合(含2滴酚酞试液),混合液刚好由红色变为无色,可认为恰好完全反应.将反应后所得溶液蒸发6.5g水(此过程中无晶体析出),求此时溶液的溶质质量分数.(写出具体计算过程,注意格式) . 32.
32.请根据下列实验装置图,回答问题.
 (1)、实验室用双氧水和二氧化锰制取氧气的化学方程式为 , 发生装置为(填字母序号).若反应过于剧烈,从实验安全角度考虑,可以采取的措施有(写一种即可).(2)、实验室用高锰酸钾制取氧气,为进一步研究高锰酸钾的分解产物,某兴趣小组查阅资料,并取一定质量的高锰酸钾加热使之完全分解,进行下表所示的实验.
(1)、实验室用双氧水和二氧化锰制取氧气的化学方程式为 , 发生装置为(填字母序号).若反应过于剧烈,从实验安全角度考虑,可以采取的措施有(写一种即可).(2)、实验室用高锰酸钾制取氧气,为进一步研究高锰酸钾的分解产物,某兴趣小组查阅资料,并取一定质量的高锰酸钾加热使之完全分解,进行下表所示的实验.【实验内容】:
编号
实验内容
实验现象
实验结论
①
取反应后固体剩余物0.2g加
入5mL6%的H2O2溶液
剧烈反应,放热,产
生大量气泡
生成物中的MnO2
催化分解H2O2
②
取0.2g Mn O2加入5mL........ 。
(填H2O2溶液的溶质质量分
数)的H2O2溶液
平稳反应,放热,持
续产生气泡
MnO2催化分解
H2O2
③
取反应后固体剩余物1.0g,加
入足量水,充分溶解,过滤
固体完全溶解,滤纸
上无黑色固体残余物
固体剩余物中无
........。
【实验分析】:
①完善上表中的填空内容:实验2 , 实验3 .
②实验2的目的是 .
③经讨论,实验1的结论不正确,理由是 .
(3)、【资料】:在43.9℃~377.9℃范围中,KMnO4受热分解时,会发生以下两个反应:a.6KMnO4 2K2MnO4+K2Mn4O8+4O2↑
b.KMnO4 KMnO2+O2↑
④取8.0g KMnO4加热使之完全分解,生成O2的质量可能为(填字母序号);
A.0.81g B.1.08g C.1.42g D.1.62g
⑤资料显示,KMnO4在43.9℃~377.9℃范围中的失重率(O2与KMnO4的质量比)为18.0%.结合资料分析,在43.9℃~377.9℃范围中,KMnO4分解反应主要以(填“a”或“b”)为主.