2017年江苏省镇江市中考化学试卷
试卷更新日期:2017-08-08 类型:中考真卷
一、选择题
-
1. 下列属于纯净物的是( )A、空气 B、盐水 C、液氮 D、生铁2. 下列属于物质化学性质的是( )A、挥发性 B、溶解性 C、导电性 D、可燃性3. 下列化学用语正确的是( )A、水银﹣﹣Ag B、锌离子﹣﹣Zn2+ C、二氧化氮﹣﹣N2O D、锰酸钾﹣﹣KMnO44. 下列做法错误的是( )A、焚烧垃圾,净化环境 B、植树造林,防沙降尘 C、回收金属,再生减污 D、煤气泄漏,关阀开窗5. 下列归类错误的是( )
选项
归类
内容
A
清洁能源
风能、氢能、太阳能
B
常见合金
黄铜、硬铝、不锈钢
C
营养物质
淀粉、油脂、维生素
D
复合肥料
KNO3、NH4H2PO4、NH4NO3
A、A B、B C、C D、D6. 某同学演示酸碱中和并利用反应后的溶液制得Na2SO4固体.下列操作错误的是( )A、 溶解
B、
溶解
B、 稀释
C、
稀释
C、 中和
D、
中和
D、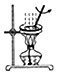 蒸发
7. 下列实验设计正确的是( )A、用活性炭软化硬水 B、用燃烧法区分聚乙烯和聚氯乙烯 C、用托盘天平称取6.45g食盐 D、用NaOH溶液除去CO2中的HCl8. 下列排序正确的是( )A、空气中物质含量: B、溶液pH: C、金属活动性顺序: D、硫元素质量分数:9. 下列对实验现象的描述或实验操作正确的是( )A、红磷在空气中燃烧,产生大量白雾 B、点燃或加热可燃性气体前,检验其纯度 C、10.0mL酒精与10.0mL蒸馏水混合,溶液的体积为20.0mL D、用高锰酸钾制取O2后,应先熄灭酒精灯再从水中取出导气管10. 自来水消毒过程中常发生下列转化:
蒸发
7. 下列实验设计正确的是( )A、用活性炭软化硬水 B、用燃烧法区分聚乙烯和聚氯乙烯 C、用托盘天平称取6.45g食盐 D、用NaOH溶液除去CO2中的HCl8. 下列排序正确的是( )A、空气中物质含量: B、溶液pH: C、金属活动性顺序: D、硫元素质量分数:9. 下列对实验现象的描述或实验操作正确的是( )A、红磷在空气中燃烧,产生大量白雾 B、点燃或加热可燃性气体前,检验其纯度 C、10.0mL酒精与10.0mL蒸馏水混合,溶液的体积为20.0mL D、用高锰酸钾制取O2后,应先熄灭酒精灯再从水中取出导气管10. 自来水消毒过程中常发生下列转化:
下列说法正确的是( )
A、转化过程中有两种氧化物 B、转化①是化合反应 C、转化②中丙和丁的分子个数之比为1:1 D、转化①、②中氯元素的化合价都发生变化11. 下列指定反应的化学方程式正确的是( )A、铝的自我保护:2Al+3O2═2Al2O3 B、用双氧水制氧气:H2O2 H2↑+O2↑ C、配制波尔多液:CaO+H2O+CuSO4=CaSO4+Cu(OH)2↓ D、小苏打治疗胃酸多:Na2CO3+2HCl═2NaCl+CO2↑+H2O12. 物质性质决定用途.下列说法错误的是( )A、氮气化学性质稳定,可用于食品保护气 B、Ca(OH)2具有碱性,可用于改良酸性土壤 C、食醋具有酸性,可用于除去水壶中的水垢 D、甲醛能使蛋白质变性,可用于食用水产品防腐13. 下列物质的转化在给定条件下均能实现的是( )A、FeFe2O3 FeCl3 B、SO2 H2SO3 H2SO4 C、Na2CO3NaNO3 KNO3 D、CaCl2溶液 CaCO3 Ca(OH)214. 下列实验操作中(括号内为杂质)不能达到实验目的是( )选项
物质
目的
主要实验操作
A
蔗糖、蛋白质溶液
鉴别
加入饱和(NH4)2SO4溶液,观察现象
B
KCl(K2CO3)固体
除杂
加入适量稀盐酸,蒸发
C
CaCl2和NaCl的混合物
分离
溶解、过滤、洗涤、烘干、蒸发
D
空气中NaOH变质程度
检验
加入足量BaCl2溶液,过滤,加酚酞,观察现象
A、A B、B C、C D、D15. 已知:Cu2O+H2SO4═Cu+CuSO4+H2O。16.0g CuO与CO反应得到Cu、Cu2O混合物13.6g,将此混合物溶于足量的100.0g稀H2SO4得9.6gCu.下列说法正确的是( )A、生成2.4g CO2 B、混合物中含9.6g铜元素 C、混合物中Cu与Cu2O的质量之比为8:9 D、反应后溶液中CuSO4的质量分数约为7.0%二、不定项选择题
-
16. 下列说法正确的是( )A、同种分子构成的物质是纯净物,纯净物一定由同种分子构成 B、某物质燃烧生成CO2和H2O,该物质中一定含有C,H,O元素 C、置换反应生成单质和化合物,生成单质和化合物的反应一定是置换反应 D、某化肥与熟石灰研磨,无刺激性气味,该化肥一定不是铵态氮肥17. MgSO4和Na2CO3的溶解度表及溶解度曲线如下.下列说法正确的是( )
温度/℃
20
30
40
50
60
70
80
溶解度S/g
MgSO4
25.1
28.2
30.8
32.9
34.3
35.0
34.9
Na2CO3
21.5
39.7
49.0
48.5
46.0
45.2
43.9
 A、甲为Na2CO3 B、乙的饱和溶液从t1升温到t4 , 溶质质量分数增大 C、等质量甲、乙饱和溶液从t3降温到t1 , 析出晶体的质量(不带结晶水):乙>甲 D、b、c点乙的饱和溶液溶质质量分数相等,且大于a点甲的饱和溶液溶质质量分数18. 向一定质量的Ba(OH)2溶液中先后滴加CuSO4、H2SO4溶液,过程中加入溶液的质量与产生沉淀的质量关系如图所示.下列说法正确的是( )
A、甲为Na2CO3 B、乙的饱和溶液从t1升温到t4 , 溶质质量分数增大 C、等质量甲、乙饱和溶液从t3降温到t1 , 析出晶体的质量(不带结晶水):乙>甲 D、b、c点乙的饱和溶液溶质质量分数相等,且大于a点甲的饱和溶液溶质质量分数18. 向一定质量的Ba(OH)2溶液中先后滴加CuSO4、H2SO4溶液,过程中加入溶液的质量与产生沉淀的质量关系如图所示.下列说法正确的是( ) A、a点对应溶液pH>7 B、b点对应溶液中溶质有2种 C、m=3.31 D、取c点对应溶液,滴加NaOH溶液,立刻产生沉淀19. 下列各组溶液,不用其它试剂就不能鉴别出来的是( )A、NaOH、NaCl、稀HNO3、FeCl3 B、BaCl2、MgSO4、KNO3、NaOH C、CuCl2、稀HCl、NaNO3、AgNO3 D、稀HCl、稀H2SO4、Na2CO3、Ba(NO3)220. 如图为海水吸收CO2并进行碳循环的原理.下列说法错误的是( )
A、a点对应溶液pH>7 B、b点对应溶液中溶质有2种 C、m=3.31 D、取c点对应溶液,滴加NaOH溶液,立刻产生沉淀19. 下列各组溶液,不用其它试剂就不能鉴别出来的是( )A、NaOH、NaCl、稀HNO3、FeCl3 B、BaCl2、MgSO4、KNO3、NaOH C、CuCl2、稀HCl、NaNO3、AgNO3 D、稀HCl、稀H2SO4、Na2CO3、Ba(NO3)220. 如图为海水吸收CO2并进行碳循环的原理.下列说法错误的是( ) A、光合中太阳能转化为化学能 B、此碳循环中将CO2转化为无机物和有机物 C、吸收的CO2与钙化中释放的CO2的量相等 D、钙化中释放CO2的反应为:2NaHCO3+CaCl2=CaCO3↓+CO2↑+2NaCl+H2O
A、光合中太阳能转化为化学能 B、此碳循环中将CO2转化为无机物和有机物 C、吸收的CO2与钙化中释放的CO2的量相等 D、钙化中释放CO2的反应为:2NaHCO3+CaCl2=CaCO3↓+CO2↑+2NaCl+H2O三、填空题
-
21. 用化学符号表示:(1)、五氧化二磷;(2)、地壳中含量最多的元素;(3)、最简单的有机物;(4)、人体缺少元素会骨质疏松.22. 选择下列适当的物质填空(选填序号):
A 、食盐 B、烧碱 C、硝酸铵 D、武德合金
E、明矾 F、氧气 G、金刚石 H、亚硝酸钠
(1)、自然界硬度最大的是;(2)、可作保险丝的是;(3)、生活中作调味品的是;(4)、溶于水降温的是;(5)、可用作医疗急救的是;(6)、常作净水剂的是 .23. 常温下进行如图所示实验. (1)、A中固体逐渐减少,发生(选填“物理”或“化学”)变化.(2)、C中有气泡,溶液颜色 .24. 以下为制备纳米CaCO3的一种流程:
(1)、A中固体逐渐减少,发生(选填“物理”或“化学”)变化.(2)、C中有气泡,溶液颜色 .24. 以下为制备纳米CaCO3的一种流程: (1)、实验室中进行操作1、2时,所用玻璃仪器有、玻璃棒和烧杯.(2)、过程中的生成物可直接应用于流程的是 .(3)、为了提高“转化”速率,可采取的措施有(选填序号).
(1)、实验室中进行操作1、2时,所用玻璃仪器有、玻璃棒和烧杯.(2)、过程中的生成物可直接应用于流程的是 .(3)、为了提高“转化”速率,可采取的措施有(选填序号).a、搅拌溶液 b、适当增大通入气体的速率 c、加热溶液至100℃
(4)、操作2所得固体用蒸馏水洗涤.检验固体已洗净的方法是 .25. 观察下列实验,回答问题: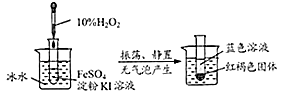 (1)、采用冰水浴的原因是 .(2)、写出此实验中反应的化学方程式(其中H2O2与生成单质的化学计量数之比为3:2) .
(1)、采用冰水浴的原因是 .(2)、写出此实验中反应的化学方程式(其中H2O2与生成单质的化学计量数之比为3:2) .四、实验题
-
26. 请结合图1回答问题:
 (1)、仪器名称:① , ② .(2)、用氯酸钾和二氧化锰制取氧气,可选用装置(选填序号)和D组合,反应的化学方程式为 , 二氧化锰的作用是 .(3)、实验室可用装置B或C制H2 , C装置相对于B的优点有 . 用E装置收集H2 , 气体应从(选填“a”或“b”)端通入.(4)、有同学将实验室制得的CO2通入澄清石灰水,石灰水未变浑浊,于是作如图2探究:
(1)、仪器名称:① , ② .(2)、用氯酸钾和二氧化锰制取氧气,可选用装置(选填序号)和D组合,反应的化学方程式为 , 二氧化锰的作用是 .(3)、实验室可用装置B或C制H2 , C装置相对于B的优点有 . 用E装置收集H2 , 气体应从(选填“a”或“b”)端通入.(4)、有同学将实验室制得的CO2通入澄清石灰水,石灰水未变浑浊,于是作如图2探究:
①实验室制CO2反应的化学方程式 .
②装置F、H中溶液变浑浊,G中溶液不变浑浊,则原石灰水未变浑浊的原因是 .
③装置G的作用是 .
27. 向Mg(HCO3)2溶液中加入一定量NaOH溶液,出现白色沉淀.某同学经过过滤、洗涤、低温烘干得白色固体,并作如下探究:【猜测】
白色固体可能是:①Mg(OH)2;②MgCO3;③Mg(OH)2、MgCO3混合物.
【资料】
MgCO3、Mg(OH)2加热易分解,生成对应的两种氧化物.
【实验1】
(1)、取适量白色固体,溶于 , 出现(填现象),则猜测①不成立.(2)、另取适量白色固体,充分加热,产生的气体使无水CuSO4粉末变蓝,则猜测(选填“②”或“③”)成立.有同学查阅资料得知上述固体应为碱式碳酸镁[xMgCO3•yMg(OH)2•3H2O],其不溶于水,加热易分解.
(3)、【实验2】为进一步确定白色固体的组成,该同学取适量白色固体,充分加热至质量不再改变,并使产生的气体全部缓缓通过如图(选填“甲”或“乙”)装置,测得生成气体的质量.
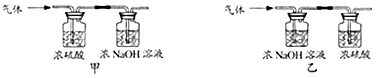
实验数据:
①加热后剩余固体质量1.60g;
②浓硫酸增重0.72g;
③浓NaOH溶液增重1.32g.
则:x:y= .
(4)、【延伸】将该碱式碳酸镁长期浸泡在浓NaOH溶液中,固体全部转化为Mg(OH)2 . 写出此反应的化学方程式 .
(5)、工业上碱式碳酸镁可作阻燃剂,其可能的原因是(选填序号).a、分解时吸热,降低可燃物的着火点
b、生成的固体覆盖燃烧物,隔绝氧气
c、生成的气体稀释了可燃物周围的氧气浓度.
五、推断题
-
28. 现有一包固体粉末,可能含有Na2CO3、Na2SO4、BaCl2、Ba(OH)2、Cu(NO3)2中的一种或几种.现做如下实验:(1)、取少量固体溶于水,过滤得白色沉淀A和无色滤液B,则原固体中一定不含 .(2)、取白色沉淀A,滴加过量稀HCl,固体不溶解,则原固体中一定不含 , 一定含有 .(3)、向无色滤液B中通入CO2 , 产生白色沉淀,则原固体中(选填“一定”或“不一定”,下同)含有Ba(OH)2 , 含有BaCl2 .29. 如图为某些物质间的转化关系.E为常见的碱,F常作食品干燥剂,M为石膏的主要成分.部分反应物和生成物已略去.
 (1)、化学式:C , F .(2)、反应①、③的化学方程式:① , ③ .(3)、能体现明代《天工开物》中“煤饼烧石成灰”的反应是(选填反应序号).(4)、工业上可用B和H合成乙醇(C2H6O),反应中B和H的质量比为 .
(1)、化学式:C , F .(2)、反应①、③的化学方程式:① , ③ .(3)、能体现明代《天工开物》中“煤饼烧石成灰”的反应是(选填反应序号).(4)、工业上可用B和H合成乙醇(C2H6O),反应中B和H的质量比为 .六、综合题
-
30. 铜、铁是人类使用最早、应用广泛的金属.
 (1)、(一)对古代制品的认识
(1)、(一)对古代制品的认识青铜铸件、丝绸织品、陶瓷器皿是我国古代劳动人民创造的辉煌成就.
①上述制品不涉及到的材料是(选填序号).
A、金属材料 B、无机非金属材料 C、复合材料
②如图1为出土文物古代青铜铸件“马踏飞燕”.该文物能保存至今的原因可能是(选填序号).
A、铜的活泼性弱 B、铜不会生锈 C、深埋于地下,隔绝空气
(2)、(二)铁、铜的冶炼①我国古代曾用孔雀石炼铜,涉及主要反应的化学方程式: , 2CuO+C 2Cu+CO2↑.
②铁、铜矿石有赤铁矿(Fe2O3)、磁铁矿(Fe3O4)、黄铁矿(FeS2)、黄铜矿(CuFeS2)等.CuFeS2为二硫化亚铁铜,其中S元素的化合价为 .
③工业炼铁大多采用赤铁矿、磁铁矿.以磁铁矿为原料炼铁反应的化学方程式为 . 炼铁不采用黄铁矿、黄铜矿,可能的原因是:黄铁矿、黄铜矿含铁量相对低; .
④以黄铜矿为原料,采用生物炼铜是现代炼铜的新工艺,原理为:4CuFeS2+17O2+2H2SO4 4CuSO4+2Fe2(SO4)3+2H2O.
向上述反应后的溶液中加入Fe粉,得到FeSO4溶液和Cu.
1)发生主要反应的化学方程式:Fe+Fe2(SO4)3=3FeSO4 , .
2)FeSO4溶液经蒸发浓缩、、过滤等操作得到FeSO4•7H2O晶体.
(3)、(三)黄铜矿中铁、铜含量的测定在科研人员指导下,兴趣小组称取25.00g黄铜矿(含少量Fe2O3和其它不含金属元素的杂质)模拟生物炼铜,使其全部转化为CuSO4、Fe2(SO4)3溶液.向溶液中加入过量NaOH溶液得到Cu(OH)2、Fe(OH)3固体.
①证明NaOH溶液过量的方法:静置,向上层清液中滴加溶液,无现象.
②用图2装置对固体进行热分解实验.
【资料】
①在68℃时,Cu(OH)2分解为CuO;在500℃时,Fe(OH)3分解为Fe2O3 .
②在1400℃时,CuO分解为Cu2O和O2 , Fe2O3分解为复杂的铁的氧化物和O2 .
1)装配好实验装置后,先要 .
2)停止加热后仍需继续通N2 , 可防止倒吸和 .
3)控制不同的温度对A中固体加热,测得装置B和C中铜网的质量变化如表.
温度/℃
室温
100
550
1400
B装置/g
200.00
201.80
205.04
205.04
C中铜网/g
100.00
100.00
100.00
101.28
①此黄铜矿中铜、铁元素的质量分数:ω(Cu)%=;ω(Fe)%= .
②复杂的铁的氧化物化学式为 .