2017年黑龙江省大庆市中考化学试卷
试卷更新日期:2017-08-08 类型:中考真卷
一、选择题
-
1. 1869年,( )发现了元素周期律并编排出了元素周期表.A、波义耳 B、拉瓦锡 C、道尔顿 D、门捷列夫2. 下列实验操作符合规范的是( )A、
 气体的干燥
B、
气体的干燥
B、 澄清石灰水检验CO2
C、
澄清石灰水检验CO2
C、 用托盘天平称量固体氢氧化钠
D、
用托盘天平称量固体氢氧化钠
D、 闻气体时的操作
3. 下列著名诗词中不涉及化学变化的是( )A、粉身碎骨浑不怕,要留清白在人间 B、春蚕到死丝方尽,蜡炬成灰泪始干 C、爆竹声中一岁除,春风送暖入屠苏 D、千里冰封,万里雪飘4. 化学与人类生产生活息息相关,下列性质与应用不存在因果关系的是( )A、氢氧化钠能与油脂反应,在生活中可用来除油污 B、活性炭具有吸附性,可用于吸附装修产生的有害气体 C、石墨有金属光泽,可用于干电池的电极 D、熟石灰具有碱性,可用于改良酸性土壤5. 下列化学方程式与事实不相符的是( )A、铝在空气中与氧气反应生成一层致密薄膜4Al+3O2═2Al2O3 B、铜在稀硝酸中逐渐溶解,放出气体,溶液变成蓝色Cu+2HNO3═Cu(NO3)2+H2↑ C、胃酸过多病症可以服用含氢氧化铝药物进行缓解Al(OH)3+3HCl═AlCl3+3H2O D、人体摄入淀粉后能转换为葡萄糖,葡萄糖经缓慢氧化后变成二氧化碳和水C6H12O6+6O2 6CO2+6H2O6. 对下列物质的俗称,理解错误的是( )A、干冰不是冰 B、纯碱不是碱 C、水银不是银 D、醋酸不是酸7. 关于物质的组成,理解正确的一组是( )A、盐酸、胆矾、石油、沼气均为混合物 B、乙醇、氮气、氨气、C60均由分子构成 C、乙酸、甲烷、葡萄糖均为含有C、H、O三种元素的有机物 D、构成NaCl、MgO的微粒,核外电子排布相同8. 许多化学反应都是在溶液中进行的,关于溶液理解正确的是( )A、通过加热蒸发的方法提高75%酒精的浓度 B、将氧化钙溶于水,可以形成氧化钙溶液 C、5gCuSO4•5H2O溶于95g水中配制CuSO4溶液,此溶液溶质的质量分数小于5% D、将50℃下的饱和KNO3溶液冷却至室温,硝酸钾固体析出,过滤后可得纯水和硝酸钾固体9. 下列关系曲线不能正确反映其对应变化关系的是( )A、
闻气体时的操作
3. 下列著名诗词中不涉及化学变化的是( )A、粉身碎骨浑不怕,要留清白在人间 B、春蚕到死丝方尽,蜡炬成灰泪始干 C、爆竹声中一岁除,春风送暖入屠苏 D、千里冰封,万里雪飘4. 化学与人类生产生活息息相关,下列性质与应用不存在因果关系的是( )A、氢氧化钠能与油脂反应,在生活中可用来除油污 B、活性炭具有吸附性,可用于吸附装修产生的有害气体 C、石墨有金属光泽,可用于干电池的电极 D、熟石灰具有碱性,可用于改良酸性土壤5. 下列化学方程式与事实不相符的是( )A、铝在空气中与氧气反应生成一层致密薄膜4Al+3O2═2Al2O3 B、铜在稀硝酸中逐渐溶解,放出气体,溶液变成蓝色Cu+2HNO3═Cu(NO3)2+H2↑ C、胃酸过多病症可以服用含氢氧化铝药物进行缓解Al(OH)3+3HCl═AlCl3+3H2O D、人体摄入淀粉后能转换为葡萄糖,葡萄糖经缓慢氧化后变成二氧化碳和水C6H12O6+6O2 6CO2+6H2O6. 对下列物质的俗称,理解错误的是( )A、干冰不是冰 B、纯碱不是碱 C、水银不是银 D、醋酸不是酸7. 关于物质的组成,理解正确的一组是( )A、盐酸、胆矾、石油、沼气均为混合物 B、乙醇、氮气、氨气、C60均由分子构成 C、乙酸、甲烷、葡萄糖均为含有C、H、O三种元素的有机物 D、构成NaCl、MgO的微粒,核外电子排布相同8. 许多化学反应都是在溶液中进行的,关于溶液理解正确的是( )A、通过加热蒸发的方法提高75%酒精的浓度 B、将氧化钙溶于水,可以形成氧化钙溶液 C、5gCuSO4•5H2O溶于95g水中配制CuSO4溶液,此溶液溶质的质量分数小于5% D、将50℃下的饱和KNO3溶液冷却至室温,硝酸钾固体析出,过滤后可得纯水和硝酸钾固体9. 下列关系曲线不能正确反映其对应变化关系的是( )A、 加热KClO3和MnO2固体混合物
B、
加热KClO3和MnO2固体混合物
B、 向Ca(OH)2溶液中通入CO2至过量
C、
向Ca(OH)2溶液中通入CO2至过量
C、 向一定浓度的NaOH溶液中加水稀释
D、
向一定浓度的NaOH溶液中加水稀释
D、 将等质量的Mg和Al分别与过量等浓度的盐酸反应,则a为Mg,b为Al
10. 如图是某同学鉴别NH4HCO3、NH4Cl、KCl三种化肥的过程,其中试剂甲和乙分别可能是( )
将等质量的Mg和Al分别与过量等浓度的盐酸反应,则a为Mg,b为Al
10. 如图是某同学鉴别NH4HCO3、NH4Cl、KCl三种化肥的过程,其中试剂甲和乙分别可能是( )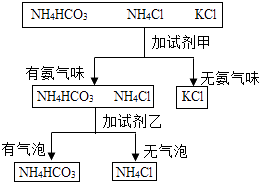 A、甲:熟石灰;乙:稀盐酸 B、甲:水;乙:氢氧化钠溶液 C、甲:氢氧化钠溶液;乙:水 D、甲:稀盐酸;乙:氯化钠溶液
A、甲:熟石灰;乙:稀盐酸 B、甲:水;乙:氢氧化钠溶液 C、甲:氢氧化钠溶液;乙:水 D、甲:稀盐酸;乙:氯化钠溶液二、填空题
-
11. 我们的家乡大庆市素有“绿色油化之都”、“天然百湖之城”的美誉,它因石油而起.因石油而兴,在合理开发利用石油资源的同时也要保护好自然环境.(1)、原油是一种粘稠状液体,属于资源(选填“可再生”、“不可再生”),它主要含有两种元素(填元素符号).(2)、石油经炼制得到的汽油、柴油等产品可作为机动车燃料,燃烧的三个条件:可燃物、、温度达到着火点.(3)、以石油产品为原料可进一步生产、合成纤维、合成橡胶等合成有机高分子材料,人类从此摆脱了依赖天然材料的历史.(4)、我市淡水资源丰富,保护好水资源是每个人的责任,保护水资源一方面要节约用水,另一方面要防治水体 . 实验室用的蒸馏水是净化程度较高的水,可以用自来水通过制取.12. 金属活性顺序在工农业生产和科学研究中都有重要作用,现有A,B,C三种金属,A、B可溶于盐酸,C不溶于盐酸,将A投入BCl2溶液中可发生反应:A+BCl2═ACl2+B.(1)、A,B,C三者金属活动性由强到弱的顺序为 .
与金属置换反应规律相同,非金属单质之间的置换反应也有类似的规律,根据下列反应:
①Cl2+2NaBr═Br2+2NaCl,②Br2+2NaI═I2+2NaBr
(2)、Cl2、Br2和I2单质的活泼性由强到弱的顺序为 .(3)、根据以上规律,下列反应可以发生的是 .a.Cl2+2KI═2KCl+I2 b.2NaCl+I2═2NaI+Cl2↑
(4)、经查阅资料,硫单质的活泼性比Cl2、Br2和I2都弱,请任写出一个化学方程式证明该结论 .13. 钛和钛合金被认为是21世纪重要的金属材料,钛合金与人体具有很好的“相容性”,可用于制造人造骨骼,工业上以钛铁矿(主要成分为钛酸亚铁,FeTiO3)为原料生产钛,其工业流程示意图如下:请回答:
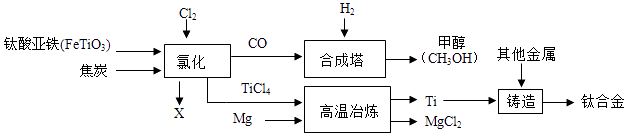 (1)、钛合金属于(选填“混合物”、“纯净物”).(2)、钛酸亚铁FeTiO3中钛的化合价为价.(3)、以CO与H2在合成塔中生产甲醇(CH3OH)属于化合反应,其化学方程式为(4)、经高温冶炼得到金属钛,则参加反应的镁与钛的质量比为 .(5)、氯化过程中主要发生的反应为2FeTiO3+6C+7Cl2 2TiCl4+2X+6CO,则X的化学式为 .14. A﹣J均为初中常见物质,它们之间的转化关系如图所思,部分产物已省略,已知A是人体胃酸的主要成分,B是由四种元素组成的盐类,C是一切生命体生存所必需 的物质,E是厨房重要的调味品,请回答下列问题:
(1)、钛合金属于(选填“混合物”、“纯净物”).(2)、钛酸亚铁FeTiO3中钛的化合价为价.(3)、以CO与H2在合成塔中生产甲醇(CH3OH)属于化合反应,其化学方程式为(4)、经高温冶炼得到金属钛,则参加反应的镁与钛的质量比为 .(5)、氯化过程中主要发生的反应为2FeTiO3+6C+7Cl2 2TiCl4+2X+6CO,则X的化学式为 .14. A﹣J均为初中常见物质,它们之间的转化关系如图所思,部分产物已省略,已知A是人体胃酸的主要成分,B是由四种元素组成的盐类,C是一切生命体生存所必需 的物质,E是厨房重要的调味品,请回答下列问题: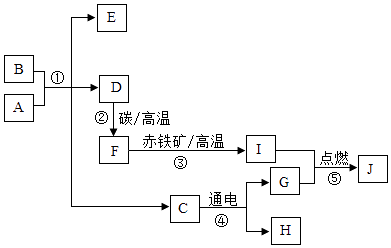 (1)、物质F、H(用化学式表示).(2)、A和B反应的化学方程式为 .(3)、①~⑤属于分解反应的是 .(4)、A和I反应可生成两种不同的盐类,两者所含元素种类相同,但其比例不同,则A和J反应的化学方程式为 .15. 已知A,B,C三种物质的溶解度曲线如图所示.
(1)、物质F、H(用化学式表示).(2)、A和B反应的化学方程式为 .(3)、①~⑤属于分解反应的是 .(4)、A和I反应可生成两种不同的盐类,两者所含元素种类相同,但其比例不同,则A和J反应的化学方程式为 .15. 已知A,B,C三种物质的溶解度曲线如图所示.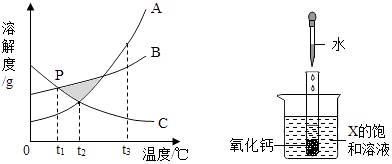 (1)、在阴影区域部分,处于不饱和状态的是(选填“A,B,C”).(2)、若在饱和A溶液中含有少量的C,提纯A的方法为结晶,过滤.(3)、P点表示的含义为 .(4)、在t1℃下,B,C的饱和溶液升温至t2℃,所得溶液溶质的质量分数大小关系为(5)、向试管中滴入2mL水后,若X中有固体析出,则X为(选填“A,B,C”)
(1)、在阴影区域部分,处于不饱和状态的是(选填“A,B,C”).(2)、若在饱和A溶液中含有少量的C,提纯A的方法为结晶,过滤.(3)、P点表示的含义为 .(4)、在t1℃下,B,C的饱和溶液升温至t2℃,所得溶液溶质的质量分数大小关系为(5)、向试管中滴入2mL水后,若X中有固体析出,则X为(选填“A,B,C”)三、解答题
-
16. 大庆市某中学化学兴趣小组利用以下装置制备氢气,并验证氢气的性质,按要求回答以下问题:
 (1)、化学实验现有质量分数为98%的浓硫酸,需配制245g质量分数10%的稀硫酸,配置步骤如下:
(1)、化学实验现有质量分数为98%的浓硫酸,需配制245g质量分数10%的稀硫酸,配置步骤如下:①计算:所需质量分数98%的浓硫酸g;②量取;③稀释
量取和稀释浓硫酸所用的玻璃仪器有 ,
简要描述浓硫酸的稀释方法 .
(2)、该兴趣小组制备氢气的原理为(化学方程式).(3)、装置B的作用 .(4)、下列有关实验操作或现象描述不正确的是A、实验开始时,应先通入氢气,然后再点燃C处酒精灯 B、点燃C处酒精灯后,D处硫酸铜固体自由白色逐渐变为蓝色 C、E处酒精灯的作用是点燃未反应的氢气 D、实验结束时,应先停止通入氢气,然后熄灭C处酒精灯(5)、实验结束后,发现部分氧化铜粉末未被还原,已知反应前氧化铜质量为a克,反应结束后混合固体质量为b克,则被氢气还原的氧化铜的质量为17. 化学反应速率是衡量化学反应进行快慢的物理量,为了探究影响化学反应速率的因素,以过氧化氢分解为研究对象进行实验.三个小组均可采用如图装置进行实验,记录收集10mL氧气的时间,实验室可供选择的试剂有:2.5%、5%、10%三种浓度的H2O2溶液、MnO2、CuO、红砖粉末.
A组:探究催化剂对化学反应速率的影响
取5mL10%H2O2溶液,三次实验分别加入0.5gMnO2、红砖粉末、CuO进行实验,记录数据如下:
试剂
MnO2
红砖粉末
CuO
t/s
10
60
20
由此可出结论:MnO2、CuO对H2O2分解有催化作用,红砖粉末无催化作用,某同学对该结论提出疑问.
补充对比实验,操作为 .
结果:长时间(大于100s),收集到很少量气体.
更正结论:红砖粉末(选填“有”、“无”)催化作用,三者中催化效率最高.
B组:探究浓度对化学反应速率的影响
甲同学:取10mL5%H2O2溶液,加入0.5gMnO2为催化剂,进行实验,记录时间t1 .
乙同学:取10mL2.5%H2O2溶液,加入0.5gMnO2为催化剂,进行实验,记录时间t2 .
实验结果 .
结论:浓度越大,反应速率越快.
丙同学:对实验设计提出疑问,并补充实验 .
记录时间t3 , 且t1<t3<t2 .
更正结论为:当时,反应物浓度越大,反应速率越快.
C组:探究对化学反应速率的影响.
取10mL5%H2O2溶液和0.5gCuO为催化剂进行实验,两次实验分别将试管置于冰水浴和50℃热水浴记录时间t4、t5 , 且t4>t5 .
结论:当反应物浓度和催化剂相同时, .
综上所述:①为了研究某一因素对化学反应速率的影响,必须 .
②探究发现影响化学反应速率的因素有 .

四、计算题
-
18. 铝合金是目前最广泛使用的合金材料,已知某铝合金由Al、Fe、Cu三种金属构成,为了测定各种金属含量,取12.5g合金样品与盐酸反应,消耗浓盐酸(质量分数36.5%)100g,另取12.5g合金样品与氢氧化钠溶液反应,消耗含氢氧化钠12g的溶液40mL.
已知:2Al+2NaOH+2H2O═2NaAlO2+3H2↑,Fe、Cu均不与氢氧化钠溶液反应.
请问:
(1)、12.5g样品中含铝多少g?(2)、铜在合金中所占的质量分数是多少?