百师联盟2019-2020学年高三化学第四次月考试卷(全国一)
试卷更新日期:2020-01-15 类型:月考试卷
一、选择题:
-
1. 有机物在生产、生活中处处可见,下列关于有机物的说法错误的是( )A、很多鲜花和水果有香味可能是由于含有酯类混合物 B、淀粉和纤维素均为多糖,在人体内淀粉能水解成葡萄糖而纤维素不能 C、苯甲酸钠是一种食品防腐剂,应尽可能提高苯甲酸钠的用量以延长食品保质期 D、早期以动物油和草木灰为主要原料生产肥皂,其中利用了盐类水解和酯的水解2. NA表示阿伏加德罗常数的值,下列叙述正确的是( )A、足量MnO2与1L12mo/L的浓盐酸混合加热,充分反应,转移的电子数目为6NA B、标准状况下的5.6L CCl4中含有2NA个氯原子 C、46 g HCOOH与50g CH3OH充分反应生成 HCOOCH3分子的数目为NA D、2L 0.5mo/L的CH3COONH4溶液中,CH3COOH和CH3COO-的总数目为NA3. 实验室用如下图所示装置制取甲烷并与氯气在光照条件下反应,试管中发生的反应是CH3COONa+NaOH CH4↑+Na2CO3 , 集气瓶中收集满混合气体后停止通入气体并对集气瓶进行光照。下列关于实验的说法错误的是( )
 A、组装好仪器后要先检验装置的气密性,然后再装药品进行实验 B、装置Y的作用之一是通过观察气泡产生的快慢调节气体流速 C、对收集好的混合气体光照时,用强光直射以加快反应速率 D、对集气瓶进行光照时,水槽中会有少量晶体析出4. 某种新型热激活电池的结构如下图所示,电极a的材料是氧化石墨烯(CP)和铂纳米粒子,电极b的材料是聚苯胺(PANI),电解质溶液中含有足量Fe3+和Fe2+。加热使电池工作时,电极b发生的反应是PANI-2e-= PANIO(氧化态聚苯胺,绝缘体)+2H+ , 电池冷却时,Fe2+在电极b表面与 PANIO反应可使电池再生。下列说法错误的是( )
A、组装好仪器后要先检验装置的气密性,然后再装药品进行实验 B、装置Y的作用之一是通过观察气泡产生的快慢调节气体流速 C、对收集好的混合气体光照时,用强光直射以加快反应速率 D、对集气瓶进行光照时,水槽中会有少量晶体析出4. 某种新型热激活电池的结构如下图所示,电极a的材料是氧化石墨烯(CP)和铂纳米粒子,电极b的材料是聚苯胺(PANI),电解质溶液中含有足量Fe3+和Fe2+。加热使电池工作时,电极b发生的反应是PANI-2e-= PANIO(氧化态聚苯胺,绝缘体)+2H+ , 电池冷却时,Fe2+在电极b表面与 PANIO反应可使电池再生。下列说法错误的是( ) A、电池冷却过程中发生的反应是:2Fe2++ PANIO+2H+=2Fe3++PANI B、电池工作时电极a发生的反应是还原反应 C、电池冷却时每生成1 mol Fe3+会有NA个电子通过导线移向电极b。 D、电池工作时电解质溶液的pH逐渐减小5. 一定条件下,向密闭容器中充入等物质的量的CO和H2O(g)发生反应:CO(g)+H2O(g) CO2(g)+H2(g)△H<0并建立平衡。下列叙述正确的是( )A、降低温度平衡正向移动,正反应速率增大而逆反应速率减小 B、保持恒温恒压充入少量氦气,正逆反应速率同等程度的减小 C、保持恒温恒容再充入CO和H2O(g)各1mol,CO的平衡转化率增大 D、若容器是绝热容器,平衡后充入CO,平衡常数会增大6. 苯六甲酸俗称蜜石酸,常以铝盐的形式存在于蜜蜡石中,其结构如图所示,下列关于苯六甲酸的说法错误的是( )
A、电池冷却过程中发生的反应是:2Fe2++ PANIO+2H+=2Fe3++PANI B、电池工作时电极a发生的反应是还原反应 C、电池冷却时每生成1 mol Fe3+会有NA个电子通过导线移向电极b。 D、电池工作时电解质溶液的pH逐渐减小5. 一定条件下,向密闭容器中充入等物质的量的CO和H2O(g)发生反应:CO(g)+H2O(g) CO2(g)+H2(g)△H<0并建立平衡。下列叙述正确的是( )A、降低温度平衡正向移动,正反应速率增大而逆反应速率减小 B、保持恒温恒压充入少量氦气,正逆反应速率同等程度的减小 C、保持恒温恒容再充入CO和H2O(g)各1mol,CO的平衡转化率增大 D、若容器是绝热容器,平衡后充入CO,平衡常数会增大6. 苯六甲酸俗称蜜石酸,常以铝盐的形式存在于蜜蜡石中,其结构如图所示,下列关于苯六甲酸的说法错误的是( ) A、苯六甲酸的分子式是C12H6O12 B、苯六甲酸中所有碳原子一定共面 C、苯六甲酸可发生还原反应取代反应而不能发生氧化反应 D、苯六甲酸与钠、NaOH、Na2CO3、NaHCO3均能发生反应7. 一定条件下,在密闭容器中发生反应4NH3(g)+6NO(g) 5N2(g)+6H2O(g)△H<0并建立平衡,在t1和t3时分别改变一个条件,在t2和t4时反应达到新的平衡状态。图1是正反应速率随时间变化的图像,图2是NO的浓度随时间变化的图像,下列说法错误的是( )
A、苯六甲酸的分子式是C12H6O12 B、苯六甲酸中所有碳原子一定共面 C、苯六甲酸可发生还原反应取代反应而不能发生氧化反应 D、苯六甲酸与钠、NaOH、Na2CO3、NaHCO3均能发生反应7. 一定条件下,在密闭容器中发生反应4NH3(g)+6NO(g) 5N2(g)+6H2O(g)△H<0并建立平衡,在t1和t3时分别改变一个条件,在t2和t4时反应达到新的平衡状态。图1是正反应速率随时间变化的图像,图2是NO的浓度随时间变化的图像,下列说法错误的是( ) A、t1时改变的条件是减小生成物浓度 B、t3时正、逆反应速率均增大 C、t3时改变的条件可能是加压或者升温 D、t4时的平衡常数小于t1时的平衡常数8. 现有两个体积均为2L的刚性容器,温度分别为T1和T2 , 向两容器中各充人1.8molA和1molB发生反应:2A(g)+B(g) C(g)+D(g),反应过程中测得B的物质的量随时间变化如下表所示:
A、t1时改变的条件是减小生成物浓度 B、t3时正、逆反应速率均增大 C、t3时改变的条件可能是加压或者升温 D、t4时的平衡常数小于t1时的平衡常数8. 现有两个体积均为2L的刚性容器,温度分别为T1和T2 , 向两容器中各充人1.8molA和1molB发生反应:2A(g)+B(g) C(g)+D(g),反应过程中测得B的物质的量随时间变化如下表所示:温度
时间/min
/n/mol
0
10
20
30
40
T1
n(B)
1
0.65
0.4
0.2
0.2
T2
n(B)
1
0.58
0.3
……
0.24
下列说法正确的是( )
A、T2时A的平衡转化率为76% B、该反应的正反应是吸热反应 C、T2时30min时的体系不一定达到平衡状态 D、T1时的平衡常数K=1609. 常温下,部分酸的电离常数如下表所示:化学式
HF
HIO3
H2S
HClO
电离常数
6.8×10-4
0.49
K1=1.3×10-7
K2=7.1×10-15
3.0×10-8
下列说法正确的是( )
A、常温下1mol的HIO3溶液中H+的物质的量浓度约为0.7mol/L B、向HF溶液中加少量NaF固体,电离平衡左移且电离常数减小 C、常温下pH相同的HF和HCO溶液,浓度较大的是HClO溶液 D、向Na2S溶液中加入HClO溶液会发生反应:S2-+HClO=HS-+ClO-10. 常温下用0.1mol/L的CH3COOH溶液滴定10mL某浓度的KOH溶液滴定过程中的pH变化曲线如下图所示,下列说法错误的是( ) A、KOH溶液的浓度为0.1mol/L B、V1小于10 C、a点溶液中各粒子浓度的关系:c(CH3COO-)+2c(CH3COOH)+c(H+)=c(OH-) D、c点溶液中离子浓度大小关系:c(CH3COO-)>c(K+)>c(H)>c(OH-)11. 下列关于同分异构体的说法错误的是( )A、丙烯与水发生加成反应可得到两种同分异构体 B、C3H6O2的同分异构体中能与NaOH溶液反应的只有1种 C、互为同分异构体的两种有机物化学性质可能相似 D、C4H10O的同分异构体中不能与钠反应的有3种12. 某温度下,水的离子积KW=10-13 , 关于该温度下水电离的说法正确的是( )A、pH=2的盐酸与pH=12的NaOH溶液中水电离出的H+浓度之比为10:1 B、向水中加入少量硫酸氢钠固体或氯化铁固体,水的电离平衡均逆向移动 C、纯水的pH=6.5,显酸性 D、pH均为2的CH3COOH溶液与H2SO4溶液中水电离出的H+浓度不同13. 下列说法错误的是( )A、实验中量取20.00mL碳酸钠溶液可使用碱式滴定管 B、为抑制Fe2+水解可向Fe(NO3)2溶液中加入大量浓硝酸 C、FeCl3溶液蒸干并灼烧得到Fe2O3 , 而CaCl2溶液蒸干并灼烧得到CaCl2 D、泡沫灭火器内筒玻璃瓶中的Al2(SO4)3溶液不能换到外筒钢瓶中14. 常温下,向FeCl3溶液中滴加NaOH溶液,pH=2时开始产生沉淀溶液中-lgc(Fe3+)随pH变化的情况如下图所示,下列说法正确的是( )
A、KOH溶液的浓度为0.1mol/L B、V1小于10 C、a点溶液中各粒子浓度的关系:c(CH3COO-)+2c(CH3COOH)+c(H+)=c(OH-) D、c点溶液中离子浓度大小关系:c(CH3COO-)>c(K+)>c(H)>c(OH-)11. 下列关于同分异构体的说法错误的是( )A、丙烯与水发生加成反应可得到两种同分异构体 B、C3H6O2的同分异构体中能与NaOH溶液反应的只有1种 C、互为同分异构体的两种有机物化学性质可能相似 D、C4H10O的同分异构体中不能与钠反应的有3种12. 某温度下,水的离子积KW=10-13 , 关于该温度下水电离的说法正确的是( )A、pH=2的盐酸与pH=12的NaOH溶液中水电离出的H+浓度之比为10:1 B、向水中加入少量硫酸氢钠固体或氯化铁固体,水的电离平衡均逆向移动 C、纯水的pH=6.5,显酸性 D、pH均为2的CH3COOH溶液与H2SO4溶液中水电离出的H+浓度不同13. 下列说法错误的是( )A、实验中量取20.00mL碳酸钠溶液可使用碱式滴定管 B、为抑制Fe2+水解可向Fe(NO3)2溶液中加入大量浓硝酸 C、FeCl3溶液蒸干并灼烧得到Fe2O3 , 而CaCl2溶液蒸干并灼烧得到CaCl2 D、泡沫灭火器内筒玻璃瓶中的Al2(SO4)3溶液不能换到外筒钢瓶中14. 常温下,向FeCl3溶液中滴加NaOH溶液,pH=2时开始产生沉淀溶液中-lgc(Fe3+)随pH变化的情况如下图所示,下列说法正确的是( ) A、x的值是5.6 B、常温下Fe(OH)3溶度积的数量级为10-37 C、开始产生沉淀之前加入NaOH溶液不发生化学反应 D、若将NaOH溶液换成Na2CO3溶液,pH为4时x值不发生变化15. 已知常温下HF酸性强于HCN,分别向1L1mo/L的HF和HCN溶液中加NaOH固体调节pH(忽略温度和溶液体积变化)溶液中 (X表示F或者CN)随pH变化的情况如下图所示,下列说法错误的是( )
A、x的值是5.6 B、常温下Fe(OH)3溶度积的数量级为10-37 C、开始产生沉淀之前加入NaOH溶液不发生化学反应 D、若将NaOH溶液换成Na2CO3溶液,pH为4时x值不发生变化15. 已知常温下HF酸性强于HCN,分别向1L1mo/L的HF和HCN溶液中加NaOH固体调节pH(忽略温度和溶液体积变化)溶液中 (X表示F或者CN)随pH变化的情况如下图所示,下列说法错误的是( ) A、Ka(HF): Ka(HCN)=106 B、Ⅰ中a点到b点的过程中水的电离程度逐渐增大 C、c点混合溶液中:c(NaX)>c(HX) D、b点溶液和d点溶液相比:cb(Na+)<cd(Na+)16. 沉淀滴定是以沉淀反应为基础的一种滴定分析方法,待测离子沉淀完全(浓度≤10-5mo/L)后溶液中会出现某种明显现象。某种用沉淀滴定法测定溶液中Cl-浓度的原理是:常温下,向待测液中加入2~3滴K2CrO4溶液作指示剂,用标准AgNO3溶液滴定待测液。部分银盐的性质如下表所示:
A、Ka(HF): Ka(HCN)=106 B、Ⅰ中a点到b点的过程中水的电离程度逐渐增大 C、c点混合溶液中:c(NaX)>c(HX) D、b点溶液和d点溶液相比:cb(Na+)<cd(Na+)16. 沉淀滴定是以沉淀反应为基础的一种滴定分析方法,待测离子沉淀完全(浓度≤10-5mo/L)后溶液中会出现某种明显现象。某种用沉淀滴定法测定溶液中Cl-浓度的原理是:常温下,向待测液中加入2~3滴K2CrO4溶液作指示剂,用标准AgNO3溶液滴定待测液。部分银盐的性质如下表所示:银盐
AgCl
AgI
AgCrO4
AgSCN
颜色
白色
黄色
砖红色
白色
KSP(25℃)
1.8×10-10
8.3×10-17
1.12×10-12
1.0×10-12
下列说法错误的是( )
A、滴定终点的现象是产生砖红色沉淀 B、为测量准确加入指示剂后溶液中的c(CrO42-)应小于或等于3.4×10-3m0L C、用标准AgNO3溶液测定溶液中SCN-浓度,不能用KCl溶液作指示剂 D、用标准AgNO3溶液测定溶液中I-浓度,能用K2CrO4溶液作指示剂二、非选择题:共58分。
-
17. 亚磷酸(H3PO3)溶液在空气中会被缓慢氧化成磷酸(H3PO4)溶液氧化过程中溶液的pH逐渐增大。请回答下列问题:(1)、等pH的H3PO3溶液和H3PO4溶液分别稀释m倍和n倍后pH仍相同,则mn(选填“>”“<”或“=”)(2)、已知Na2HPO3溶液中共有三种含磷元素的粒子,这三种粒子的浓度由大到小的顺序是 (用化学式表示),由此可判断H3PO3是 元酸。(3)、25℃时磷酸的电离常数K1=7.5×10-3、K2=6.3×10-8、K3=4.4×10-13 , 则该温度下反应HPO42-+H2O H2PO4-+OH-的平衡常数K=(保留两位有效数字)(4)、Ca3(PO4)2和Cu3(PO4)2的溶度积依次是2×10-29和1.4×10-37 , 向Ca3(PO4)2的悬浊液中加入少量CuCl2浓溶液,发生反应的离子方程式是 , 最终所得溶液中c(Cu2+):c(Ca2+)=。(已知 =191)18. 亚硫酰氯(SOCl2)又叫二氯亚砜,可用于农药医药等方面的生产,可以用作锂电池的正极活性物质。SOCl2的熔点是-105℃,沸点是788℃,易水解生成一种强酸和一种具有漂白性的气体,加热时会部分分解。某种比较先进的合成SOCl2的工艺流程如下图所示。

请回答下列相关问题
(1)、若将SOCl2加入水中,发生反应的化学方程式是。(2)、SOCl2合成反应的原子利用率是100%,该反应的化学方程式是。从理论上分析,S2Cl2合成(硫磺完全反应)、SCl2合成(S2Cl2完全反应)、SOCl2合成(SCl2完全反应)三个阶段消耗的氯气的物质的量之比为。(3)、导热油冷却的目的是。(4)、已经被淘汰的氯磺酸法合成SOCl2的原理是SCl2+HSO3Cl=SOCl2+SO2↑+HCl↑,与流程中的方法相比其缺点是、。(5)、锂亚硫酰氯电池中SOCl2既作正极活性物质又作溶剂,电池总反应是8Li+3SOCl2=6LiCl+Li2SO3+2S,该电池的正极反应是 。19. 对二叔丁基苯[(CH3)3C C(CH3)3]是一种合成化学试剂实验室用苯和叔丁基氯[(CH3)3CCl]在无水ACl2的催化作用下制备对二叔丁基苯,其反应和装置如下图所示:
C(CH3)3]是一种合成化学试剂实验室用苯和叔丁基氯[(CH3)3CCl]在无水ACl2的催化作用下制备对二叔丁基苯,其反应和装置如下图所示:  +2(CH3)3CCl (CH3)3C
+2(CH3)3CCl (CH3)3C  C(CH3)3+2HCl
C(CH3)3+2HCl
可能用到的有关数据如下:
物质
相对分子质量
密度/(g·cm-3)
熔点/(℃)
沸点/(℃)
溶解性
苯
78
0.88
5.5
80.1
难溶于水,与乙醚混溶
叔丁基氯
92.5
0.851
-26
51~52
难溶于水,易溶于杠、乙醚
对二叔丁基苯
190
0.854
77~78
236
难溶于水,易溶于苯、乙醚
乙醚
-
-
-
34.6
难溶于水,与苯混溶
HCl
-
-
-
-
难溶于苯、叔丁基氯等有机物
合成反应在三口烧瓶中加入1.5mL苯和足量叔丁基氯,控制温度在0~5℃,迅速加入0.4g粉末状无水AlCl3 , 保持反应液温度为5-10℃并搅拌,待反应基本完成后将温度逐渐恢复至室温。
分离提纯:用仪器B向三口烧瓶中加入4mL冰水,冷却后用乙醚萃取,萃取液用饱和食盐水洗涤,再向有机层中加入无水硫酸镁并过滤,滤液用沸水浴蒸馏除去大部分有机杂质,然后在通风橱内将剩余有机杂质挥发,得到的白色晶体经称重为1.8g
请回答下列问题:
(1)、仪器A的名称是 , 其作用有。(2)、若将装置中盛放无水氯化钙的仪器去掉,可能会造成的影响是。(3)、合成反应中控制温度的方法是 , 合成反应基本完成的标志现象是 。(4)、蒸馏时除去的有机杂质除苯以外还包括 。(5)、本实验中对二叔丁基苯的产率为(保留两位有效数字)。20. 钒是一种过渡金属,在空气、碱溶液、硫酸溶液和盐酸中均性质稳定,可溶于氢氟酸、硝酸和王水,钒及其化合物在冶金、航天、化工和电池行业都有着广泛的应用。请回答下列相关问题:(1)、钒的最高价氧化物V2O5是一种常用的催化剂,高温分解会生成V2O4和另一种物质,该物质的化学式是。V2O5属于两性氧化物,可溶于硫酸溶液得到VO2+ , 该反应的化学方程式是 , VO2+中V的化合价是。(2)、VCl3是一种还原性较强的紫色晶体,溶于水后会快速生成H2V4O9、VCl2等三种产物,该反应的化学方程式是 ,VCl3保存的条件应该是 。(3)、工业生产钒通常是用热还原法得到含少量铬铁、铝等杂质的粗钒(氧化性:Cr3+>Fe2+>V2+>Al3+),再用电解法精炼得到纯度较高的钒。某工厂测得精炼前后粗钒和成品钒中杂质金属的含量如下表所示精炼系数K(K= )最高的杂质是 。粗钒中杂质含量/%
成品钒中杂质含量/%
Fe
Al
Cr
Fe
Al
Cr
0.06
0.3
0.01
0.008
0.0054
0.005
该工厂用电解法精炼钒的原理如下图所示,下列说法错误的是(填标号)。

A.X电极是电源的正极
B.粗钒表面发生的反应是还原反应
C.粗钒处的电势高于钒棒处的电势
D.钒棒上发生的反应只有V2++2e-=V
21. 氮循环是指氮在自然界中的循环转化过程,含有较多蓝、绿藻类的酸性水体中存在如下图所示的氮循环。
请回答下列相关问题:
(1)、氮气在藻类作用下转化成含氮有机物的过程叫做 。(2)、NO3-在反硝化细菌作用下转化成氮气的总反应是:2NO3-(aq)+10e-+12H+(aq)=N2(g)+6H2O(I)△H
反硝化过程实际分多步进行(全过程电子均来自作电子供体的同种有机物),其中的三步反应为:
NO3-(aq)+2e-+3H+(aq)==HNO2(aq)+H2O(I) △H1
HNO2(aq)+e-+H+(aq)=NO(g)+H2O(I) △H2
N2O(g)+2e-+2H+(aq)=N2(g)+H2O(I) △H3
则另一步反应2NO(g)+2e-+2H+(aq)=N2O(g)+H2O(Ⅰ)的反应热△H4=(用含△H、△H1、△H2、△H3的代数式表示)。水体中发生反硝化作用可减弱硝酸积累对水中生物的危害,但土壤中过多发生反硝化作用对农业生产不利,原因是 。
(3)、NH4+硝化过程的化学方程式是2NH4++3O2 2HNO2+2H2O+2H+ , 恒温时在亚硝酸菌的作用下发生该反应,能说明体系达到平衡状态的是(填标号)。A.溶液的pH不再改变
B.NH4+的消耗速率和H+的生成速率相等
C.溶液中氮原子的总物质的量保持不变
D.断开3molO=O键的同时消耗2molH2O
实验测得在其它条件一定时,NH4+硝化反应的速率随温度变化曲线如下图所示,温度高于35℃时,反应速率迅速下降的原因可能是。
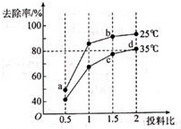
 (4)、亚硝酸盐含量过高对人和动植物都会造成直接或间接的危害,处理亚硝酸盐的方法之一是用次氯酸钠将亚硝酸盐氧化为硝酸盐,反应方程式是ClO-+NO2-=NO3-+Cl-。在25℃和35℃下,分别向NO2-的初始浓度为5×10-3mol/L的溶液中按不同的投料比[ ]加入次氯酸钠固体,平衡时NO2-的去除率和温度投料比的关系如下图所示,a、b、c、d四点ClO-的转化率由小到大的顺序是 ,35℃时,该反应的平衡常数K= (保留三位有效数字)。
(4)、亚硝酸盐含量过高对人和动植物都会造成直接或间接的危害,处理亚硝酸盐的方法之一是用次氯酸钠将亚硝酸盐氧化为硝酸盐,反应方程式是ClO-+NO2-=NO3-+Cl-。在25℃和35℃下,分别向NO2-的初始浓度为5×10-3mol/L的溶液中按不同的投料比[ ]加入次氯酸钠固体,平衡时NO2-的去除率和温度投料比的关系如下图所示,a、b、c、d四点ClO-的转化率由小到大的顺序是 ,35℃时,该反应的平衡常数K= (保留三位有效数字)。