初中化学人教版九年级下学期第八单元测试题
试卷更新日期:2020-01-09 类型:单元试卷
一、单选题
-
1. 下列物品所使用的主要材料属于金属材料的是( )A、
 橡胶轮胎
B、
橡胶轮胎
B、 木雕作品
C、
木雕作品
C、 艺术瓷瓶
D、
艺术瓷瓶
D、 青铜摆件
2. 下列物质不属于合金的是()A、生铁 B、玻璃钢 C、黄铜 D、硬铝3. 下列反应属于置换反应的是()A、3Fe+2O2 Fe3O4 B、CaCO3 CaO+CO2↑ C、2KMnO4 K2MnO4+MnO2+O2↑ D、Cl2+2KI=2KCl+I24. 只用一种试剂就能一次性判断金属锌、铜、银的活动性顺序,这种试剂是( )A、氯化镁溶液 B、稀硫酸 C、硫酸铜溶液 D、硝酸银溶液5. 下列物质,不能由金属单质和盐酸直接反应生成的是( )A、FeCl3 B、ZnCl2 C、MgCl2 D、AlCl36. 假设与排除是探索未知物的一种方法。《本草纲目拾遗》中记载:“强水性最烈,能蚀五金(金、银、铜、铅、铁)”,下列物质最可能是“强水”的是( )A、硫酸亚铁溶液 B、稀盐酸 C、浓硝酸和浓盐酸的混合物 D、稀硫酸7. 相同质量的Mg、Fe、Zn三种金属,分別与足量的、质量相同、质量分数相同的稀H2SO4充分反应,生成氢气与消耗稀H2SO4的质量关系见图,分析图象所得的结论中,错误的是( )
青铜摆件
2. 下列物质不属于合金的是()A、生铁 B、玻璃钢 C、黄铜 D、硬铝3. 下列反应属于置换反应的是()A、3Fe+2O2 Fe3O4 B、CaCO3 CaO+CO2↑ C、2KMnO4 K2MnO4+MnO2+O2↑ D、Cl2+2KI=2KCl+I24. 只用一种试剂就能一次性判断金属锌、铜、银的活动性顺序,这种试剂是( )A、氯化镁溶液 B、稀硫酸 C、硫酸铜溶液 D、硝酸银溶液5. 下列物质,不能由金属单质和盐酸直接反应生成的是( )A、FeCl3 B、ZnCl2 C、MgCl2 D、AlCl36. 假设与排除是探索未知物的一种方法。《本草纲目拾遗》中记载:“强水性最烈,能蚀五金(金、银、铜、铅、铁)”,下列物质最可能是“强水”的是( )A、硫酸亚铁溶液 B、稀盐酸 C、浓硝酸和浓盐酸的混合物 D、稀硫酸7. 相同质量的Mg、Fe、Zn三种金属,分別与足量的、质量相同、质量分数相同的稀H2SO4充分反应,生成氢气与消耗稀H2SO4的质量关系见图,分析图象所得的结论中,错误的是( )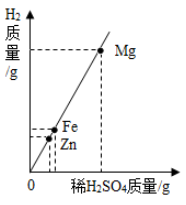 A、三种金属的活动性顺序: B、三种金属的相对原子质量: C、三种金属消耗稀 的质量: D、三种金属与稀 反应后溶液的质量:8. 我国西汉时期,在《淮南万毕术》中记载“曾青得铁则化为铜”,意思是可溶性的铜的化合物与铁发生反应得到单质铜。此为现代湿法冶金的先驱。下列有关说法正确的是()A、由该反应可推测出铜能与稀硫酸反应 B、该反应证明了铁的金属活动性比铜强 C、若铁足量,溶液的颜色将逐渐变为无色 D、该反应属于复分解反应9. 将一定量的铁粉加入到含有Cu(NO3)2和AgNO3的废液中,充分反应后过滤,向滤渣中加入稀盐酸,无气泡产生。下列判断正确的是()A、滤渣中一定含有Ag和Cu,滤液中一定含有Fe(NO3)2 B、滤渣中一定不含Fe,滤液中一定含有Fe(NO3)2和Cu(NO3)2 C、滤渣中一定含有Ag,滤液中可能含有Cu(NO3)2和AgNO3 D、滤渣中一定含有Ag和Cu,滤液中可能含有Cu(NO3)2和AgNO310. 把铁钉放入稀硫酸中,下列叙述正确的是( )
A、三种金属的活动性顺序: B、三种金属的相对原子质量: C、三种金属消耗稀 的质量: D、三种金属与稀 反应后溶液的质量:8. 我国西汉时期,在《淮南万毕术》中记载“曾青得铁则化为铜”,意思是可溶性的铜的化合物与铁发生反应得到单质铜。此为现代湿法冶金的先驱。下列有关说法正确的是()A、由该反应可推测出铜能与稀硫酸反应 B、该反应证明了铁的金属活动性比铜强 C、若铁足量,溶液的颜色将逐渐变为无色 D、该反应属于复分解反应9. 将一定量的铁粉加入到含有Cu(NO3)2和AgNO3的废液中,充分反应后过滤,向滤渣中加入稀盐酸,无气泡产生。下列判断正确的是()A、滤渣中一定含有Ag和Cu,滤液中一定含有Fe(NO3)2 B、滤渣中一定不含Fe,滤液中一定含有Fe(NO3)2和Cu(NO3)2 C、滤渣中一定含有Ag,滤液中可能含有Cu(NO3)2和AgNO3 D、滤渣中一定含有Ag和Cu,滤液中可能含有Cu(NO3)2和AgNO310. 把铁钉放入稀硫酸中,下列叙述正确的是( )①在铁钉表面产生气泡②溶液由无色逐渐变为浅绿色③铁钉的质量增加
A、②③ B、①②③ C、①③ D、①②二、填空题
-
11. 请用化学式填空:
金属活动顺序中,最活泼的金属是 ,人体中含量最高的金属元素是 ,应用最广泛的金属是 ,香烟盒中的金属纸是 ,灯泡中的金属丝是 ,量血压的气压计中用的金属是 .
12. 地球上的金属资源大多以化合物的形式存在,还原法是冶炼金属的常用方法。请写出用一氧化碳从赤铁矿(主要成分为氧化铁)中冶炼铁的化学方程式。铁在自然环境中很容易生锈,请写出一种防止钢铁制品锈蚀的方法。13.根据下面部分金属的活动性顺序回答:
(1)上述金属中活动性最强的是;
(2)按年代最早被广泛使用的金属是;
(3)已知:①X+H2SO4=XSO4+H2↑ ②Y+2ZNO3=Y(NO3)2+2Z ③Y与稀硫酸不反应,则符合要求的X、Y、Z分别是 (填字母序号).
A.Cu、Hg、Ag B.Fe、Cu、Ag C.Mg、Zn、Fe.
 14. 向硝酸银、硝酸铜、硝酸亚铁的混合溶液中加入一定质量的锌粉,反应停止后过滤,得滤渣A和滤液B.向滤渣A中加入稀盐酸,有气泡冒出.则滤渣A中一定有;滤液B中一定有的金属离子是 , 一定没有的金属离子是 .
14. 向硝酸银、硝酸铜、硝酸亚铁的混合溶液中加入一定质量的锌粉,反应停止后过滤,得滤渣A和滤液B.向滤渣A中加入稀盐酸,有气泡冒出.则滤渣A中一定有;滤液B中一定有的金属离子是 , 一定没有的金属离子是 .三、综合题
-
15. 人类历史发展的不同阶段曾以不同金属材料的使用作为标志。
 (1)、金、银在自然界有单质形式存在,说明他们的化学性质都。(2)、在生产生活实践中,人类逐渐掌握了多种金属的冶炼技术。
(1)、金、银在自然界有单质形式存在,说明他们的化学性质都。(2)、在生产生活实践中,人类逐渐掌握了多种金属的冶炼技术。①比较两种铁矿石磁铁矿(主要成分Fe3O4)和菱铁矿(主要成分FeCO3),从化学的角度分析“磁铁矿作炼铁原料更具优势”,其原因是。
②近代工业上采用电解熔融氧化铝(Al2O3)的方法冶炼铝,Al2O3分解后得到两种单质,该反应的化学方程式为。
(3)、镁铝合金被誉为“21世纪绿色金属结构材料”。一种镁铝合金Mg17All2是特殊的储氢材料,完全吸收氢气后得到MgH2和Al,该反应的化学方程式为。(4)、钛和钛合金是21世纪的重要的金属材料。钛合金制品放在海水中数年,取出后仍光亮如新,是因为其_____(填字母序号)非常好。A、可塑性 B、机械性能 C、抗腐蚀性能(5)、铁在潮湿的空气中反应生成疏松的铁锈。已知:2FeCl3+Fe=3FeCl2①铁锈的主要成分是(填化学式):将生锈的铁制品放入一定量的稀盐酸中充分反应,变化过程中最多涉及种化学反应基本类型。
②将10g表面生锈的铁钉(杂质已忽略)浸泡在100g溶质质量分数为7.3%的稀盐酸中充分反应,观察到铁锈已完全消失。反应停止后,取出光亮的铁钉洗涤、干燥、称量,质量为3.6g。则原锈铁钉中铁元素的质量分数为。
(6)、利用“活泼金属”可以制得H2 , H2可用作汽车能源。若推广应用于汽车产业,则需综合考虑的因素有_____(填字母序号)。A、金属原料的成本 B、生成过程中的能耗和污染 C、金属的回收利用四、实验探究题
-
16. 铜锈,俗称“铜绿”,主要成分是Cu2(OH)2CO3。课外活动小组围绕铜生锈的条件展开探究:

 (1)、(查阅资料)二氧化碳易与氢氧化钠溶液发生化学反应,生成碳酸钠和水。
(1)、(查阅资料)二氧化碳易与氢氧化钠溶液发生化学反应,生成碳酸钠和水。提出问题)铜在什么条件下会生锈?
(假设猜想)根据铜锈主要成分的化学式,猜想铜生锈可能是铜与空气中水、氧气、共同作用的结果。
(2)、(探究过程)小组同学设计了“铜片锈蚀条件的探究”实验如上图所示:实验进行较长一段时间后,观察现象可发现(填序号)试管中的光亮铜片最先生锈。B试管中氢氧化钠溶液的作用。(3)、(评价与改进)我认为课外小组设计的实验不够完普,若要得出正确结论,还要补充的一个实验是(也可在上面方框内画图表示)(4)、(反思与小结)补充实验后,通过实验证明了原猜想正确,则铜生锈变成铜绿的化学方程式为(5)、(拓展应用)写出一种防止铁或铜等金属制品生锈的具体方法为。17. 某研究小组为验证铁、铜、锌、银的金属活动性顺序,设计如图甲所示三个实验(三种金属均已用砂纸打磨过,其形状和大小相同,稀盐酸的浓度和用量也相同)。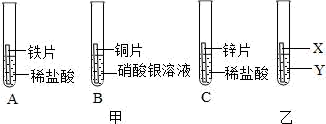 (1)、实验前用砂纸打磨金属的目的是。(2)、一段时间后,观察到实验B的铜片表面有银白色固体附着,且溶液由无色变为色,这说明铜比银的金属活动性(填“强”或“弱”),该反应的化学方程式为。(3)、甲同学认为通过实验A和C可比较锌和铁的金属活动性,他依据的实验现象是。(4)、乙同学认为仅仅通过上述实验不足以得出四种金属的活动性顺序,因此在上述实验的基础上,乙同学又补做了一个实验,装置如图乙所示,且实现了探究目的。乙同学的实验:X是金属 , Y是溶液。
(1)、实验前用砂纸打磨金属的目的是。(2)、一段时间后,观察到实验B的铜片表面有银白色固体附着,且溶液由无色变为色,这说明铜比银的金属活动性(填“强”或“弱”),该反应的化学方程式为。(3)、甲同学认为通过实验A和C可比较锌和铁的金属活动性,他依据的实验现象是。(4)、乙同学认为仅仅通过上述实验不足以得出四种金属的活动性顺序,因此在上述实验的基础上,乙同学又补做了一个实验,装置如图乙所示,且实现了探究目的。乙同学的实验:X是金属 , Y是溶液。五、计算题
-
18. 将Cu-Zn合金样品20g放入足量稀硫酸中,所产生氢气的质量与反应时间的关系如图所示.试计算:
 (1)、反应产生氢气的质量为g(2)、原样品中所含锌的质量分数 .(3)、实验测得20g该样品与154.7g某稀硫酸恰好完全反应,求此时所得溶质的质量
(1)、反应产生氢气的质量为g(2)、原样品中所含锌的质量分数 .(3)、实验测得20g该样品与154.7g某稀硫酸恰好完全反应,求此时所得溶质的质量
-