上海市松江区2019-2020学年九年级上学期化学第三次月考试卷
试卷更新日期:2020-01-07 类型:月考试卷
一、单选题
-
1. 小明在探究蔗糖的性质实验前,所做的假设属于化学变化范畴的是()A、能否溶于酒精 B、能否磨碎变成糖粉 C、能否变成酒精 D、能否通过结晶方法变成大晶体2. 下列物质中,属于纯净物的是()A、豆浆 B、酒精 C、食醋 D、牛奶3. 下列物质放入水中,不能形成溶液的是()A、花生油 B、白糖 C、白酒 D、白醋4. ClO2 中氯元素的化合价为()A、-1 B、-2 C、+2 D、+45. 50℃时某物质的溶解度为 100 克/100 克水,则 50℃时此物质的饱和溶液中质量关系为()A、溶质∶溶液=1∶1 B、溶质∶溶剂=1∶1 C、溶剂∶溶液=1∶1 D、饱和溶液的质量一定为 200 g6. 家庭常用液体的pH如下,酸性最强的是()A、洁厕精:1.0 B、洗发露:7.6 C、洗衣液:10.5 D、漂白液:13.47. 下列各因素不会影响固体溶解度的是()A、溶质的种类 B、溶剂的种类 C、溶剂的质量 D、温度的变化8. 打开汽水瓶盖会有大量气泡冒出,产生这一现象的原因是二氧化碳的溶解度随( )A、压强增大而减小 B、压强减小而减小 C、温度升高而升高 D、温度降低而减小9. 下列物质在氧气中燃烧,生成黑色固体的是()A、木炭 B、铁丝 C、硫粉 D、红磷10. 用氯化钠固体和蒸馏水配制 50g10%的氯化钠溶液,不需要的实验仪器是()A、玻璃棒 B、蒸发皿 C、烧杯 D、天平11. 实验室中下列药品存放规范的是()A、
 氧气
B、
氧气
B、 氢氧化钠溶液
C、
氢氧化钠溶液
C、 硝酸钾固体
D、
硝酸钾固体
D、 稀盐酸
12. 下列物质的名称和化学式相对应的是()A、胆矾 CuSO4 B、氯化氨 NH4Cl C、氢氧化铁 Fe(OH)2 D、氧化钙 CaO13. 20℃时,15gA与30g水混合正好形成饱和溶液,40℃时,20g水最多能溶解5gB物质,则A、B两物质的溶解度大小关系是()A、SA>SB B、SA<SB C、SA=SB D、无法确定14. 对“质量分数为 10%的食盐水”含义解释错误的是()A、100g食盐溶液中溶有10g食盐 B、将 10g食盐溶于90g水中所得的溶液 C、100g水中溶解了10g 食盐 D、将食盐与水按1:9的质量比配成溶液15. 对于某一澄清透明的酸雨样品,判断正确的是( )A、呈中性 B、pH>7 C、属于悬浊液 D、属于溶液16. 室温下,把 100g 10%的硝酸钾溶液中溶质质量分数增加到 20%,可以采用的方法是()A、蒸发掉 45g 水 B、蒸发掉 50g 水 C、加入 10g 硝酸钾 D、加入 100g 10%硝酸钾溶液17. 某物质的溶解度见下图。40℃时将60g该物质放入100g水中充分溶解,有关判断正确的是()
稀盐酸
12. 下列物质的名称和化学式相对应的是()A、胆矾 CuSO4 B、氯化氨 NH4Cl C、氢氧化铁 Fe(OH)2 D、氧化钙 CaO13. 20℃时,15gA与30g水混合正好形成饱和溶液,40℃时,20g水最多能溶解5gB物质,则A、B两物质的溶解度大小关系是()A、SA>SB B、SA<SB C、SA=SB D、无法确定14. 对“质量分数为 10%的食盐水”含义解释错误的是()A、100g食盐溶液中溶有10g食盐 B、将 10g食盐溶于90g水中所得的溶液 C、100g水中溶解了10g 食盐 D、将食盐与水按1:9的质量比配成溶液15. 对于某一澄清透明的酸雨样品,判断正确的是( )A、呈中性 B、pH>7 C、属于悬浊液 D、属于溶液16. 室温下,把 100g 10%的硝酸钾溶液中溶质质量分数增加到 20%,可以采用的方法是()A、蒸发掉 45g 水 B、蒸发掉 50g 水 C、加入 10g 硝酸钾 D、加入 100g 10%硝酸钾溶液17. 某物质的溶解度见下图。40℃时将60g该物质放入100g水中充分溶解,有关判断正确的是() A、40℃时形成160g溶液 B、若降温至20℃,溶质质量减少 C、若升温至60℃,溶质质量分数不变 D、若升温至80℃,溶液是饱和溶液18. 25℃时向一定量不饱和KNO3溶液中逐渐加入KNO3固体,则下列图像中能正确表示此过程溶质质量变化规律的是()A、
A、40℃时形成160g溶液 B、若降温至20℃,溶质质量减少 C、若升温至60℃,溶质质量分数不变 D、若升温至80℃,溶液是饱和溶液18. 25℃时向一定量不饱和KNO3溶液中逐渐加入KNO3固体,则下列图像中能正确表示此过程溶质质量变化规律的是()A、 B、
B、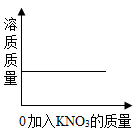 C、
C、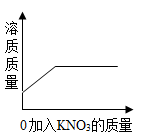 D、
D、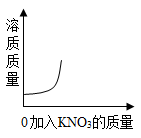 19. 20℃时,恒温蒸发某硝酸钾溶液,第一次蒸发掉10克水,没有晶体析出;第二次又蒸发掉10克水,析出3克晶体;第三次再蒸发掉10克水,析出m克晶体()A、m<3 B、m≤3 C、m>3 D、m≥320. 如图为M、N两种固体物质的溶解度曲线,下列对图示信息的描述正确的是()
19. 20℃时,恒温蒸发某硝酸钾溶液,第一次蒸发掉10克水,没有晶体析出;第二次又蒸发掉10克水,析出3克晶体;第三次再蒸发掉10克水,析出m克晶体()A、m<3 B、m≤3 C、m>3 D、m≥320. 如图为M、N两种固体物质的溶解度曲线,下列对图示信息的描述正确的是() A、30℃时M的溶解度小于N的溶解度 B、P点表示t℃时M、N的溶解度相等 C、M、N都是难溶物质 D、阴影处各点对应的溶液(不包含曲线上的点)是M的不饱和溶液,N的饱和溶液
A、30℃时M的溶解度小于N的溶解度 B、P点表示t℃时M、N的溶解度相等 C、M、N都是难溶物质 D、阴影处各点对应的溶液(不包含曲线上的点)是M的不饱和溶液,N的饱和溶液二、填空题
-
21. 化学与生活密切相关,请按要求填空。(1)、用来检验无水酒精中是否含有水的物质是化学式为;(2)、引起酸雨的主要物质是;(3)、自来水生产过程中加液氯的目的是;(4)、丙烷(C3H8)是液化石油气的主要成分,C3H8的摩尔质量是 , 其中碳元素的质量分数是(用分数表示),0.25molC3H8中约含有个H原子。22. 走进化学变化的微观世界,有利于进一步认识化学变化。如图是某化学变化的微观示意图,据图回答问题:
 (1)、写出反应中氧化物的化学式;(2)、参与反应的
(1)、写出反应中氧化物的化学式;(2)、参与反应的 的与
的与  的分子个数比为; (3)、试写出该变化的化学方程式:;(4)、该反应的基本反应类型是。23. 下表是NaCl和KNO3物质在不同温度下的部分溶解度数据(单位:g/100g水),请回答问题:
的分子个数比为; (3)、试写出该变化的化学方程式:;(4)、该反应的基本反应类型是。23. 下表是NaCl和KNO3物质在不同温度下的部分溶解度数据(单位:g/100g水),请回答问题:温度(℃)
10
20
30
40
60
NaCl
35.8
36.0
36.3
36.6
37.3
KNO3
20.9
31.6
45.8
63.9
110
(1)、20℃时,NaCl的溶解度是g/100g水;(2)、以上两种物质溶解度变化受温度影响较小的是(选填“NaCl”或“KNO3”);(3)、20℃时,将20gNaCl固体加入50g水中,充分搅拌,形成的溶液质量为g;(4)、为了将混有少量NaCl杂质的KNO3的饱和溶液提纯,可通过方法获得较纯净的KNO3晶体;(5)、40℃时,将NaCl和KNO3的饱和溶液各100g降温到20℃,对剩余溶液描述正确的是________。A、溶质的质量分数:NaCl>KNO3 B、析出固体的质量:NaCl>KNO3 C、温度降至20℃时, 和 都是饱和溶液 D、温度降低溶剂质量不变,溶剂的质量: >三、实验题
-
24. 用如图装置进行水的电解实验。已知氢氧化钠在水的电解实验中,只起到增强水的导电性作用。
 (1)、开始反应前a、b两管内都充满4%的氢氧化钠溶液。关闭活塞,接通电源,可以看到两个电极上出现;一段时间后,两管产生的气体如图所示,则a管下方导线应接电源的(填“正”或“负”)极,用验证b管中的气体。(2)、该实验证明水是由组成的,电解水的方程式为(3)、电解后溶液的溶质质量分数4%(选填“<”、“=”或“>”)。25. 下图是配制100g溶质质量分数为10%的NaCl溶液实验操作示意图:
(1)、开始反应前a、b两管内都充满4%的氢氧化钠溶液。关闭活塞,接通电源,可以看到两个电极上出现;一段时间后,两管产生的气体如图所示,则a管下方导线应接电源的(填“正”或“负”)极,用验证b管中的气体。(2)、该实验证明水是由组成的,电解水的方程式为(3)、电解后溶液的溶质质量分数4%(选填“<”、“=”或“>”)。25. 下图是配制100g溶质质量分数为10%的NaCl溶液实验操作示意图: (1)、用上图的序号表示配制溶液的正确操作顺序是;(2)、图D中,取用固体NaCl的仪器名称是;(3)、图E中,将氯化钠放在称量纸上,称出g氯化钠;量取所需的水(此时水的密度可看作1g/mL),应选择量筒的规格是(选填“10”、“50”或“100”)mL。量取读数时,下图视线角度正确的是(填序号);
(1)、用上图的序号表示配制溶液的正确操作顺序是;(2)、图D中,取用固体NaCl的仪器名称是;(3)、图E中,将氯化钠放在称量纸上,称出g氯化钠;量取所需的水(此时水的密度可看作1g/mL),应选择量筒的规格是(选填“10”、“50”或“100”)mL。量取读数时,下图视线角度正确的是(填序号);
四、综合题
-
26. 根据下面的装置图,回答下列问题:
 (1)、写出指定仪器的名称:a.(2)、用装置A作为发生装置制取氧气,发生反应的化学方程式为 , 其中二氧化锰的作用是;可用D装置收集氧气,是因为氧气的性质,当看到现象时,说明氧气收满;(3)、实验室用溶质质量分数为20%的过氧化氢溶液和二氧化锰制氧气,并选用图B做发生装置时,同学们发现不能得到平稳的氧气流,大家提出从两方面加以改进:
(1)、写出指定仪器的名称:a.(2)、用装置A作为发生装置制取氧气,发生反应的化学方程式为 , 其中二氧化锰的作用是;可用D装置收集氧气,是因为氧气的性质,当看到现象时,说明氧气收满;(3)、实验室用溶质质量分数为20%的过氧化氢溶液和二氧化锰制氧气,并选用图B做发生装置时,同学们发现不能得到平稳的氧气流,大家提出从两方面加以改进:一是选用图C做发生装置,其理由是;
二是加水稀释过氧化氢溶液,若把50g溶质质量分数为20%的过氧化氢溶液稀释成溶质质量分数为5%的过氧化氢溶液,需加水的质量为g;
(4)、现有一瓶102g双氧水,加入适量二氧化锰,完全反应后生成氧气的物质的量为0.03mol,试计算参与反应的过氧化氢的物质的量和这瓶双氧水溶质质量分数。(写出计算过程)