2017年陕西省西安市电子科大附中高考化学二诊试卷
试卷更新日期:2017-08-01 类型:高考模拟
一、本卷共7题,在每题给出的四个备选项中,只有一项符合题目要求.
-
1. 化学与生产、生活密切相关,下列说法不正确的是( )A、Fe2O3常用作红色油漆和涂料 B、生物柴油与柴油的化学成分相同 C、聚丙烯酸钠可做“尿不湿”原料 D、液氯或浓硫酸可用钢瓶储存2. 设NA为阿伏加德罗常数的值.下列说法正确的是( )A、高温下,0.2 mol Fe与足量水蒸气反应,生成的H2分子数目为0.3NA B、室温下,1 L pH=13的NaOH溶液中,由水电离的OH﹣离子数目为0.1NA C、氢氧燃料电池正极消耗22.4 L(标准状况)气体时,电路中通过的电子数目为2NA D、5NH4NO3 2HNO3+4N2↑+9H2O反应中,生成28 g N2时,转移的电子数目为3.75NA3. 分子式为C9H10O2的芳香族化合物并且能与饱和NaHCO3溶液反应放出气体的有机物有(不含立体异构)( )A、6种 B、8种 C、12种 D、14种4. 已知X、Y、Z、W四种短周期主族元素在周期表中的相对位置如图所示,下列说法中正确的是( )
 A、W的原子序数不可能是X的原子序数的3倍 B、Z元素可能是金属元素 C、W的气态氢化物的稳定性一定比Y的强 D、四种元素的原子有可能均能与氢原子形成18电子分子5. 表中的实验内容不能达到实验目的或不能得出相应实验结论的是( )
A、W的原子序数不可能是X的原子序数的3倍 B、Z元素可能是金属元素 C、W的气态氢化物的稳定性一定比Y的强 D、四种元素的原子有可能均能与氢原子形成18电子分子5. 表中的实验内容不能达到实验目的或不能得出相应实验结论的是( )编号
实验内容
实验目的或实验结论
①
向足量的酸性KMnO4溶液中加入乙二醇(HOCH2CH2OH)
将乙二醇转化为乙二酸(H2C2O4)
②
向5mL 0.1mol/L AgNO3溶液中滴加1mL 0.1mol/L NaCl溶液,有白色沉淀生成,再向其中滴加1mL 0.1mol/L KI溶液,有黄色沉淀生成.
验证AgCl的溶解度比AgI大
③
向KI溶液中滴入CuSO4溶液,有白色沉淀生成,但无气体产生,再加入四氯化碳振荡,四氯化碳层呈紫色.
说明白色沉淀可能为CuI
④
室温下,分别向2支试管中加入相同体积、相同浓度的Na2S2O3溶液,再分别加入等体积不同浓度的稀硫酸.
研究浓度对反应速率的影响
⑤
将铁粉投入到盛有稀HNO3的试管中,充分反应后滴入几滴KSCN溶液无明显现象.
说明HNO3将Fe氧化成Fe2+
A、①②⑤ B、②③⑤ C、②③④ D、①②③6. H2C2O4为二元弱酸.20℃时,配制一组c(H2C2O4)+c(HC2O4﹣)+c(C2O42﹣)=0.100mol•L﹣1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示.下列指定溶液中微粒的物质的量浓度关系一定正确的是( ) A、pH=2.5的溶液中:c(H2C2O4)+c(C2O42﹣)>c(HC2O4﹣) B、c(Na+)=0.100 mol•L﹣1的溶液中:c(H+)+c(H2C2O4)=c(OH﹣)+c(C2O42﹣) C、c(HC2O4﹣)=c(C2O42﹣)的溶液中:c(Na+)>0.100 mol•L﹣1+c(HC2O4﹣) D、pH=7.0的溶液中:c(Na+)=2(C2O42﹣)7. 在恒温条件下,向盛有食盐的2L恒容密闭容器中加入0.2molNO2、0.2molNO和0.1molCl2 , 发生如下两个反应:
A、pH=2.5的溶液中:c(H2C2O4)+c(C2O42﹣)>c(HC2O4﹣) B、c(Na+)=0.100 mol•L﹣1的溶液中:c(H+)+c(H2C2O4)=c(OH﹣)+c(C2O42﹣) C、c(HC2O4﹣)=c(C2O42﹣)的溶液中:c(Na+)>0.100 mol•L﹣1+c(HC2O4﹣) D、pH=7.0的溶液中:c(Na+)=2(C2O42﹣)7. 在恒温条件下,向盛有食盐的2L恒容密闭容器中加入0.2molNO2、0.2molNO和0.1molCl2 , 发生如下两个反应:①2NO2(g)+NaCl(s)⇌NaNO3(s)+ClNO(g)△H1<0 平衡常数K1
②2NO(g)+Cl2(g)⇌2ClNO(g)△H2<0 平衡常数K2
10min时反应达到平衡,测得容器内体系的压强减少20%,10min内用ClNO(g)表示的平均反应速率v(ClNO)=7.5×10﹣3mol/(L•min).下列说法不正确的是( )
A、反应4NO2(g)+2NaCl(s)⇌2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数为K12/K2 B、平衡后c(Cl2)=2.5×10﹣2mol/L C、其它条件保持不变,反应在恒压条件下进行,则平衡常数K2增大 D、平衡时NO2的转化率为50%二、非选择题
-
8. 为有效控制雾霾,各地积极采取措施改善大气质量.有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要.(1)、在汽车排气管内安装催化转化器,可将汽车尾气中主要污染物转化为无毒的大气循环物质.
已知:①N2(g)+O2(g)═2NO(g)△H1=+180.5kJ•mol﹣1
②C和C0的燃烧热(△H)分别为﹣393.5kJ•mol﹣1和﹣283kJ•mol﹣1
则2NO(g)+2CO(g)═N2(g)+2CO2(g)的△H=kJ•mol﹣1
(2)、将0.20mol NO和0.10mol CO充入一个容积为1L的密闭容器中,反应过程中物质浓度变化如图所示.①CO在0﹣9min内的平均反应速率v(CO)=mol•L﹣1•min﹣1(保留两位有效数字);第12min时改变的反应条件可能为 .
A.升高温度 B.加入NO C.加催化剂 D.降低温度
②该反应在第24min时达到平衡状态,CO2的体积分数为(保留三位有效数字),化学平衡常数K=(保留两位有效数字).
 (3)、烟气中的SO2可用某浓度NaOH溶液吸收得到Na2SO3和NaHSO3混合溶液,且所得溶液呈中性,该溶液中c(Na+)=(用含硫微粒浓度的代数式表示).(4)、通过人工光合作用能将水与燃煤产生的CO2转化成HCOOH和O2 . 已知常温下0.1mol•L﹣1的HCOONa溶液pH=10,则HCOOH的电离常数Ka= .9. 以铝灰(主要成分为Al、Al2O3 , 另有少量CuO、SiO2、FeO和Fe2O3杂质)为原料,可制得液体聚合氯化铝[Alm(OH)nCl3m﹣n],生产的部分过程如图所示(部分产物和操作已略去).
(3)、烟气中的SO2可用某浓度NaOH溶液吸收得到Na2SO3和NaHSO3混合溶液,且所得溶液呈中性,该溶液中c(Na+)=(用含硫微粒浓度的代数式表示).(4)、通过人工光合作用能将水与燃煤产生的CO2转化成HCOOH和O2 . 已知常温下0.1mol•L﹣1的HCOONa溶液pH=10,则HCOOH的电离常数Ka= .9. 以铝灰(主要成分为Al、Al2O3 , 另有少量CuO、SiO2、FeO和Fe2O3杂质)为原料,可制得液体聚合氯化铝[Alm(OH)nCl3m﹣n],生产的部分过程如图所示(部分产物和操作已略去).
已知某些硫化物的性质如下表:
物质
性质
Fe2S3 Al2S3
在水溶液中不存在
FeS
黑色,难溶于水,可溶于盐酸
CuS
黑色,难溶于水,难溶于盐酸
(1)、操作I是 . Al2O3与盐酸反应的离子方程式是 .(2)、滤渣2为黑色,该黑色物质的化学式是 .(3)、向滤液2中加入NaClO溶液至不再产生红褐色沉淀,此时溶液的pH约为3.7.NaClO的作用是 .(4)、将滤液3的pH调至4.2~4.5,利用水解反应得到液体聚合氯化铝.反应的化学方程式是 .(5)、将滤液3电解也可以得到液体聚合氯化铝.装置如图所示(阴离子交换膜只允许阴离子通过,电极为惰性电极).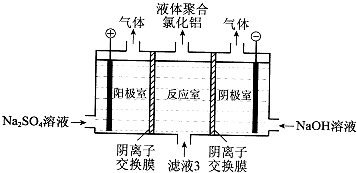
①写出阴极室的电极反应: .
②简述在反应室中生成聚合氯他铝的原理: .
10. 某研究性学习小组对Cu与H2SO4反应的产物种类和性质进行探究.Ⅰ.产物种类探究
在铜与浓硫酸反应的过程中,发现有黑色物质出现,经查阅文献获得下列资料.
资料1:X射线晶体分析表明,铜与浓硫酸反应生成的黑色物质为中的一种或两种.
资料2:
硫酸/mol•L﹣1
黑色物质出现的温度/℃
黑色物质消失的温度/℃
15
约150
约236
16
约140
约250
18
约120
不消失
(1)、由上述资料2可得出的正确结论是(选填下列字母编号)a.铜与浓硫酸反应时所涉及的反应可能不止一个
b.硫酸浓度选择适当,可避免最后产物中出现黑色物质
c.该反应发生的条件之一是硫酸浓度>15mol•L﹣1
d.硫酸浓度越大,黑色物质出现越快,越难消失
(2)、Cu与足量16mol•L﹣1浓硫酸反应时,在80℃以后,随着温度的逐渐升高,反应中硫酸铜的生成逐渐增加,而CuS却逐渐减少,到达250℃左右时,CuS在反应中完全消失的澄清溶液,CuS消失的化学方程式为 .(3)、Ⅱ.产物性质探究Cu与浓H2SO4反应生成的CuSO4具有某些特定性质,一定浓度CuSO4溶液与NaHCO3溶液反应后生成蓝绿色颗粒状沉淀,沉淀可能是CuCO3 , Cu(OH)2 , 或者CuCO3与Cu(OH)2的混合物.
1)若沉淀是Cu(OH)2 , 生成沉淀的离子方程式是 .
2)为了进一步探究沉淀的成分,设计的实验装置如图:
实验操作步骤为
a.取沉淀样品100克于B中,检查装置的气密性
b.打开K1 , K3 , 关闭K2 , K4 , 通入足量空气
c.关闭K1 , K3 , 打开K2 , K4 , 充分反应
d.反应结束后,关闭K2 , 打开K1 , 再通入足量空气
e.测得装置D的质量增加了22g
①步骤b的作用是
②若沉淀样品为CuCO3和Cu(OH)2的混合物,则Cu(OH)2的质量分数为 , 若不进行步骤d,则会使测得Cu(OH)2的质量分数为(填“偏高”“无影响”“偏低”)
 11. 以苯为主要原料,制取高分子材料N和R的流程如下:
11. 以苯为主要原料,制取高分子材料N和R的流程如下:
已知:
 (1)、B中含氧官能团的名称是 .(2)、由
(1)、B中含氧官能团的名称是 .(2)、由 生成
生成  的反应类型是 . (3)、反应Ⅰ的反应条件是 .(4)、化合物C的结构简式是 .(5)、反应Ⅱ的化学方程式是 .(6)、下列说法正确的是(选填序号字母).
的反应类型是 . (3)、反应Ⅰ的反应条件是 .(4)、化合物C的结构简式是 .(5)、反应Ⅱ的化学方程式是 .(6)、下列说法正确的是(选填序号字母).a.A可与NaOH溶液反应 b.常温下,A能和水以任意比混溶
c.化合物C可使高锰酸钾酸性溶液褪色 d.E存在顺反异构体
(7)、反应Ⅲ的化学方程式是 .(8)、符合下列条件的B的同分异构体有种.a.能与饱和溴水反应生成白色沉淀 b.属于酯类 c.苯环上只有两个对位取代基.