2017年北京市丰台区高考化学二模试卷
试卷更新日期:2017-08-01 类型:高考模拟
一、选择题
-
1. 铁锅表面覆盖有下列物质时,锈蚀速率最快的是( )A、水 B、食盐水 C、食用油 D、酒精2. 生活中下列物质起还原作用的是( )A、明矾作净水剂 B、硅胶作干燥剂 C、铁粉作脱氧剂 D、活性炭作吸附剂3. 下列由相关实验现象所推出的结论正确的是( )A、纯碱溶液和烧碱溶液均呈碱性,说明二者均属于碱 B、Cl2、SO2均能使品红溶液褪色,说明二者均有氧化性 C、某酸与Na2CO3反应生成CO2 , 说明该酸一定是强酸 D、某溶液中滴加KSCN溶液后,溶液不变色,滴加氯水后溶液显红色,该溶液中一定含Fe2+4. 下列说法不正确的是( )A、苯甲酸共有四个同分异构体(含苯环且包括苯甲酸) B、相同条件下的沸点:乙二醇>乙醇>乙烷>甲烷 C、CH3COOCH3在核磁共振氢谱中有两种不同类型的氢原子 D、两种不同的氨基酸在缩聚反应时可生成不少于4种的聚合物5. 利用图1和图2中的信息,按图3装置(连接的A、B瓶中已充有NO2气体)进行实验.
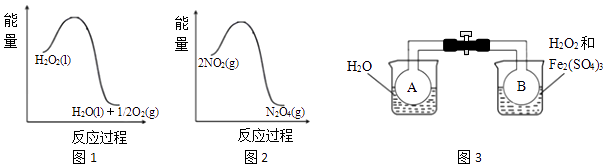
下列说法正确的是( )
A、H2O2中只含有极性共价键,不含离子键 B、2NO2⇌N2O4的平衡常数K随温度升高而减小 C、向H2O2中加入Fe2(SO4)3后,B中颜色变浅 D、H2O2分解反应中Fe2(SO4)3作催化剂,可以使反应的△H减小6. 混合动力汽车(HEV)中使用了镍氢电池,其工作原理如图所示:其中M为储氢合金,MH为吸附了氢原子的储氢合金,KOH溶液作电解液.关于镍氢电池,下列说法不正确的是( )
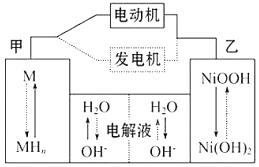 A、充电时,阴极附近pH降低 B、电动机工作时溶液中OH﹣向甲移动 C、放电时正极反应式为:NiOOH+H2O+e﹣═Ni(OH)2+OH﹣ D、电极总反应式为:MH+NiOOH M+Ni(OH)27. 已知常温下0.1mol/L NaHSO3溶液pH<7,将10mL 0.1mol/LBa(OH)2溶液缓慢滴加到10mL 0.1mol/L NaHSO3溶液中,下列说法不正确的是( )A、常温下0.1 mol/L NaHSO3溶液中HSO3﹣电离程度大于水解程度 B、当加入的Ba(OH)2溶液体积小于5 mL时,溶液中的反应为:2HSO3﹣+Ba2++2OH﹣⇌BaSO3↓+2H2O+SO32﹣ C、滴加过程中,溶液中白色沉淀不断增加 D、当加入Ba(OH)2溶液体积为7.5 mL时,溶液中离子浓度大小为:c(Na+)>c(SO32﹣)>c(OH﹣)>c(H+)
A、充电时,阴极附近pH降低 B、电动机工作时溶液中OH﹣向甲移动 C、放电时正极反应式为:NiOOH+H2O+e﹣═Ni(OH)2+OH﹣ D、电极总反应式为:MH+NiOOH M+Ni(OH)27. 已知常温下0.1mol/L NaHSO3溶液pH<7,将10mL 0.1mol/LBa(OH)2溶液缓慢滴加到10mL 0.1mol/L NaHSO3溶液中,下列说法不正确的是( )A、常温下0.1 mol/L NaHSO3溶液中HSO3﹣电离程度大于水解程度 B、当加入的Ba(OH)2溶液体积小于5 mL时,溶液中的反应为:2HSO3﹣+Ba2++2OH﹣⇌BaSO3↓+2H2O+SO32﹣ C、滴加过程中,溶液中白色沉淀不断增加 D、当加入Ba(OH)2溶液体积为7.5 mL时,溶液中离子浓度大小为:c(Na+)>c(SO32﹣)>c(OH﹣)>c(H+)二、非选择题
-
8. 槟榔碱在医疗上常用于治疗青光眼,其一种合成路线如图:
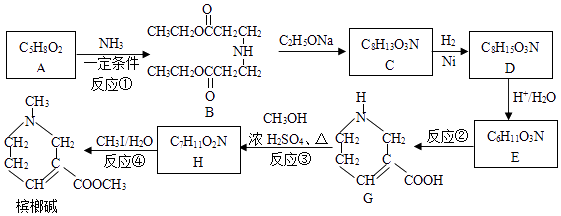
已知:Ⅰ.不饱和化合物与氨(NH3)或胺(R﹣NH2)反应能生成新的胺类化合物
如:R1﹣CH=CH2+R2﹣NH2 R1﹣CH2﹣CH2﹣NH﹣R2
Ⅱ.
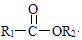 +R3
+R3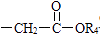
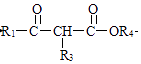 +R2OH(1)、B中含氧官能团的名称为 .(2)、反应①的反应类型为;反应②的反应条件为 .(3)、反应③的化学方程式为 .(4)、C的结构简式为 .(5)、下列说法正确的是(填字母).
+R2OH(1)、B中含氧官能团的名称为 .(2)、反应①的反应类型为;反应②的反应条件为 .(3)、反应③的化学方程式为 .(4)、C的结构简式为 .(5)、下列说法正确的是(填字母).a.反应④为取代反应
b.槟榔碱与化合物G互为同系物
c.1mol D最多能与2mol NaOH发生反应
(6)、已知A在NaOH溶液中水解的产物之一是一种新型功能高分子材料(PAANa)的单体,写出生成PAANa的化学方程式 .(7)、已知:CH2=CHCH3+Cl2 CH2=CHCH2Cl+HCl,以丙烯和乙醇为起始原料,选用必要的无机试剂合成A,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件) .9. 饮用水中含有砷会导致砷中毒,水体中溶解的砷主要以As(Ⅲ)亚砷酸盐和As(Ⅴ)砷酸盐形式存在.(1)、砷与磷为同一主族元素,磷的原子结构示意图为 .(2)、根据元素周期律,下列说法正确的是 .a.酸性:H2SO4>H3PO4>H3AsO4
b.原子半径:S>P>As
c.非金属性:S>P>As
(3)、关于地下水中砷的来源有多种假设,其中一种认为是富含砷的黄铁矿(FeS2)被氧化为Fe(OH)3 , 同时生成SO42﹣ , 导致砷脱离矿体进入地下水.FeS2被O2氧化的离子方程式为 .(4)、去除水体中的砷,可先将As(Ⅲ)转化为As(Ⅴ),选用NaClO可实现该转化.研究NaClO投加量对As(Ⅲ)氧化率的影响得到如下结果: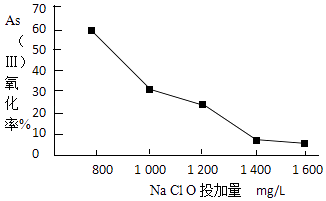
已知:投料前水样pH=5.81,0.1mol/LNaClO溶液pH=10.5,溶液中起氧化作用的物质是次氯酸.产生此结果的原因是 .
(5)、强阴离子交换柱可以吸附以阴离子形态存在的As(Ⅴ)达到去除As的目的.已知:一定条件下,As(Ⅴ)的存在形式如表所示:
pH
<2
2~7
7~11
11~14
存在形式
H3AsO4
H2AsO3﹣
HAsO42﹣
HAsO42﹣、AsO43﹣
pH=6时,NaClO氧化亚砷酸(H3AsO3)的离子方程式是 .
10. 粉煤灰(主要含有SiO2、Fe2O3、Al2O3等)是燃煤发电过程中产生的废渣,粉煤灰的综合利用具有很大的价值.Ⅰ.研究人员通过实验对粉煤灰中铝和铁元素的分离工艺进行了研究.
(1)、以硫酸溶液分解粉煤灰,使其中的铝、铁元素溶出,过滤实现初步分离.①写出硫酸溶液与Fe2O3反应的离子方程式 .
②初步分离得到的滤渣主要成分是 .
(2)、向(1)分离所得的滤液中加入还原剂使Fe3+转化为Fe2+ , 结合表分析其原因 .物质
Fe(OH)2
Fe(OH)3
Al(OH)3
沉淀区间(pH)
7.06~8.95
1.94~3.20
3.69~4.8
(3)、使用碱性较弱的氨水为pH调节剂,进行分离实验.①氨水使滤液中铝离子沉淀的离子方程式为 .
②反应终点的pH对铝和铁分离效果的影响如图1.根据实验结果,为达到好的分离效果,反应过程中控制pH的范围是 , 选择该范围的理由是 .
(4)、Ⅱ.NH4HSO4和H2SO4按物质的量比1:1混合配制成浸取液,220℃时,可将高铝粉煤灰中Al2O3转化为硫酸铝铵[NH4Al(SO4)2],然后分离、煅烧获得纯Al2O3 .已知硫酸铝铵:①溶解度:0℃时,S=5.2g;100℃时,S=421.9g.
②280℃时分解.
1)依据资料可知,将硫酸铝铵与其他溶质分离的方法是 .
2)煅烧NH4Al(SO4)2同时得到混合气体(NH3、N2、SO2、SO3、H2O).若16mol混合气体按图2装置被完全吸收制得浸取液,请将图2中试剂及其物质的量补充完整 .
11. 某研究小组为探究饱和NaHCO3溶液中是否还能溶解少量NaHCO3固体,设计并完成了下列实验.实验
编号
实验操作
现象或结论
①
测饱和NaHCO3溶液的pH
pH为8.3
②
向2mL Na2CO3溶液中加入MgCl2溶液
有白色沉淀生成
③
向2mL饱和NaHCO3溶液中加入MgCl2溶液
无明显现象
④
向20mL 饱和NaHCO3溶液中加入少量的NaHCO3固体,静置24小时
溶液中微小的气体缓慢地从底部固体逸出,最终固体全部溶解
已知常温下:Ksp(CaCO3)=4.96×10﹣9 , Ksp(MgCO3)=6.82×10﹣6
碳酸的电离常数:H2CO3⇌HCO3﹣+H+ K1=4.3×10﹣7
HCO3﹣⇌CO32﹣+H+ K2=5.6×10﹣12
Mg(OH)2沉淀范围:pH 9.4~12.4
(1)、用化学用语解释饱和NaHCO3溶液pH为8.3的原因: .(2)、实验③中若用CaCl2溶液代替MgCl2溶液完成实验,会观察到白色沉淀.现象不同的原因是 .(3)、为探究NaHCO3固体溶解的原理,取实验④反应后的溶液,检验其产物.Ⅰ.收集反应产生的气体,发现气体能使澄清的石灰水变浑浊.
Ⅱ.测得反应后烧杯中溶液的pH为8.7.
Ⅲ.向反应后的溶液中滴加MgCl2溶液,有白色沉淀生成.
①步骤Ⅲ中白色沉淀是 .
②结合化学用语解释饱和NaHCO3溶液中固体溶解的原因 .
③固体全部溶解后溶液pH升高的原因是 .
(4)、实验③的目的是 .(5)、根据上述实验得出的结论是 .