2017年北京市房山区高考化学二模试卷
试卷更新日期:2017-08-01 类型:高考模拟
一、选择题
-
1. 化学在古代与现代的科技发展中起了十分重要的作用,下列说法中正确的是( )



古代与现代的冶金均运用了相同的化学原理
古代与现代的火箭发射均利用了液体燃料
古代捣碎中药与现代中药纳米粉碎均是化学变化
古代风筝与现代热气球飞行均无需物质直接供给能量
A、A B、B C、C D、D2. 下列说法正确的是( )A、苯酚与苯甲醇互为同系物 B、利用碘酒解毒与酒精消毒均运用了蛋白质变性的性质 C、蔗糖与纤维素都是由C、H、O组成的高分子化合物 D、1mol油脂在酸性条件下充分水解,可制得3mol高级脂肪酸和1mol甘油3. 在下列离子组中加入相应试剂后,发生反应的离子方程式正确的是( )离子组
加入试剂
离子方程式
A
Al3+、SO42﹣
适量Ba(OH)2溶液
Al3++3OH﹣═Al(OH)3↓
B
Fe2+、I﹣
足量新制氯水
Cl2+2I﹣═2Cl﹣+I2
C
Fe3+、NO3﹣
NaHSO3溶液
3SO32﹣+2NO3﹣+2H+═3SO42﹣+2NO↑+H2O
D
Ca2+、HCO3﹣
氨水
Ca2++2HCO3﹣+2NH3•H2O═CaCO3↓+CO32﹣+2NH4++2H2O
A、A B、B C、C D、D4. 研究金属桥墩腐蚀及防护是跨海建桥的重要课题.下列有关判断中正确的是( )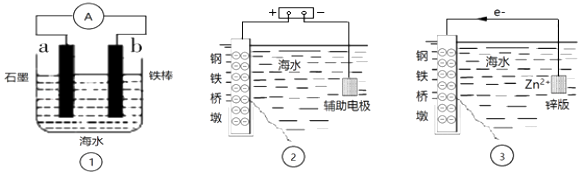 A、用装置①模拟研究时未见a上有气泡,说明铁没有被腐蚀 B、②中桥墩与外加电源正极连接能确保桥墩不被腐蚀 C、③中采用了牺牲阳极的阴极保护法保护桥墩 D、①②③中海水均是实现化学能与电能相互转化的电解质5. 用如图所示装置进行以下实验,能达到实验目的是( )
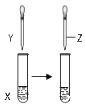
A、用装置①模拟研究时未见a上有气泡,说明铁没有被腐蚀 B、②中桥墩与外加电源正极连接能确保桥墩不被腐蚀 C、③中采用了牺牲阳极的阴极保护法保护桥墩 D、①②③中海水均是实现化学能与电能相互转化的电解质5. 用如图所示装置进行以下实验,能达到实验目的是( )X
Y
Z
目的
装置
A
甲苯
KMnO4溶液
稀硫酸
证明甲基对苯环的性质存在影响
B
FeCl3溶液
KSCN溶液
饱和KCl溶液
证明增大反应物浓度化学平衡向正反应方向移动
C
1mol/LNaOH
溶液5mL
1﹣氯丁烷5mL
2%AgNO3
溶液1mL
证明1﹣氯丁烷中含有氯元素
D
0.1mol/LNaCl
溶液2mL
0.1mol/LAgNO3溶液1mL
0.1mol/LNa2S
溶液1mL
证明AgCl大于Ag2S的溶解度
A、A B、B C、C D、D6. 已知:用Pt﹣Rh合金催化氧化NH3制NO,其反应的微观模型及含氮生成物产率随反应温度的变化曲线分别如图①、图②所示:下列说法中,不正确的是( )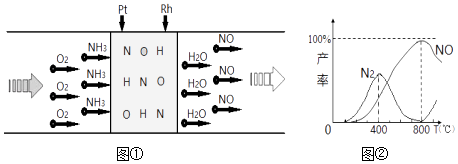 A、400℃时,生成的产物有N2、NO、H2O B、800℃时,反应的化学方程式是:4NH3+5O2 4NO+6H2O C、400℃﹣800℃间,Pt﹣Rh合金对N2的吸附力逐渐减弱 D、800℃以上,发生了反应:2NO(g)⇌O2(g)+N2(g)△H>07. 分别在相同物质的量浓度、相同体积的H2SO3、NaHSO3、Na2SO3三种溶液中,滴加同一新制氯水.其导电能力随氯水体积变化的曲线如图所示(不考虑空气的影响).下列分析正确的是( )
A、400℃时,生成的产物有N2、NO、H2O B、800℃时,反应的化学方程式是:4NH3+5O2 4NO+6H2O C、400℃﹣800℃间,Pt﹣Rh合金对N2的吸附力逐渐减弱 D、800℃以上,发生了反应:2NO(g)⇌O2(g)+N2(g)△H>07. 分别在相同物质的量浓度、相同体积的H2SO3、NaHSO3、Na2SO3三种溶液中,滴加同一新制氯水.其导电能力随氯水体积变化的曲线如图所示(不考虑空气的影响).下列分析正确的是( )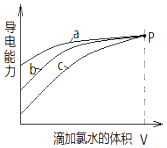 A、曲线a代表H2SO3溶液 B、曲线b代表的溶液中:c(Na+)═c(H2SO3)+c(HSO3﹣)+c(SO32﹣)+c(SO42﹣) C、曲线a、b、c代表的溶液中均始终保持:2c(Cl﹣)=c(SO42﹣) D、当滴加氯水体积均为V时,三种溶液的导电能力基本相同,c(H+)也相同
A、曲线a代表H2SO3溶液 B、曲线b代表的溶液中:c(Na+)═c(H2SO3)+c(HSO3﹣)+c(SO32﹣)+c(SO42﹣) C、曲线a、b、c代表的溶液中均始终保持:2c(Cl﹣)=c(SO42﹣) D、当滴加氯水体积均为V时,三种溶液的导电能力基本相同,c(H+)也相同二、非选择题
-
8. “张﹣烯炔环异构化反应”,可高效构筑五元环状化合物:

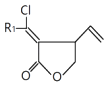 (R1代表氢原子或烃基)
(R1代表氢原子或烃基) 某五元环状化合物的合成路线如图:
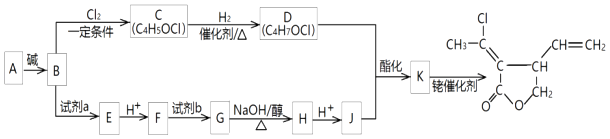
已知:
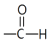 +
+ 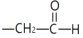
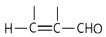 +H2O(1)、A中所含官能团名称是;B→C的反应类型是 .(2)、A→B的化学方程式是 .(3)、D的结构简式是 .(4)、下列叙述中正确的是 .
+H2O(1)、A中所含官能团名称是;B→C的反应类型是 .(2)、A→B的化学方程式是 .(3)、D的结构简式是 .(4)、下列叙述中正确的是 .①B能使酸性KMnO4和Br2的四氯化碳溶液均褪色
②试剂a一定是银氨溶液
③J、A的核磁共振氢谱峰面积之比均为3:1
(5)、与F具有相同官能团的同分异构体(不含顺反异构)的结构简式有 .(6)、试剂b为Cl2 , G→H反应的化学方程式是 .(7)、D与J反应形成K的化学方程式是 .9. 资料显示,可用次氯酸钠处理废水中的氨氮(NH3),使其转化为氮气除去,其主要反应如下:①NH3(aq)+HClO(aq)═NH2Cl(aq)+H2O(l)
②2NH2Cl(aq)+HClO(aq)═N2(g)+H2O(l)+3HCl(aq)
(1)、在其他条件不变的情况下,向一定量废水中逐滴滴加次氯酸钠溶液,氨氮去除率随 的变化曲线如图1:
Ⅰ.物质NH2Cl中氮元素的化合价是 .
Ⅱ.a﹣b点间,溶液中氨氮去除率迅速提高的原因是 .
(2)、Ⅰ.反应①②中HClO 的来源用化学用语解释是 .Ⅱ.实验测得,废水中pH与氨氮去除率如图2所示:
pH较高时,氨氮去除率下降的原因是 .
pH较低时,氨氮去除率也下降,可能的原因是 .
(3)、运用上述原理去除废水中的氨氮,可结合图3所示的电解法.Ⅰ.a极为 .
Ⅱ.d极反应式为 .
10. 黄铁矿(主要成分FeS2)、黄铜矿(主要成分CuFeS2)均是自然界中的常见矿物资源. (1)、黄铁矿在空气中易被氧化,其反应历程可能为如图1所示的四步:
(1)、黄铁矿在空气中易被氧化,其反应历程可能为如图1所示的四步:①a反应中每生成1molFeSO4转移电子的物质的量为 mol.
②d反应的离子方程式为 .
(2)、用黄铜矿常温细菌冶铜和高温火法冶铜的流程如图2所示:①细菌冶铜时,当黄铜矿中伴有黄铁矿可明显提高Cu2+的浸出速率,
其原理如图3所示:
Ⅰ.冶炼过程中,FeS2周边溶液的pH(填“增大”、“减小”或“不变”).
Ⅱ.从CuFeS2析出S的反应式是 .
②火法冶铜时,由Cu2S制得铜的化学方程式是 .
(3)、煤炭中的硫主要以黄铁矿形式存在,用氢气脱除黄铁矿中硫的相关反应(见表),其相关反应的平衡常数与温度的关系如图4.相关反应
反应热
平衡常数
FeS2(s)+H2(g)⇌FeS(s)+H2S(g)
△H1
K1
FeS2(s)+H2(g)⇌ Fe(s)+H2S(g)
△H2
K2
FeS(s)+H2(g)⇌Fe(s)+H2S(g)
△H3
K3
①上述反应中,△H10(填“>”或“<”).
②提高硫的脱除率可采取的措施有(举1例).
11. 某化学小组在研究Na2SO3溶液、FeCl3溶液性质及反应时,进行了下列实验:(1)、取1mol•L﹣1的Na2SO3溶液置于空气中,测得其pH随时间的变化曲线如图所示: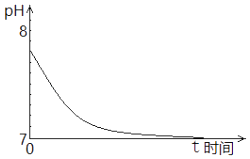
①最初,Na2SO3溶液pH=7.8,解释其原因的离子方程式是 .
②t时间段内,造成其pH发生上述变化,用离子方程式解释是 .
(2)、探究Na2SO3溶液与FeCl3溶液实际反应的情况:实验ⅰ
装置
操作
现象
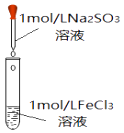
向2mL1mol•L﹣1FeCl3溶液中,逐滴滴加1mo•L﹣1Na2SO3溶液2mL
溶液黄色逐渐加深,最终得红褐色溶液(W)
实验ⅱ
装置
操作
现象
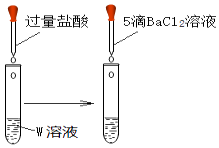
取1mL溶液W于试管中,向其滴加过量盐酸,再滴加5滴BaCl2溶液
产生白色沉淀
①实验ⅱ证明,溶液中含有离子;
②对Na2SO3溶液与FeCl3溶液实际反应存在两种认识:
认识Ⅰ.反应中Fe3+完全转化为Fe2+ , W溶液中c(Fe2+)一定很大,反应的离子方程式是 .
认识Ⅱ.W溶液中c(Fe2+)应该极小,否则W溶液不会呈红褐色.
(3)、资料显示:Fe2+呈淡绿色、FeSO3是墨绿色沉淀、碱式硫酸铁[Fe4(OH)2(SO4)5]溶液为红褐色.①实验中始终未出现墨绿色沉淀,说明c(Fe2+)极小,其原因用离子方程式解释是 .
②实验过程和结果显示,O2、Fe3+、SO42﹣的氧化性强弱顺序是 .
③若Fe4(OH)2(SO4)5是造成溶液W呈红褐色的原因之一,其形成的化学方程式是 .
④用激光笔照射W溶液,发现有丁达尔现象,用离子方程式解释原因是 .