2017年北京市朝阳区高考化学二模试卷
试卷更新日期:2017-08-01 类型:高考模拟
一、选择题
-
1. 下列以高粱为主要原料的酿醋工艺中,利用醋酸溶解性的是( )
A.
B.
C.
D.



蒸拌原料
淀粉发酵
用水浸淋
放置陈酿
A、A B、B C、C D、D2. 《电石安全技术说明书》中对电石的描述为“…遇水或湿气能迅速产生高度易燃的乙炔气体,应与氧化剂类物质分开存放…”.下列说法不合理的是( ) A、盛装电石的包装上贴有的危险化学品标志为: B、电石与硝酸分开存放 C、运输电石的铁桶内可充入氮气 D、电石着火可用泡沫灭火器扑灭3. 下列说法正确的是( )A、NaOH溶液的导电能力一定比氨水强 B、中和等体积、等物质的量浓度的盐酸和醋酸,需要等量的NaOH C、若盐酸的浓度是醋酸浓度的两倍,则盐酸的c(H+)也是醋酸c(H+)的两倍 D、将NaOH溶液和氨水各稀释一倍,两者的c(OH﹣)均减小到原来的一半4. 某同学利用如图装置探究SO2的性质.
A、盛装电石的包装上贴有的危险化学品标志为: B、电石与硝酸分开存放 C、运输电石的铁桶内可充入氮气 D、电石着火可用泡沫灭火器扑灭3. 下列说法正确的是( )A、NaOH溶液的导电能力一定比氨水强 B、中和等体积、等物质的量浓度的盐酸和醋酸,需要等量的NaOH C、若盐酸的浓度是醋酸浓度的两倍,则盐酸的c(H+)也是醋酸c(H+)的两倍 D、将NaOH溶液和氨水各稀释一倍,两者的c(OH﹣)均减小到原来的一半4. 某同学利用如图装置探究SO2的性质.
下列有关反应的方程式,不正确的是( )
A、①中溶液显红色的原因:CO32﹣+H2O⇌HCO3﹣+OH﹣ B、①中溶液红色褪去的原因:2SO2+CO32﹣+H2O═CO2+2HSO3﹣ C、②中溶液显黄绿色的原因:Cl2+H2O═HCl+HClO D、②中溶液黄绿色褪去的原因:SO2+Cl2+2H2O═H2SO4+2HCl5. 下列实验方案能达到实验目的是( )选项
目的
实验方案
A.
比较Mg、Al的金属性
将去除氧化膜的镁条、铝片分别放入沸水中
B.
鉴别MgCl2和 AlCl3溶液
将过量稀氨水分别滴入MgCl2和 AlCl3溶液中
C.
证明苯环对羟基活性的影响
分别向苯和苯酚溶液中滴加饱和溴水
D.
比较浓度对反应速率的影响
将不同浓度的KMnO4溶液、稀H2SO4与同浓度的H2C2O4溶液混合
A、A B、B C、C D、D6. NH3催化还原NO是重要的烟气脱硝技术,其反应过程与能量关系如左图;研究发现在以Fe2O3为主的催化剂上可能发生的反应过程如右图.下列说法正确的是( ) A、NH3催化还原NO为吸热反应 B、过程Ⅰ中NH3断裂非极性键 C、过程Ⅱ中NO为氧化剂,Fe2+为还原剂 D、脱硝的总反应为:4NH3(g)+4NO(g)+O2(g) 4N2(g)+6H2O(g)7. 汽车发动机中生成NO的反应为:N2(g)+O2(g)⇌2NO(g),t℃时,K=0.09.在t℃下甲、乙、丙三个恒容密闭容器中,投入N2(g)和 O2(g)模拟反应,起始浓度如表所示.下列判断不正确的是( )
A、NH3催化还原NO为吸热反应 B、过程Ⅰ中NH3断裂非极性键 C、过程Ⅱ中NO为氧化剂,Fe2+为还原剂 D、脱硝的总反应为:4NH3(g)+4NO(g)+O2(g) 4N2(g)+6H2O(g)7. 汽车发动机中生成NO的反应为:N2(g)+O2(g)⇌2NO(g),t℃时,K=0.09.在t℃下甲、乙、丙三个恒容密闭容器中,投入N2(g)和 O2(g)模拟反应,起始浓度如表所示.下列判断不正确的是( )起始浓度
甲
乙
丙
c(N2)/mol•L﹣1
0.46
0.46
0.92
c(O2)/mol•L﹣1
0.46
0.23
0.92
A、起始时,反应速率:丙>甲>乙 B、平衡时,c(NO):甲=丙>乙 C、平衡时,N2的转化率:甲>乙 D、平衡时,甲中c(N2)=0.4 mol•L﹣1二、非选择题
-
8. 环扁桃酯是用于治疗心脑血管疾病的重要化合物,它的一种合成路线如图.
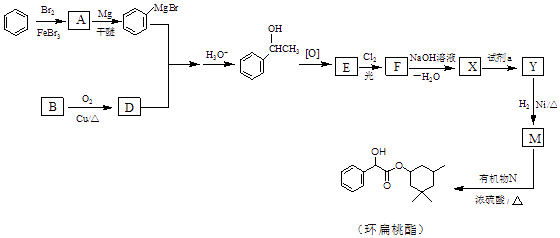
已知:
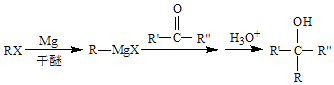 (R、R′、R″代表烃基或氢)(1)、A的结构简式是 .(2)、B→D的化学方程式是 .(3)、红外吸收光谱表明E有C=O键.F的分子式为C8H6Cl2O.
(R、R′、R″代表烃基或氢)(1)、A的结构简式是 .(2)、B→D的化学方程式是 .(3)、红外吸收光谱表明E有C=O键.F的分子式为C8H6Cl2O.①E的结构简式是 .
②E→F的反应类型是 .
(4)、X的结构简式是 .(5)、试剂a是 .(6)、生成环扁桃酯的化学方程式是 .(7)、以CH3CH=CH2、CH3CHO为有机原料,结合题目所给信息,选用必要的无机试剂合成CH2=CHCH=CHCH3 , 写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件).9. 工业上由N2、H2合成NH3 . 制备H2需经多步完成,其中“水煤气(CO、H2)变换”是纯化H2的关键一步.(1)、水煤气变换:CO(g)+H2O(g)⇌CO2(g)+H2(g),平衡常数K随温度变化如表:温度/℃
200
300
400
K
290
39
11.7
①下列分析正确的是 .
a.水煤气变换反应的△H<0
b.增大压强,可以提高CO的平衡转化率
c.增大水蒸气浓度,可以同时增大CO的平衡转化率和反应速率
②以氨水为吸收剂脱除CO2 . 当其失去吸收能力时,通过加热使吸收剂再生.用化学方程式表示“吸收”、“再生”两个过程: .
(2)、Fe3O4是水煤气变换反应的常用催化剂,经CO、H2还原Fe2O3制备.两次实验结果如表:实验Ⅰ
实验Ⅱ
通入气体
CO、H2
CO、H2、H2O(g)
固体产物
Fe3O4、Fe
Fe3O4
结合化学方程式解释H2O(g)的作用: .
(3)、2016年我国某科研团队利用透氧膜,一步即获得N2、H2 , 工作原理如图所示.(空气中N2与O2的物质的量之比按4:1计)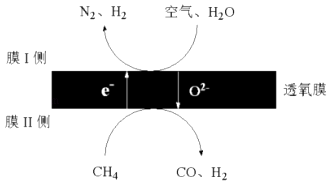
①起还原作用的物质是 .
②膜Ⅰ侧发生的电极反应式是 .
③膜Ⅰ侧所得气体 =3,CH4、H2O、O2反应的化学方程式是 .
10. Li﹣CuO二次电池的比能量高、工作温度宽,性能优异,广泛应用于军事和空间领域.(1)、Li﹣CuO电池中,金属锂做极.(2)、比能量是指消耗单位质量的电极所释放的电量,用来衡量电池的优劣.比较Li、Na、Al分别作为电极时比能量的大小: .(3)、通过如下过程制备CuOCu CuSO4溶液 Cu2(OH)2CO3沉淀 CuO
①过程Ⅰ,H2O2的作用是 .
②过程Ⅱ产生Cu2(OH)2CO3的离子方程式是 .
③过程Ⅱ,将CuSO4溶液加到Na2CO3溶液中,研究二者不同物质的量之比与产品纯度的关系(用测定铜元素的百分含量来表征产品的纯度),结果如下:
已知:Cu2(OH)2CO3中铜元素的百分含量为57.7%.
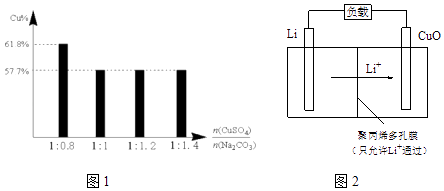
二者比值为1:0.8时,产品中可能含有的杂质是 , 产生该杂质的原因是 .
④过程Ⅲ反应的化学方程式是 .
(4)、Li﹣CuO二次电池以含Li+的有机溶液为电解质溶液,其工作原理示意如图2.放电时,正极的电极反应式是 .11. 某研究性学习小组查阅资料收集到如下信息:铁盐能蚀刻银而用来制作液晶显示器的银线路板.他们对蚀刻银的过程进行了探究.【实验1】制备银镜:
(1)、ⅰ.配制银氨溶液,需要的试剂是 . 并取等量银氨溶液于多支试管中.ⅱ.向银氨溶液中加入等量的葡萄糖溶液,水浴加热.产生银镜,洗净,备用.
【实验2】溶解银镜:分别向两支试管中加入5mL Fe(NO3)3、Fe2(SO4)3溶液.
编号
a
b
试剂
0.1mol/L Fe(NO3)3
0.05mol/L Fe2(SO4)3
现象
银镜消失较快;
溶液黄色略变浅;
产生少许白色沉淀
银镜消失较慢;
溶液黄色明显变浅;
产生较多白色沉淀
(2)、选用Fe2(SO4)3溶液的浓度为0.05mol/L,目的是保证相等.(3)、从a、b中均检出了Fe2+ , 说明Fe3+具有氧化性.a中Fe3+氧化Ag的离子方程式是 .(4)、确认b中沉淀为Ag2SO4(微溶),检验Ag2SO4固体中SO42﹣的方法是 .(5)、推测在a中的酸性条件下NO3﹣氧化了银,证据是 . 通过如下实验验证了推测是合理的:ⅰ.测pH:测定实验a中所用Fe(NO3)3溶液的pH=2;
ⅱ.配制溶液: . 取5mL此溶液加入有银镜的试管,现象是 .
请将步骤ⅱ补充完整.
(6)、分析a中白色沉淀的成分,提出假设.假设1:Fe(OH)2;假设2:AgNO2;假设3:…
①设计实验方案验证假设1:取少量沉淀置于空气中,未变色.假设1不成立.
②设计实验方案验证假设2(已知:亚硝酸盐能与酸化的KI溶液反应).
实验方案
预期现象和结论
【实验结论与讨论】铁盐能蚀刻银;NO3﹣能提高铁盐的蚀刻能力.推测硝酸铁溶液如果保持足够的酸性,可以避免产生沉淀.