2017年山东省潍坊市高密市中考化学二模试卷
试卷更新日期:2017-08-01 类型:中考模拟
一、选择题
-
1. 物质世界每时每刻都在发生着变化,下列变化属于化学变化的是( )
①电灯通电发光②煤制成焦炭③塑料老化④干冰升华⑤石油分馏⑥海水制镁⑦石块粉碎成石子⑧粮食酿酒.
A、①③④⑧ B、②⑤⑥⑧ C、②③⑥⑧ D、①④⑥⑦2. 如图所示的实验操作中,正确的是( )A、 制备和检验氢气的可燃性
B、
制备和检验氢气的可燃性
B、 向试管中倾倒液体试剂
C、
向试管中倾倒液体试剂
C、 蒸发食盐水
D、
蒸发食盐水
D、 测定溶液的pH
3. 厨房中的下列物质放入足量的水中,充分搅拌,能形成溶液的是( )A、面粉 B、食盐 C、冰块 D、花生油4. 我国自主研制的首艘货运飞船“天舟一号”已于2017年4月20日发射成功,并与天宫二号空间实验室完成交会对接.本次使用的是长征七号遥二运载火箭,火箭采用了液氧煤油发动机等新技术.下列说法不正确的是( )A、液氧是助燃剂 B、煤油是燃料 C、液氧是混合物 D、煤油是有机物5. 氨气是工业制硝酸的重要原料.氨气(NH3)中氮元素的化合价为( )A、﹣3 B、+3 C、+4 D、+56. “生活离不开化学”,下列叙述合理的是( )A、食用加碘盐可以预防大脖子病,所以应尽量多吃 B、煤、石油、天然气都是不可再生能源 C、用甲醛溶液浸泡鱿鱼,以保质保鲜 D、有人称自己有特异功能,能“化水为油”7. 下列叙述正确的是( )A、纯净物只含一种元素 B、凡是有氧元素参与的反应就是氧化反应 C、任何饱和溶液升高温度均能变为不饱和溶液 D、催化剂在化学反应前后质量和化学性质都不会改变8. 用如图所示装置来测定空气中氧气的含量,对该实验认识错误的是( )
测定溶液的pH
3. 厨房中的下列物质放入足量的水中,充分搅拌,能形成溶液的是( )A、面粉 B、食盐 C、冰块 D、花生油4. 我国自主研制的首艘货运飞船“天舟一号”已于2017年4月20日发射成功,并与天宫二号空间实验室完成交会对接.本次使用的是长征七号遥二运载火箭,火箭采用了液氧煤油发动机等新技术.下列说法不正确的是( )A、液氧是助燃剂 B、煤油是燃料 C、液氧是混合物 D、煤油是有机物5. 氨气是工业制硝酸的重要原料.氨气(NH3)中氮元素的化合价为( )A、﹣3 B、+3 C、+4 D、+56. “生活离不开化学”,下列叙述合理的是( )A、食用加碘盐可以预防大脖子病,所以应尽量多吃 B、煤、石油、天然气都是不可再生能源 C、用甲醛溶液浸泡鱿鱼,以保质保鲜 D、有人称自己有特异功能,能“化水为油”7. 下列叙述正确的是( )A、纯净物只含一种元素 B、凡是有氧元素参与的反应就是氧化反应 C、任何饱和溶液升高温度均能变为不饱和溶液 D、催化剂在化学反应前后质量和化学性质都不会改变8. 用如图所示装置来测定空气中氧气的含量,对该实验认识错误的是( ) A、铜粉用量的多少,不会影响实验结果 B、实验结束后冷却到室温才能读数 C、气球的作用是调节气压,使氧气完成反应 D、在正常操作情况下,反应结束后消耗氧气的总体积应该是反应前注射器内气体体积的五分之一9. 下列化学用语表示正确的是( )A、氯化钡的化学式:BaCl B、4个氖原子:4Ne C、钠离子: D、硫酸铁:FeSO410. 依据所给食物的近似pH判断,下列说法正确的是( )
A、铜粉用量的多少,不会影响实验结果 B、实验结束后冷却到室温才能读数 C、气球的作用是调节气压,使氧气完成反应 D、在正常操作情况下,反应结束后消耗氧气的总体积应该是反应前注射器内气体体积的五分之一9. 下列化学用语表示正确的是( )A、氯化钡的化学式:BaCl B、4个氖原子:4Ne C、钠离子: D、硫酸铁:FeSO410. 依据所给食物的近似pH判断,下列说法正确的是( )食物
白葡萄汁
苹果
牛奶
玉米粥
pH
3.5﹣4.5
2.9﹣3.3
6.3﹣6.6
6.8﹣8.0
A、苹果汁和葡萄汁显酸性 B、葡萄汁的酸性比苹果汁强 C、玉米粥和牛奶显碱性 D、胃酸过多的人不宜常喝玉米粥二、选择题
-
11. 食醋是厨房中常用的调味品,它的主要成分是乙酸,乙酸分子的模型如图所示,其中
 代表一个碳原子,
代表一个碳原子,  代表一个氢原子,
代表一个氢原子,  代表一个氧原子.下列说法不正确的是( )
代表一个氧原子.下列说法不正确的是( )  A、乙酸是一种化合物 B、乙酸的相对分子质量为60 C、乙酸中碳元素的质量分数为60% D、乙酸分子中的碳原子、氢原子、氧原子的个数比为1:2:112. 逻辑推理是一种重要的化学思维方法.以下推理正确的是( )A、酸碱中和反应有水生成,有水生成的反应一定是酸碱中和反应 B、NaCl溶液能够导电,则所有溶液都能导电 C、化学变化中分子种类发生改变,分子种类发生改变的变化一定是化学变化 D、酸溶液能使紫色石蕊试液变红,能使紫色石蕊试液变红的一定是酸溶液13. 如图是甲、乙、丙三种物质的溶解度曲线,下列叙述正确的是( )
A、乙酸是一种化合物 B、乙酸的相对分子质量为60 C、乙酸中碳元素的质量分数为60% D、乙酸分子中的碳原子、氢原子、氧原子的个数比为1:2:112. 逻辑推理是一种重要的化学思维方法.以下推理正确的是( )A、酸碱中和反应有水生成,有水生成的反应一定是酸碱中和反应 B、NaCl溶液能够导电,则所有溶液都能导电 C、化学变化中分子种类发生改变,分子种类发生改变的变化一定是化学变化 D、酸溶液能使紫色石蕊试液变红,能使紫色石蕊试液变红的一定是酸溶液13. 如图是甲、乙、丙三种物质的溶解度曲线,下列叙述正确的是( ) A、t1℃时,等质量的甲、丙溶液中所含溶质的质量分数为丙>甲 B、t2℃时,20g丙溶解于50g水中能形成70g溶液 C、分别将三种物质的饱和溶液从t3℃降温至t2℃时,所得溶液溶质质量分数的大小关系为乙>甲=丙 D、若要将组成在N点的甲溶液转变为M点的甲溶液,可采取恒温蒸发溶剂的方法14. 汽车尾气净化装置中装有铂催化剂,尾气在催化剂表面反应的微观过程可用如图表示.下列有关说法正确的是( )
A、t1℃时,等质量的甲、丙溶液中所含溶质的质量分数为丙>甲 B、t2℃时,20g丙溶解于50g水中能形成70g溶液 C、分别将三种物质的饱和溶液从t3℃降温至t2℃时,所得溶液溶质质量分数的大小关系为乙>甲=丙 D、若要将组成在N点的甲溶液转变为M点的甲溶液,可采取恒温蒸发溶剂的方法14. 汽车尾气净化装置中装有铂催化剂,尾气在催化剂表面反应的微观过程可用如图表示.下列有关说法正确的是( ) A、反应I中的反应物分子有三种 B、反应Il属于置换反应 C、反应Il中参加反应的二氧化氮与一氧化碳的分子个数比为2:1 D、此净化装置可以消除一氧化碳、一氧化氮、二氧化氮对空气的污染15. 一定温度下,在Ca(OH)2饱和溶液中加入下列物质,溶液的pH没有明显变化的是( )A、CO2 B、CaO C、CuSO4 D、HCl16. 在一密闭容器中加入甲、乙、丙、丁四种物质,在一定条件下发生化学反应,测得反应前及t1、t2时各物质质量变化情况如图所示,下列说法错误的是( )
A、反应I中的反应物分子有三种 B、反应Il属于置换反应 C、反应Il中参加反应的二氧化氮与一氧化碳的分子个数比为2:1 D、此净化装置可以消除一氧化碳、一氧化氮、二氧化氮对空气的污染15. 一定温度下,在Ca(OH)2饱和溶液中加入下列物质,溶液的pH没有明显变化的是( )A、CO2 B、CaO C、CuSO4 D、HCl16. 在一密闭容器中加入甲、乙、丙、丁四种物质,在一定条件下发生化学反应,测得反应前及t1、t2时各物质质量变化情况如图所示,下列说法错误的是( )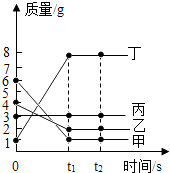 A、该物质为化合反应 B、丙可能是该反应的催化剂 C、该化学反应中甲、丁的质量变化之比为5:7 D、该化学反应中乙、丁的质量变化之比为1:417. 向AgNO3溶液中加入一定质量的Fe和Al的混合粉末,充分反应后过滤,得到滤渣和浅绿色滤液.下列说法正确的是( )A、滤液中一定含有Al3+、Ag+ B、滤液中一定含有Fe2+、Ag+ C、滤渣中一定含有Ag D、滤渣中一定含有Fe18. 下列除去杂质的方法错误的是( )
A、该物质为化合反应 B、丙可能是该反应的催化剂 C、该化学反应中甲、丁的质量变化之比为5:7 D、该化学反应中乙、丁的质量变化之比为1:417. 向AgNO3溶液中加入一定质量的Fe和Al的混合粉末,充分反应后过滤,得到滤渣和浅绿色滤液.下列说法正确的是( )A、滤液中一定含有Al3+、Ag+ B、滤液中一定含有Fe2+、Ag+ C、滤渣中一定含有Ag D、滤渣中一定含有Fe18. 下列除去杂质的方法错误的是( )选项
物质(括号内为杂质)
除去杂质的方法
A
MnO2(KCl)
加水溶解、过滤、洗涤、干燥
B
CaO(CaCO3)
高温煅烧至固体质量不再改变
C
N2(O2)
通过灼热的足量的铜网
D
NaOH溶液(Na2CO3)
滴加适量氯化钙溶液,过滤
A、A B、B C、C D、D19. 下列四个图形的变化趋势能正确描述对应操作的是( )A、 足量的铁片和镁条分别与等质量、等质量分数的稀盐酸反应
B、
足量的铁片和镁条分别与等质量、等质量分数的稀盐酸反应
B、 将浓盐酸敞口放置在空气中
C、
将浓盐酸敞口放置在空气中
C、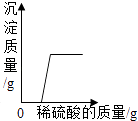 向氢氧化钠和硝酸钡的混合溶液中逐滴加入稀硫酸
D、
向氢氧化钠和硝酸钡的混合溶液中逐滴加入稀硫酸
D、 向pH=2的盐酸溶液中加水稀释
20. 下列各组物质的溶液不用其他试剂无法鉴别的是( )A、H2SO4 NaCl Na2CO3 CaCl2 B、HCl NaOH CuSO4 MgSO4 C、NaNO3 HCl CaCl2 KOH D、Na2CO3、K2SO4 BaCl2 HCl
向pH=2的盐酸溶液中加水稀释
20. 下列各组物质的溶液不用其他试剂无法鉴别的是( )A、H2SO4 NaCl Na2CO3 CaCl2 B、HCl NaOH CuSO4 MgSO4 C、NaNO3 HCl CaCl2 KOH D、Na2CO3、K2SO4 BaCl2 HCl三、填空题
-
21. 生活中处处有化学,化学与生活密切相关.(1)、山药中含有碱性皂角素,皮肤沾上会奇痒难忍.你认为可涂厨房中的来止痒;(2)、森林发生火灾时,常砍伐出一条隔离带的目的是:(3)、我们常用洗涤剂消洗餐具上的油污,这是因为洗涤剂具有功能;(4)、饼干包装袋中常用的干燥剂是(填化学式);(5)、下列物品所使用的主要材料属于合成有机高分子材料的是(填序号):
①陶瓷杯②黄沙③羊毛衫④煤炭⑥玻璃茶壶⑥塑料盆⑦酒精.
22. 掌握科学的研究方法,探索化学世界的奥秘.(1)、分类是学习化学的重要方法之一.生活中,常会接触到下列物质:A.铜丝 B.天然气 C.干冰 D.食盐水
其中属于混合物的是(填字母,下同),属于氧化物的是 .
(2)、控制变量,设计对比实验是实验探究的重要方法.实验编号
1.探究人体呼出气体中二氧化碳含量比空气中的高
2、探究影响品红扩散快慢的因素
3、探究硫在空气和氧气中燃烧
实验设计


实验分析
本实验条件除了要控制两个盛装气体样品的集气瓶大小规格相同外,还要控制相同.
发现两杯水都变红,且整杯热水变红时间比冷水要短,由此说明:①分子在不断运动;②影响分子运动快慢的因素有 .
取等量的硫粉点燃后,分别插入相同规格的盛有空气和氧气样品的集气瓶中,发现硫在氧气中燃烧更剧烈,该对比实验所得结论为 .
(3)、质量守恒定律是帮助我们学习和认识化学反应实质的重要理论.①下列表述正确的是 .
A.蜡烛燃烧后质量减少,说明质量守恒定律不是普遍规律
B.每32gS和32gO2完全反应后,生成64gSO2
C.在化学反应aA+bB=cC+dD中一定有:a+b=c+d
②物质X是一种可再生绿色能源,其燃烧的化学方程式为X+3O2 2CO2+3H2O,则X的化学式为 .
23. 治理污染、保护环境,事关人民群众的身体健康和社会的可持续发展.(1)、下列环境问题与燃煤有直接关系的是(填字母序号).a.酸雨 b.温室效应 c.可吸入颗粒物增加
(2)、烟气脱硫是目前控制燃煤污染的重要途径.如钠碱循环法是利用亚硫酸钠(Na2SO3)溶液脱除烟气中的SO2 , 生成亚硫酸氢钠(NaHSO3),反应的化学方程式为 .(3)、烟道气中含有大量CO2 , 经“捕捉”可用于生产尿素、甲醇等产晶.①尿素[CO(NH2)2]属于化学肥料中的肥.
②生产甲醇(CH3OH).
“捕捉”CO2:在高压时将烟道气中的CO2溶解于甲醇,得到CO2的甲醇溶液.所得溶液中溶质是 .
用“捕捉”CO2生产甲醇,反应的微观示意图如下:

该反应的化学方程式为 .
③还可以利用NaOH溶液来“捕捉”CO2 , 并将CO2储存或利用,流程如下:

下列有关该过程的叙述正确的有 .
a.该过程可实现CO2零排放
b.该过程中至少有2种物质可以循环利用
C.反应分离室中分离物质的操作是蒸发、结晶
d.该过程中至少发生了4个化学反应.
24. 初中化学中,我们学习了酸和碱发生中和反应的实质是H++OH﹣═H2O.如图,像这种用实际参加反应的离子符号来表示反应的式子叫离子方程式. (1)、离子方程式的书写一般按以下步骤:(以Na2SO4与BaCl2反应为例)
(1)、离子方程式的书写一般按以下步骤:(以Na2SO4与BaCl2反应为例)①写出Na2SO4与BaCl2反应的化学方程式:;
②把易溶于水、易电解的物质写成离子形式,把难溶的物质、气体和水等仍用化学式表示.上述方程式可改写成:2Na++SO42﹣+Ba2++2Cl﹣═BaSO4↓+2Na++2Cl﹣
③删去方程式两边不参加反应的离子:Ba2++SO42﹣═BaSO4↓
④检查方程式两边各元素的原子个数和电荷总数是否相等.
(2)、请回答:
下列各组中的离子,在pH=3的水溶液中能大量共存的是。A、Na+、Mg2+、Cl﹣、SO4 2﹣ B、Na+、K+、Cl﹣、OH﹣ C、Na+、Cu2+、Cl﹣、SO42﹣ D、Na+、K+、Cl﹣、CO32﹣(3)、写出稀盐酸滴在石灰石上所发生反应的离子方程式;(4)、写出一个与离子方程式Mg+2H+═Mg2++H2↑相对应的化学方程式;(5)、酸、碱、盐在水溶液中发生的复分解反应实质上就是两种化合物在溶液中相互交换离子的反应,只要具备生成物中有气体或沉淀或生成,反应就能发生.四、解答题
-
25. 请结合图回答问题
 (1)、写出图1中有标号仪器的名称:a , b .(2)、用高锰酸钾制取一瓶氧气,可选用装置A和(选填序号)组合.装入药品前要先 , 该反应的化学方程式 .(3)、用双氧水和二氧化锰制氧气,二氧化锰的作用是 , 可选用的发生装置是(选填序号).(4)、用如图2装置制取CO2并验证相关性质.
(1)、写出图1中有标号仪器的名称:a , b .(2)、用高锰酸钾制取一瓶氧气,可选用装置A和(选填序号)组合.装入药品前要先 , 该反应的化学方程式 .(3)、用双氧水和二氧化锰制氧气,二氧化锰的作用是 , 可选用的发生装置是(选填序号).(4)、用如图2装置制取CO2并验证相关性质.①生成CO2反应的化学方程式 .
②F装置的作用是 .
③H装置中的现象可说明CO2具有的性质是(答一点即可).
26. 日常生活中,人们利用碳酸钠溶液具有碱性,清洗餐具上的油污,碱性越强,去油污的效果越好,小菁决定对影响碳酸钠溶液碱性的因素展开探究,请你参与.用不同温度的水,配制溶质质量分数分别为2%、6%和10%的碳酸钠溶液,依次测量溶液的pH,记录数据如下表:
实验编号
a1
a2
a3
b1
b2
b3
c1
c2
c3
溶质质量分数
2%
2%
2%
6%
6%
6%
10%
10%
10%
水的温度(℃)
20
40
60
20
50
60
20
40
70
溶液pH
10.90
11.18
11.26
11.08
11.27
11.30
11.22
11.46
11.50
请你分析表中数据回答:
(1)、溶液碱性最强的是(填实验编号).(2)、要得出碳酸钠溶液的溶质质量分数变化与pH变化关系的结论,可选择的一组实验是(填实验编号),结论是 .(3)、在一定温度范围内,温度的变化与碳酸钠溶液的pH变化关系是 .(4)、将10%的碳酸钠溶液从20℃持续升温到70℃,所测得的pH如下表:温度(℃)
20
30
40
50
60
70
溶液pH
11.22
11.35
11.46
11.48
11.50
11.50
①当温度介于20℃~40℃时,温度对碳酸钠溶液的pH影响比较(选填“大”或“小”).
②小菁将适量碳酸钠粉末洒在沾有油污的餐具上,并冲入适量的热水,再进行擦洗,达到较好的洗涤效果,这是因为 .
(5)、碳酸钠溶于水,有部分碳酸钠能与水发生反应生成氢氧化钠,致使溶液呈碱性.实验室鉴别碳酸钠溶液和氢氧化钠溶液可选用的试剂是(填标号).a.酚酞试液 b.稀盐酸 c.氯化钠溶液 d.氯化钙溶液
(6)、欲使碳酸钠溶液中的碳酸钠完全转化为烧碱,可在溶液中加入足量的物质(写名称):或 , 并充分搅拌,有关反应的化学方程式为(写一个).五、计算题
-
27. 某品牌洁厕灵的成分是硫酸与盐酸的混合溶液,某课外活动小组想测定该品牌洁厕灵溶液中HCl的质量.取20g该品牌的洁厕灵溶液于烧杯中,不断滴加溶质质量分数为17.1%的氢氧化钡溶液,反应过程中烧杯中产生沉淀质量和烧杯中溶液pH值变化的部分数据如表所示:(已知BaCl2溶液的pH=7)
滴加氢氧化钡溶液的质量/g
5
10
25
30
烧杯中产生沉淀的质量/g
1.165
2.33
4.66
4.66

求:
(1)、完全反应后生成沉淀的质量为;(2)、计算该洁厕灵溶液中HCl的质量分数为多少?(计算结果保留至0.1%)