2017年江西省萍乡市中考化学二模试卷
试卷更新日期:2017-08-01 类型:中考模拟
一、选择题
-
1. 空气中含量较多且化学性质不活泼的气体是( )A、氧气 B、氮气 C、水蒸气 D、二氧化碳2. 放入水中不能形成溶液的物质是( )A、白糖 B、食盐 C、花生油 D、白酒3. 如图所示实验操作正确的是( )A、
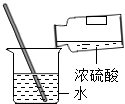 稀释浓硫酸
B、
稀释浓硫酸
B、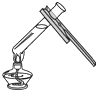 加热液体
C、
加热液体
C、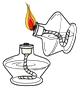 点燃酒精灯
D、
点燃酒精灯
D、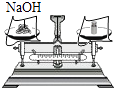 称量NaOH固体
4. “绿色发展”、“低碳生活”等理念逐渐深入民心,下列做法不符合这一理念的是( )A、出行多乘公共交通工具 B、生活中用火烧毁废旧塑料和橡胶 C、用废旧报纸制作铅笔杆 D、农业和园林改浸灌为喷灌和滴灌5. 打开装有浓氨水的试剂瓶,能闻到刺激性气味,从分子的角度解释正确的是( )A、分子大小可以改变 B、分子由原子构成 C、分子在不断运动 D、分子可以保持物质的化学性质6. 下列说法或做法正确的是( )A、门捷列夫用定量的方法研究空气的成分 B、发现厨房燃气泄漏时,立即打开排风扇开关 C、我国的纯碱资源比较丰富,用纯碱来制取大量食盐 D、生活中可以用煮沸的方法降低水的硬度7. 科学家最新发现,通过简单的化学反应,可以将树木纤维素转变成超级储能装置,如图是该反应的微观示意图,下列说法错误的是( )
称量NaOH固体
4. “绿色发展”、“低碳生活”等理念逐渐深入民心,下列做法不符合这一理念的是( )A、出行多乘公共交通工具 B、生活中用火烧毁废旧塑料和橡胶 C、用废旧报纸制作铅笔杆 D、农业和园林改浸灌为喷灌和滴灌5. 打开装有浓氨水的试剂瓶,能闻到刺激性气味,从分子的角度解释正确的是( )A、分子大小可以改变 B、分子由原子构成 C、分子在不断运动 D、分子可以保持物质的化学性质6. 下列说法或做法正确的是( )A、门捷列夫用定量的方法研究空气的成分 B、发现厨房燃气泄漏时,立即打开排风扇开关 C、我国的纯碱资源比较丰富,用纯碱来制取大量食盐 D、生活中可以用煮沸的方法降低水的硬度7. 科学家最新发现,通过简单的化学反应,可以将树木纤维素转变成超级储能装置,如图是该反应的微观示意图,下列说法错误的是( )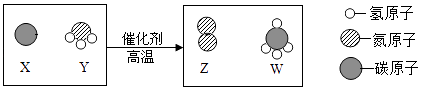 A、参加反应的X,Y两物质的粒子个数之比为3:4 B、该反应不属于置换反应 C、W物质中碳元素的质量分数为75% D、化学反应前后原子的种类、个数、质量均保持不变8. 甲、乙的溶解度曲线如图所示.下列有关说法不正确的是( )
A、参加反应的X,Y两物质的粒子个数之比为3:4 B、该反应不属于置换反应 C、W物质中碳元素的质量分数为75% D、化学反应前后原子的种类、个数、质量均保持不变8. 甲、乙的溶解度曲线如图所示.下列有关说法不正确的是( )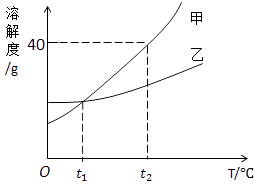 A、t2℃时,甲的饱和溶液中溶质和溶剂的质量之比为2:5 B、乙的饱和溶液从t2℃降温到t1℃,溶液仍饱和 C、t1℃时,甲、乙两种饱和溶液中溶质的质量相等 D、甲、乙两种饱和溶液分别从t2℃降温到t1℃,两溶液中溶质质量分数相等9. 化学物质通常都有其“功”与“过”,以下对化学物质的评价不符合事实的是( )A、氧气可供人呼吸但会使食物变质 B、化肥能促进植物生长但会污染土壤 C、一氧化碳可用于冶炼金属但会使人中毒 D、二氧化碳能灭火但会造成酸雨10. X、Y、Z有如图所示的转化关系(“→”表示反应一步实现,部分物质和反应条件已略去),则符合要求的X、Y、Z依次为( )
A、t2℃时,甲的饱和溶液中溶质和溶剂的质量之比为2:5 B、乙的饱和溶液从t2℃降温到t1℃,溶液仍饱和 C、t1℃时,甲、乙两种饱和溶液中溶质的质量相等 D、甲、乙两种饱和溶液分别从t2℃降温到t1℃,两溶液中溶质质量分数相等9. 化学物质通常都有其“功”与“过”,以下对化学物质的评价不符合事实的是( )A、氧气可供人呼吸但会使食物变质 B、化肥能促进植物生长但会污染土壤 C、一氧化碳可用于冶炼金属但会使人中毒 D、二氧化碳能灭火但会造成酸雨10. X、Y、Z有如图所示的转化关系(“→”表示反应一步实现,部分物质和反应条件已略去),则符合要求的X、Y、Z依次为( )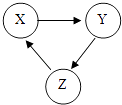 A、Cu、CuO、Cu(OH)2 B、C,CO、H2CO3 C、CaO、Ca(OH)2、CaCO3 D、H2O2、H2、H2O
A、Cu、CuO、Cu(OH)2 B、C,CO、H2CO3 C、CaO、Ca(OH)2、CaCO3 D、H2O2、H2、H2O二、选择填充题
-
11. 下列选项中物质的俗名、用途、化学式、类别完全对应正确的是
选项
俗名
用途
化学式
类别
A
食盐
除铁锈
NaCl
盐
B
生石灰
补钙剂
CaO
氧化物
C
火碱
除油污
NaOH
碱
D
纯碱
制玻璃
Na2CO3
12. 化学是以实验为基础的学科,下列有关实验现象的描述中,正确的是A、硫粉在氧气中燃烧产生蓝紫色火焰
B、将铁丝插入硫酸铜溶液中,铁丝上会有红色固体生成,溶液变成无色
C、在氯化铜溶液中滴加氢氧化钠溶液,有白色沉淀生成
D、电解水实验中正极与负极产生的气体体积比为 .
13. 硼氢化钠(NaBH4 , 其中氢元素的化合价为﹣1),是一种安全车载氢源.有关硼氢化钠的说法正确的是A.含2个氢分子 B.硼元素的化合价为+3
C.只含一种非金属元素 D.Na、B、H的质量比为 .
14. 下列各组依据实验目的设计的实验方案中合理的是选项
实验目的
实验操作
A
验证某可燃性气体中含有H2
点燃气体,在火焰上方罩干冷烧杯,观察烧杯内壁是否出现液滴
B
除去NaCl中的Na2SO4
加水溶解,再加过量BaCl2溶液后过滤、蒸发、结晶
C
鉴别化肥KNO3和NH4Cl
取样与熟石灰混合研磨,闻气味
D
检验NaOH是否变质
15. 如图所示示意图与对应的叙述正确的是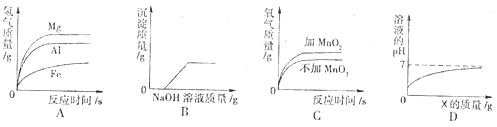
A、向等质量的不同金属中分别滴加足量的溶质质量分数相同的稀盐酸
B、向硫酸和硫酸铜的混合溶液中滴加过量的氢氧化钠溶液
C、两份等体积的5%的过氧化氢溶液,向其中一份加入少量二氧化锰
D、向稀硫酸中逐渐滴加物质X,则物质X可能是 .
三、填空与说明题
-
16. 请再如表所示中横线上填上适当的内容:
物质名称
铁
②
氯化镁
化学式
Fe
N2
④
构成物质的微粒符号
①
③
⑤
17. 化学与我们的生产、生活有着密切的联系.(1)、炒菜时,燃气灶的火焰呈黄色,锅底出现黑色物质,此时可将灶具的进风口(填“调大”或“调小”).(2)、大部分手机外壳是用塑料或镁合金制成,二者中属于有机合成高分子材料的是;当有机小分子化合物聚合成有机高分子化合物时,发生的是(填“物理变化”或“化学变化”).(3)、氯气可用作自来水的消毒剂,实验室制取氯气的化学方程式为:MnO2+4HCl(浓) X+Cl2↑+2H2O,其中X的化学式为(4)、铁是生活中最常见的金属,根据图文请回答下列问题:
不粘锅手柄应选择(填“热塑”或“热固”)性塑料制作;鸡蛋清提供的营养素主要是(填答案字母)
A.糖类 B.油脂 C.蛋白质
(5)、聚四氯乙烯内衬还能防止铁锅生锈,其原因是 .18. 如图中A、B、C、D分别是四种粒子的示意图,请回答: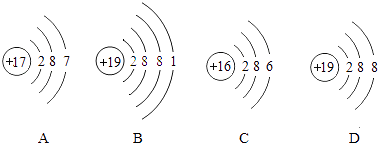 (1)、以上四种粒子A和C属于元素(填“金属”或“非金属”).(2)、A,B,C,D四种粒子中属于同种元素的是(填序号).(3)、B在化学反应中易电子(填“得到”或“失去”).(4)、B和C形成的化合物是(填化学式).19. 高纯氧化锌广泛应用于电子工业,某研究小组设计如图流程制备高纯氧化锌:
(1)、以上四种粒子A和C属于元素(填“金属”或“非金属”).(2)、A,B,C,D四种粒子中属于同种元素的是(填序号).(3)、B在化学反应中易电子(填“得到”或“失去”).(4)、B和C形成的化合物是(填化学式).19. 高纯氧化锌广泛应用于电子工业,某研究小组设计如图流程制备高纯氧化锌: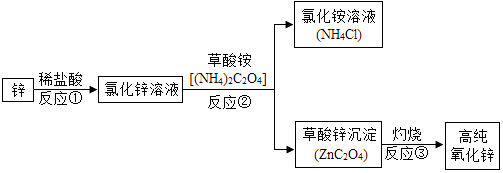 (1)、反应②的基本反应类型是;(2)、反应②后进行的分离操作名称是 , 完成该操作所需要的玻璃仪器除烧杯、玻璃棒外,还需要 , 若得到的氯化铵溶液仍然浑浊,原因可能是(写出一种即可);(3)、反应③属于分解反应,除得到氧化锌外还生成两种常见气体,其化学式为和 .(4)、高纯氧化锌属于(填“混合物”或“纯净物”)20. A~H是初中化学常见的物质,已知A为黑色固体单质,G为紫红色固体单质,B为红棕色粉末,H为蓝色的硫酸盐溶液.它们的转化关系如图所示,回答问题:
(1)、反应②的基本反应类型是;(2)、反应②后进行的分离操作名称是 , 完成该操作所需要的玻璃仪器除烧杯、玻璃棒外,还需要 , 若得到的氯化铵溶液仍然浑浊,原因可能是(写出一种即可);(3)、反应③属于分解反应,除得到氧化锌外还生成两种常见气体,其化学式为和 .(4)、高纯氧化锌属于(填“混合物”或“纯净物”)20. A~H是初中化学常见的物质,已知A为黑色固体单质,G为紫红色固体单质,B为红棕色粉末,H为蓝色的硫酸盐溶液.它们的转化关系如图所示,回答问题: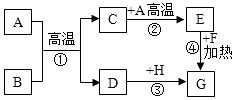 (1)、B的化学式为 , H中溶质的化学式;(2)、反应①的化学反应方程式为;该反应中氧化剂是(填物质名称);(3)、反应①~③中为置换反应的是(填序号);(4)、反应②是(填“放热”或“吸热”)反应.
(1)、B的化学式为 , H中溶质的化学式;(2)、反应①的化学反应方程式为;该反应中氧化剂是(填物质名称);(3)、反应①~③中为置换反应的是(填序号);(4)、反应②是(填“放热”或“吸热”)反应.四、解答题
-
21. 如图是实验室制取气体的有关装置图,据图回答下列问题:
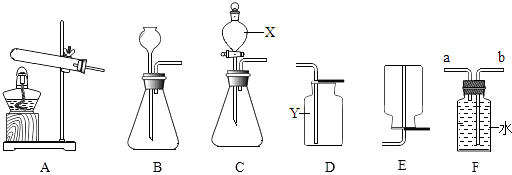 (1)、写出图中标号仪器的名称:X , Y .(2)、CO2的制取方法有多种,若用加热碳酸氢钠固体制取CO2 , 应选用的发生装置为(填装置序号,下同),收集装置为;若用大理石与稀盐酸反应制取CO2 , 则反应的化学方程式为 .(3)、小海同学在装置B中加入15%的过氧化氢溶液和二氧化锰制取氧气.
(1)、写出图中标号仪器的名称:X , Y .(2)、CO2的制取方法有多种,若用加热碳酸氢钠固体制取CO2 , 应选用的发生装置为(填装置序号,下同),收集装置为;若用大理石与稀盐酸反应制取CO2 , 则反应的化学方程式为 .(3)、小海同学在装置B中加入15%的过氧化氢溶液和二氧化锰制取氧气.①若用F装置收集氧气,氧气应从(填“a”或“b”)端通入.
②实验中发现不能得到平稳的氧气流.小涛同学提出可以从两个方面加以改进:
一是将制取的装置B换为上图中的装置;
二是将过氧化氢溶液加水稀释.如果把50g溶质质量分数为15%的过氧化氢溶液稀释成溶质质量分数为10%的溶液,需加水的质量为克.
22. 为了比较铝与相同pH的稀盐酸和稀硫酸反应的快慢,某化学兴趣小组做了如下的探究实验: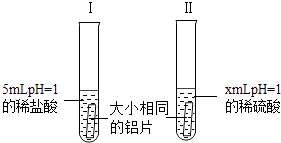 (1)、铝与稀硫酸反应的化学方程式为 .(2)、x= , 实验过程中,可以通过观察来比较铝与稀盐酸和稀硫酸反应的剧烈程度.(3)、实验过程中,发现铝与稀盐酸反应更加剧烈,同学们提出了以下猜想:
(1)、铝与稀硫酸反应的化学方程式为 .(2)、x= , 实验过程中,可以通过观察来比较铝与稀盐酸和稀硫酸反应的剧烈程度.(3)、实验过程中,发现铝与稀盐酸反应更加剧烈,同学们提出了以下猜想:猜想一:试管Ⅰ中氯离子对反应起了促进作用;
猜想二:试管Ⅱ中硫酸根离子对反应起了阻碍作用;
猜想三:以上两种猜想同时成立.
为了验证上述猜想是否正确,向试管Ⅰ中加入少量(填序号),向试管Ⅱ中加入少量(填序号),作对比试验.
A、硫酸铜 B、氯化钠 C、硫酸钠 D、浓盐酸
(4)、通过(3)中的对比试验,观察到试管Ⅰ中反应快慢无明显变化,试管Ⅱ中反应明显加剧,则猜想成立.23. “84”消毒液在日常生活中使用广泛,具有漂白、杀菌、消毒功效.某化学兴趣小组对一瓶敞口久置的“84”消毒液成分产生兴趣,在老师的指导下,展开探究.【提出问题】该敞口久置的消毒液中溶质有哪些?
【查阅资料】“84”消毒液主要成分是次氯酸钠(NaClO)和氯化钠,NaClO为有效成分,有腐蚀性并易与空气中CO2反应(2NaClO+CO2+H2O═2HClO+Na2CO3).NaClO溶液、HClO都具有漂泊、杀菌、消毒功效.HClO不稳定,受热或光照会发生分解.
(1)、【分析讨论】小组同学经过讨论,认为该消毒液中的溶质一定有 . 可能还有NaClO、Na2CO3、HClO中的一种或多种.(2)、【实验过程】Ⅰ:向装入有色布条的试管中加入适量该消毒液试样,布条长时间不褪色.Ⅱ:另取适量该消毒液试样于试管中,加入足量氯化钙溶液,静置,观察到的现象为 .
(3)、【得出结论】实验过程Ⅰ中有色布条不褪色,说明该消毒液试样中的溶质不含 .实验过程Ⅱ中反应的化学方程式为 .
综上所述,该消毒液试样中的溶质为 .
(4)、【交流反思】生活中,“84”消毒液贮藏时应注意;一般不要“84”消毒液对蔬菜、水果进行消毒,其原因可能是 .(5)、【拓展延伸】①次氯酸钠与稀硫酸可发生复分解反应,化学方程式为
②次氯酸钠与盐酸反应可生成有毒的氯气,日常生活中“84”消毒液不能与洁厕灵(主要成分为盐酸)混合使用.
五、解答题
-
24. 向53g质量分数为10%的碳酸钠溶液中逐滴加入质量分数为5%的稀盐酸,生成二氧化碳的质量随加入盐酸质量的变化关系如图所示.(不考虑CO2的溶解)
已知:
OB段反应的化学方程式为Na2CO3+HCl═NaCl+NaHCO3
BD段(不含B点)反应的化学方程式为NaH CO3+HCl═NaCl+H2O+CO2↑
请回答:
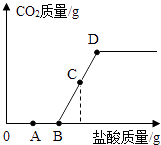 (1)、53g质量分数为10%的碳酸钠溶液中溶质质量为 g.(2)、A点对应溶液中溶质有(填化学式).(3)、B点横坐标为.(计算结果保留1位小数,下同)(4)、假设C点横坐标为54.75,计算C点对应的二氧化碳质量.(写出计算过程)
(1)、53g质量分数为10%的碳酸钠溶液中溶质质量为 g.(2)、A点对应溶液中溶质有(填化学式).(3)、B点横坐标为.(计算结果保留1位小数,下同)(4)、假设C点横坐标为54.75,计算C点对应的二氧化碳质量.(写出计算过程)