2017年黑龙江省大庆市中考化学二模试卷
试卷更新日期:2017-08-01 类型:中考模拟
一、选择题
-
1. 自然界的下列过程或现象中,伴随着化学变化的是( )A、南极冰川的融化 B、江河沙石的迁移 C、地下石油形成 D、天上云雨转换2. 甲、乙两同学在实验室制取CO2和O2时,无论选择什么药品,他们都能选用的装置是( )A、
 B、
B、 C、
C、 D、
D、 3. 化学物质通常都有其“功”与“过”,以下对化学物质的评价不符合事实的是( )A、氧气可供人呼吸但会使食物变质 B、化肥能促进植物生长但会污染土壤 C、一氧化碳可用于冶炼金属但会使人中毒 D、二氧化碳能灭火但会造成酸雨4. 规范操作室实验成功的关键,下列有关试验中涉及到的操作错误的是( )A、水电解实验时,向水中加入硫酸钠或氢氧化钠增加水的导电性 B、做铁丝在氧气中燃烧实验时,预先在集气瓶底加少量水 C、点燃一氧化碳气体时,先要检验一氧化碳气体的纯度 D、测定空气中氧气含量,红磷在氧气中燃烧熄灭后,立即打开弹簧夹观察水面上升情况5. 下列叙述正确的是( )A、稀释浓硫酸时应将水沿烧杯内壁倒入浓硫酸中,并用玻璃棒不断搅拌 B、将100g溶质质量分数为98%的浓硫酸稀释为49%,需加水50g C、玻璃棒在过滤操作和蒸发操作中所起的作用是一样的 D、蔗糖溶液不导电是因为其中不存在自由移动的带电粒子6. 下列关于化学中“一定”的说法完全正确的一组是( )A、分子一定由原子构成;原子核一定由质子和中子构成 B、碱中一定含有氢元素;有机物中一定含有碳元素 C、纯净物一定由同种分子构成;生成盐和水的反应一定是中和反应 D、冷却热饱和溶液一定会有晶体析出;当可燃物的温度达到其着火点就一定会燃烧7. 下列实验方案正确的是( )A、用点燃的方法除去二氧化碳中少量的一氧化碳 B、用Fe3O4和稀硫酸制备FeSO4溶液 C、用水区别固体硝酸铵和固体氢氧化钠 D、用氯化钡溶液检验硫酸钠溶液中是否含有碳酸钠8. 如下两个转化都可以通过一步反应实现:CO→CO2、H2SO4→MgSO4 . 对上述转化过程分析正确的是( )A、都能通过与非金属单质反应实现 B、都能通过与金属氧化物反应实现 C、都能通过化合反应实现 D、都能通过置换反应实现9. 下列图象能正确反映实验过程中相应量变化的是( )
3. 化学物质通常都有其“功”与“过”,以下对化学物质的评价不符合事实的是( )A、氧气可供人呼吸但会使食物变质 B、化肥能促进植物生长但会污染土壤 C、一氧化碳可用于冶炼金属但会使人中毒 D、二氧化碳能灭火但会造成酸雨4. 规范操作室实验成功的关键,下列有关试验中涉及到的操作错误的是( )A、水电解实验时,向水中加入硫酸钠或氢氧化钠增加水的导电性 B、做铁丝在氧气中燃烧实验时,预先在集气瓶底加少量水 C、点燃一氧化碳气体时,先要检验一氧化碳气体的纯度 D、测定空气中氧气含量,红磷在氧气中燃烧熄灭后,立即打开弹簧夹观察水面上升情况5. 下列叙述正确的是( )A、稀释浓硫酸时应将水沿烧杯内壁倒入浓硫酸中,并用玻璃棒不断搅拌 B、将100g溶质质量分数为98%的浓硫酸稀释为49%,需加水50g C、玻璃棒在过滤操作和蒸发操作中所起的作用是一样的 D、蔗糖溶液不导电是因为其中不存在自由移动的带电粒子6. 下列关于化学中“一定”的说法完全正确的一组是( )A、分子一定由原子构成;原子核一定由质子和中子构成 B、碱中一定含有氢元素;有机物中一定含有碳元素 C、纯净物一定由同种分子构成;生成盐和水的反应一定是中和反应 D、冷却热饱和溶液一定会有晶体析出;当可燃物的温度达到其着火点就一定会燃烧7. 下列实验方案正确的是( )A、用点燃的方法除去二氧化碳中少量的一氧化碳 B、用Fe3O4和稀硫酸制备FeSO4溶液 C、用水区别固体硝酸铵和固体氢氧化钠 D、用氯化钡溶液检验硫酸钠溶液中是否含有碳酸钠8. 如下两个转化都可以通过一步反应实现:CO→CO2、H2SO4→MgSO4 . 对上述转化过程分析正确的是( )A、都能通过与非金属单质反应实现 B、都能通过与金属氧化物反应实现 C、都能通过化合反应实现 D、都能通过置换反应实现9. 下列图象能正确反映实验过程中相应量变化的是( )
①将接近饱和的硝酸钾溶液缓慢降温
②向一定量的氢氧化钡溶液中加过量稀硫酸
③向等质量、等质量分数的稀盐酸中分别逐渐加入锌粉、镁粉至过量
④在密闭容器中点燃H2和O2的混合气体.
A、①② B、②③ C、①④ D、②④10. 为了探究实验室中久置的氢氧化钠固体的变质情况,同学们进行如下图所示的实验.下列分析和结论正确的是( ) A、若Ⅱ、Ⅲ均有明显现象,则说明样品一定完全变质 B、若D为白色固体,则溶液A是Na2CO3溶液. C、若D为气体,则加入甲溶液的目的是证明样品已变质. D、若D为白色固体,且溶液C为红色,则样品一定是部分变质.
A、若Ⅱ、Ⅲ均有明显现象,则说明样品一定完全变质 B、若D为白色固体,则溶液A是Na2CO3溶液. C、若D为气体,则加入甲溶液的目的是证明样品已变质. D、若D为白色固体,且溶液C为红色,则样品一定是部分变质.二、填空题
-
11. 生活离不化学,化学与生活息息相关.(1)、人体可以从水果和蔬菜中摄取 , 该类物质需要量很小,但可以起到调节新陈代谢、预防疾病和维持身体健康的作用.
营养成分表
营养成分
每片含量
每100g含量
镁
6.7mg
1.12g
叶酸
255
42.5mg
(2)、如表是某儿童补铁药品的部分说明.说明中的“铁”指的是(填“单质”、“元素”或“分子”).(3)、某些食品的近似pH如下:食品
柠檬汁
苹果汁
葡萄汁
番茄汁
牛奶
玉米粥
pH
2.4
3.1
4.2
4.4
6.5
7.8
其中酸性最强的是 , 胃酸过多的人应食用
(4)、农业上用石灰乳和硫酸铜配制农药“波尔多液”时不宜用铁质容器,用化学方程式表示其原因 .(5)、如图为某化工企业生产流程示意图:下列说法正确的是 . (填选项序号) A、钛酸亚铁(FeTiO3)中钛元素为+3价 B、③中氩气(Ar)作反应物,反应类型为置换反应 C、②中为使原料全部转化为甲醇,理论上CO和H2投料的质量比为1:2 D、①中反应为:2FeTiO3+6C+7Cl2 2X+2TiCl4+6CO,则X为FeCl3 .12. 在宏观、微观和符号之间建立联系是化学学科的特点.
A、钛酸亚铁(FeTiO3)中钛元素为+3价 B、③中氩气(Ar)作反应物,反应类型为置换反应 C、②中为使原料全部转化为甲醇,理论上CO和H2投料的质量比为1:2 D、①中反应为:2FeTiO3+6C+7Cl2 2X+2TiCl4+6CO,则X为FeCl3 .12. 在宏观、微观和符号之间建立联系是化学学科的特点. (1)、对图的理解不正确的是 .A、原子可以构成物质 B、分子可以构成物质 C、反应前后元素种类不变 D、反应前后各元素化合价不变(2)、果糖(C6H12O6)大量存在于水果中,它是由种元素组成,其中碳、氢元素的质量比为 .(3)、A,B,C,D表示4种物质,部分物质分子的微观示意图如图所示.
(1)、对图的理解不正确的是 .A、原子可以构成物质 B、分子可以构成物质 C、反应前后元素种类不变 D、反应前后各元素化合价不变(2)、果糖(C6H12O6)大量存在于水果中,它是由种元素组成,其中碳、氢元素的质量比为 .(3)、A,B,C,D表示4种物质,部分物质分子的微观示意图如图所示.物质
B
C
D

微观



A和B可发生如下反应:A+3B 2C+3D.则A的化学式为 , A,B,C,D中属于氧化物的是(填字母).
13. 金属在生产和生活中有广泛的应用.(1)、钢铁可以制成炒锅,主要利用了铁的延展性和性.(2)、下列关于金属的说法正确的是 .A、常温下金属均为固态 B、在铁制品表面刷漆防止铁锈蚀 C、铜是目前世界年产量最高的金属 D、金属与酸反应后溶液质量一定增加 E、铝表面易生成致密的氧化膜,因此铝有良好的抗腐蚀性(3)、某电镀厂为减少水污染及节约成本,从含有CuSO4、ZnSO4、FeSO4的废水中回收硫酸锌和有关金属,实验过程如下: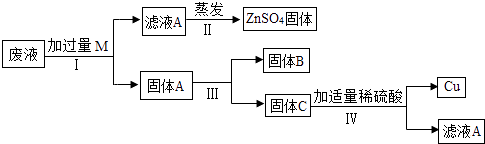
①步骤Ⅰ中加入过量M的目的是 , 写出该步骤中反应的化学方程式
②步骤Ⅲ的操作为 .
14. 有A ,B ,C ,D ,E五种物质,它们由氢、碳、氧、钠、氯、钙中部分元素组成.其中,C、E由两种元素组成,A,B,D由三种元素组成.某实验小组做了如下实验,实验中的每一步均有明显现象.其中,紫色石蕊溶液遇C溶液变红,C溶液与A,B反应时均产生无色气体,A溶液与D溶液、E溶液反应时均产生白色沉淀. (1)、A溶液遇无色酚酞溶液变红,则A溶液一定呈性(填“酸”或“中”或“碱”).(2)、A溶液与D溶液反应时产生白色沉淀的化学式是 , D的常见用途有(写出一条即可).(3)、在C溶液与B固体反应后的试管中滴加A溶液,先产生气泡后产生沉淀,则加入A溶液后所发生反应的化学方程式为 .(4)、在A溶液与D溶液反应后的试管中加入C溶液,测得反应后的溶液pH<7,则反应后的溶液中含有的溶质除HCl外,还有 .15. 下列数据是氯化钠和氯化钾固体在不同温度时的溶解度.
(1)、A溶液遇无色酚酞溶液变红,则A溶液一定呈性(填“酸”或“中”或“碱”).(2)、A溶液与D溶液反应时产生白色沉淀的化学式是 , D的常见用途有(写出一条即可).(3)、在C溶液与B固体反应后的试管中滴加A溶液,先产生气泡后产生沉淀,则加入A溶液后所发生反应的化学方程式为 .(4)、在A溶液与D溶液反应后的试管中加入C溶液,测得反应后的溶液pH<7,则反应后的溶液中含有的溶质除HCl外,还有 .15. 下列数据是氯化钠和氯化钾固体在不同温度时的溶解度.温度/℃
0
20
40
60
80
100
溶解度/g
NaCl
35.7
36.0
36.6
37.3
38.4
39.8
KCl
27.6
34.0
40.0
45.5
51.1
56.7
(1)、在0~20℃时,KCl的溶解度(填“>”或“<”)NaCl的溶解度;(2)、20℃时,向100g水中加入25g氯化钠,充分溶解后,得到的溶液为(填“饱和”或“不饱和”)溶液,溶液中溶质质量分数为;(3)、20℃时,进行如下图所示的实验.
①A~E中,溶液中溶质质量分数相同的是;
②下列操作能使E溶液中溶质质量分数变小的是(填字母序号).
a.加入2g KCl b.加入100g 100℃的水 c.降温至40℃
三、解答题
-
16. 氢化钙(CaH2)固体是一种储氢材料,登山运动员常用其作能源提供剂.

【查阅资料】
①碱石灰是氧化钙和氢氧化钠的固体混合物.
②钙和氢化钙都能与水反应,均生成氢氧化钙和氢气.
【氢化钙的制备】
氢化钙通常用氢气与钙加热制得.某化学兴趣小组设计的制取装置如图所示(图中固定装置省略).
(1)、装置A中制取氢气反应的化学方程式是 .(2)、装置B的作用是 .(3)、装置D的作用是 .(4)、装置C中制取氢化钙的化学方程式是 .(5)、【样品成分的猜想】通过上述方法制得的氢化钙样品的成分有下列两种猜想:猜想一:全部是氢化钙; 猜想二: .
(6)、【设计实验】现有2.1g氢化钙样品,请设计实验验证猜想二是否成立(要求操作、数据和结论).17. 我国青海湖采集的天然碱样品可表示为aNa2CO3•bNaHCO3•cH2O(a、b、c为最简整数比).小红同学为测定其组成,称取该天然碱样品16.6g进行如下实验:
已知:碳酸钠比较稳定,加热时不分解;2NaHCO3 Na2CO3+CO2↑+H2O
图中B处为两个单向阀:推注射器时A1关闭,A2处打开;拉注射器时,A1打开进空气,A2关闭.
(一)实验步骤 ①组装好装置,检查气密性 ②反复推拉注射器 ③称量E、F的质量 ④关闭弹簧夹,加热D处试管直到反应不再进行 ⑤打开弹簧夹,再次反复缓缓推拉注射器 ⑥再次称量E、F的质量.
(二)问题探究:
(1)、E中的药品为 , E的作用是 . C、F、G中装有碱石灰(生石灰与烧碱的固体混合物),则C的作用是 ,F的作用是 , G的作用是 .
(2)、实验步骤②与③能否颠倒(填“能”或“不能”).若不进行步骤⑤的操作,则所测得的碳酸氢钠质量(填“偏大”、“偏小”、“无影响”),该操作中推注射器时缓缓的目的是;若没有G装置,则碳酸氢钠的质量(填“偏大”、“偏小”、“无影响”).
(3)、据下表回答下列问题:反应前
反应后
E的质量为100.0g
E的质量为102.25g
F的质量为50.0g
F的质量为51.1g
①碳酸氢钠分解生成二氧化碳的质量为g,
②碳酸氢钠的质量为g
③结晶水的质量为g
④Na2CO3的质量为g,
⑤该天然碱的化学式中a:b:c= .
四、解答题
-
18. 胆矾晶体部分失水后得到某硫酸铜晶体(CuSO4•xH2O),华雪同学为研究CuSO4•xH2O加热后所得物质的组成,做了以下实验:取10.7gCuSO4•xH2O晶体加热使其分解,绘制出固体的质量随温度的变化关系图.如图所示,到t1℃时该固体完全失去结晶水,化学方程式为:CuSO4•xH2O CuSO4+xH2O↑.
回答下列问题.(写出计算过程)
 (1)、CuSO4中铜元素的质量分数是多少?(2)、计算该硫酸铜晶体(CuSO4•xH2O)中x的值;(3)、升温到t2℃,残留固体是黑色物质,求m的值.
(1)、CuSO4中铜元素的质量分数是多少?(2)、计算该硫酸铜晶体(CuSO4•xH2O)中x的值;(3)、升温到t2℃,残留固体是黑色物质,求m的值.