贵州省从江县民中2018-2019学年高一上学期化学期末考试试卷
试卷更新日期:2019-12-24 类型:期末考试
一、单选题
-
1. 在某体系内有反应物和生成物5种物质:H2S、S、FeCl3、FeCl2、HCl.已知H2S为反应物,则另一反应物是( )A、S B、FeCl2 C、FeCl3 D、HCl2. 下列说法中错误的是( )A、用过滤法除去食盐水中的少量泥沙 B、用水溶解可除去氢氧化钠中的碳酸钠 C、用蒸发结晶的方法从食盐水中提取氯化钠 D、用加热法除去水中溶解的少量氧气3. 下列反应不属于氧化还原反应的是( )A、Zn+2HCl=ZnCl2+H2↑ B、Ca(ClO)2+2HCl=CaCl2+2HClO C、Pb3O4+8HCl(浓)=3PbCl2+Cl2↑+4H2O D、3Cl2+6KOH(浓) 5KCl+KClO3+3H2O4. 把各组中的气体通入溶液中,溶液的导电能力显著增强的是( )A、CO2(g)通入NaOH溶液 B、CO2(g)通入石灰水 C、NH3(g)通入CH3COOH溶液 D、NH3(g)通入盐酸中5. 当光束通过下列分散系:①有尘埃的空气 ②稀硫酸 ③蒸馏水 ④墨水,能观察到有丁达尔效应的是( )A、①② B、②③ C、①④ D、②④6. 某金属元素由氧化物转变为单质,则该金属元素( )A、一定被氧化 B、一定被还原 C、可能被氧化,也可能被还原 D、既不被氧化,也不被还原7. 等体积的硫酸铝、硫酸锌、硫酸钠溶液分别与足量氯化钡溶液反应。若生成硫酸钡沉淀的质量比为1∶2∶3,则三种硫酸盐的物质的量浓度之比为( )A、1∶2∶3 B、1∶6∶9 C、1∶3∶3 D、1∶3∶68. 已知地下水含钙离子、镁离子等,家庭中的下列物品可用于检验这两种离子的是( )A、纯碱 B、食盐 C、食醋 D、食糖9. 下列相应条件下不能发生电离的电解质是( )A、硫酸氢钠溶于水 B、高温下氢氧化钠熔化 C、固态醋酸熔化 D、酒精溶于水10. 下列变化过程中,画横线的元素被氧化的是( )A、CO2→CO B、FeCl3→FeCl2 C、HCl→AgCl D、KI→I211. 下列物质:①汽油、②四氯化碳、③酒精,其中可用作从碘水中提取碘的萃取剂是( )A、①③ B、②③ C、①② D、①②③12. 同温同压下,下列气体的密度最大的是( )A、F2 B、Cl2 C、HCl D、CO213. 有K2SO4和Al2(SO4)3的混合溶液,已知其中Al3+的物质的量浓度为0.4 mol·L-1 , SO42-的物质的量浓度为0.7 mol·L-1 , 则此溶液中K+的物质的量浓度为( )A、0.1 mol·L-1 B、0.15 mol·L-1 C、0.2 mol·L-1 D、0.25 mol·L-114. 已知某气体的摩尔质量为Mg/mol,则bg该气体在标准状况下的体积(L)为( )A、22.4Mb B、22.4b/M C、22.4M/b D、22.4b15. 下列有关金属材料的说法错误的是( )A、铁有良好的导热性,常用来制作炊具 B、铜的化学性质不活泼,因此可用于制导线 C、废旧电池中汞的回收可减少对环境的污染 D、钛合金与人体有很好的相容性,因此可用来制造人造骨16. 已知浓盐酸和次氯酸钙能发生如下反应:Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O。用贮存很久的漂白粉与浓盐酸反应制得的氯气中,可能含有的杂质气体是:( )
①CO2②HCl③H2O④O2
A、①②③ B、②③④ C、②③ D、①④17. 已知铜与浓硝酸反应生成硝酸铜、二氧化氮和水。下列说法正确的是( )A、硝酸是氧化剂,二氧化氮是氧化产物 B、还原剂与氧化剂的物质的量之比是1∶4 C、氧化产物和还原产物的物质的量之比为2∶1 D、若2 mol硝酸(浓)完全反应,则反应中共转移了NA个电子18. 小明家收藏了一尊清末的铝制佛像,至今保存完好,其未被锈蚀的主要原因是( )A、铝不易发生化学反应 B、铝的氧化物易发生还原反应 C、铝不易被氧化 D、铝易被氧化,且氧化铝膜具有保护内部铝的作用19. 铁和铁合金是生活中常见的材料,下列说法正确的是( )A、纯铁和铁合金都能导电、传热 B、纯铁的熔点低于铁合金 C、纯铁的硬度和强度都高于铁合金 D、纯铁与盐酸反应,铁合金不与盐酸反应20. 在过氧化钠与水反应中,发生氧化反应和还原反应的物质的物质的量之比是( )A、1∶1 B、1∶2 C、2∶1 D、8∶5321. 等体积、等物质的量浓度的稀硫酸、氢氧化钠溶液分别放在甲、乙两烧杯中,各加入等质量的铝,生成氢气的体积之比为5∶6,则甲、乙两烧杯中的反应情况是( )A、甲、乙中都是铝过量 B、甲中铝过量、乙中碱过量 C、甲中酸过量、乙中铝过量 D、甲中酸过量、乙中碱过量22. 水泥和普通玻璃都是常见的硅酸盐产品。下列说法中错误的是( )A、生产水泥和普通玻璃的每一种原料都含有硅 B、水泥、普通玻璃都是混合物 C、生产水泥和玻璃都必须用石灰石 D、用纯净的石英制成石英玻璃,它的膨胀系数小,常用来制造耐高温的化学仪器23. 下列各项比较中,正确的是( )A、熔点:金属钠<钠钾合金 B、导电性:银<铜 C、硬度:硬铝<铝 D、延展性:生铁<纯金24. 物质的量相同的二氧化硫和三氧化硫所含氧原子的个数比为( )A、3∶2 B、2∶3 C、4∶5 D、5∶425. 将一盛满Cl2的试管倒立在水槽中,当日光照射相当一段时间后,试管中最后剩余的气体约占试管容积的( )A、2/3 B、1/2 C、1/3 D、1/426. 既能与盐酸反应,又能与氢氧化钠溶液反应的化合物是( )A、碳酸钙 B、氯化铜 C、碳酸氢钠 D、金属铝27. 有下列物质:①干燥的氯气、②过氧化钠、③次氯酸钠、④活性炭、⑤二氧化硫,其中能使品红溶液褪色的是( )A、除①外其他都可以 B、①②③ C、①④⑤ D、全部28. 下列说法中,错误的是:( )①金属钠、氢气都能在氯气中燃烧,生成白色的烟雾;②铜丝在氯气中燃烧,生成蓝绿色的氯化铜;③液氯就是氯气的水溶液,它能使干燥的有色布条褪色;④久置的氯水,因氯气几乎完全挥发掉,剩下的就是水
A、① B、①② C、①③④ D、①②③④二、填空题
-
29. 二氧化硫是形成酸雨的“罪魁祸首”,为了保护环境,应减少二氧化硫在大气中的排放。请回答下列问题:(1)、二氧化硫与水反应可生成亚硫酸,那么二氧化硫是电解质还是非电解质?。(2)、工业尾气中的二氧化硫常用氢氧化钠溶液吸收,生成亚硫酸钠或亚硫酸氢钠:
①亚硫酸钠溶于水的电离方程式是;
②亚硫酸氢钠溶于水的电离方程式是。
(3)、二氧化硫在催化剂的作用下可被氧气氧化成三氧化硫,三氧化硫与水反应生成硫酸:①三氧化硫是电解质还是非电解质?;
②氧气属于电解质或非电解质吗?。
(4)、三氧化硫与氢氧化钠溶液反应可生成硫酸氢钠:①硫酸氢钠溶于水的电离方程式是;
②硫酸氢钠是酸类物质吗?。
30. 常温下,A是可用来对自来水进行消毒的黄绿色单质气体,A、B、C、D、E都含X元素,其转化关系如图所示: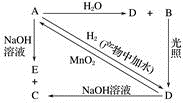 (1)、请分别写出下列物质的化学式(如为溶液请填溶质的化学式):A、B、D。(2)、写出下列反应的化学方程式或离子方程式(请注明反应条件):A+H2O(离子方程式):;A+NaOH(离子方程式):;D→A(化学方程式):。
(1)、请分别写出下列物质的化学式(如为溶液请填溶质的化学式):A、B、D。(2)、写出下列反应的化学方程式或离子方程式(请注明反应条件):A+H2O(离子方程式):;A+NaOH(离子方程式):;D→A(化学方程式):。三、实验题
-
31. 现有A,B,C,D,E,F六种装置,如图所示。(胶塞、导管可自由选用)。已知:实验室可用下列反应制取氧气2KClO3 2KCl+3O2↑

 (1)、写出仪器名称:① , ②。(2)、实验室制取并收集氧气时,应选择和相连接。(3)、做木炭还原氧化铜并检验生成气体的实验时,应选择和相连接,检验生成气体时使用的试剂是 , 检验气体时观察到的实验现象是。(4)、制取氢气并做还原氧化铜的实验时,应选择和装置,实验结束时应先停止加热,待试管冷却后,再停止通氢气,其原因是。
(1)、写出仪器名称:① , ②。(2)、实验室制取并收集氧气时,应选择和相连接。(3)、做木炭还原氧化铜并检验生成气体的实验时,应选择和相连接,检验生成气体时使用的试剂是 , 检验气体时观察到的实验现象是。(4)、制取氢气并做还原氧化铜的实验时,应选择和装置,实验结束时应先停止加热,待试管冷却后,再停止通氢气,其原因是。四、综合题
-
32. 某氧化铁样品中含有少量的硫酸亚铁。某同学要测定其中铁元素的质量分数,设计了如下实验方案。
 (1)、操作Ⅰ中配制溶液时,所用到的玻璃仪器除烧杯、量筒、玻璃棒、胶头滴管以外,还必须有 (填仪器名称)。(2)、反应①中加入足量H2O2溶液,反应的离子方程式:。(3)、检验沉淀中 是否洗涤干净的操作是。(4)、将沉淀加热,冷却至室温,用天平称量坩埚与加热后固体的总质量为b1g,再次加热并冷却至室温称其质量为b2g,若b1-b2=0.3,还应进行的操作是。(5)、坩埚的质量为42.6 g,最终坩埚与加热后的固体的总质量为45.8 g,则样品中铁元素的质量分数为。(6)、有同学认为上述方案的实验步骤太繁琐,他认为,只要将样品溶于水充分搅拌,加热、蒸干、灼烧称量即可测得样品中铁元素的质量分数,你认为他的这个方案是否可行?(填“可行”或“不可行”)。
(1)、操作Ⅰ中配制溶液时,所用到的玻璃仪器除烧杯、量筒、玻璃棒、胶头滴管以外,还必须有 (填仪器名称)。(2)、反应①中加入足量H2O2溶液,反应的离子方程式:。(3)、检验沉淀中 是否洗涤干净的操作是。(4)、将沉淀加热,冷却至室温,用天平称量坩埚与加热后固体的总质量为b1g,再次加热并冷却至室温称其质量为b2g,若b1-b2=0.3,还应进行的操作是。(5)、坩埚的质量为42.6 g,最终坩埚与加热后的固体的总质量为45.8 g,则样品中铁元素的质量分数为。(6)、有同学认为上述方案的实验步骤太繁琐,他认为,只要将样品溶于水充分搅拌,加热、蒸干、灼烧称量即可测得样品中铁元素的质量分数,你认为他的这个方案是否可行?(填“可行”或“不可行”)。五、推断题
-
33. 现有金属单质A、B和气体甲、乙、丙及物质C、D、E、F、G,它们之间能发生如图反应(图中有些反应的产物和反应的条件没有全部标出)。

请根据以上信息回答下列问题:
(1)、写出下列物质的化学式:乙 , F。(2)、写出下列反应的离子方程式:①金属A和水反应。②红褐色沉淀C与物质E反应。
③F与黄绿色气体乙反应。
④实验室常用氢氧化钠吸收实验过程中的黄绿色气体乙,写出用氢氧化钠溶液吸收该气体的离子方程式。
(3)、将G溶液逐滴加入到沸水中会产生一种红褐色的液体。你认为该液体中的分散质粒子直径在之间,验证的简单方法是:。34. 将红热的固体单质M放入浓硝酸中,剧烈反应,产生混合气体A,A在常温下不与空气接触时,发生如图所示的变化。 (1)、混合气体A的主要成分是。(2)、气体B为 , 蓝色溶液D为。(3)、单质M与浓硝酸反应的化学方程式是。(4)、单质C与稀硝酸反应的化学方程式是。
(1)、混合气体A的主要成分是。(2)、气体B为 , 蓝色溶液D为。(3)、单质M与浓硝酸反应的化学方程式是。(4)、单质C与稀硝酸反应的化学方程式是。
-
-