内蒙古自治区鄂尔多斯西部四旗2018-2019学年高三上学期化学期末考试试卷
试卷更新日期:2019-12-24 类型:期末考试
一、单选题
-
1. 化学与生活、生产密切相关。下列说法错误的是( )A、MgO的熔点很高,可作优良的耐火材料,工业上也用其电解冶炼镁 B、明矾水解形成的胶体能吸附水中悬浮物,可用于水的净化 C、燃放的焰火是某些金属元素焰色反应所呈现出来的色彩 D、铝比铁活泼,但铝制品比铁制品在空气中耐腐蚀2. 柠檬烯(
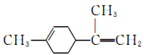 )是一种食用香料。下列分析正确的是( ) A、柠檬烯的一氯代物有8种 B、柠檬烯和
)是一种食用香料。下列分析正确的是( ) A、柠檬烯的一氯代物有8种 B、柠檬烯和 互为同分异构体
C、柠檬烯分子中所有碳原子可能均处同一平面
D、一定条件下,柠檬烯可以发生加成、氧化、酯化等反应
3. 用下列实验装置进行相应实验,能达到实验目的的是(夹持装置未画出)( )A、
互为同分异构体
C、柠檬烯分子中所有碳原子可能均处同一平面
D、一定条件下,柠檬烯可以发生加成、氧化、酯化等反应
3. 用下列实验装置进行相应实验,能达到实验目的的是(夹持装置未画出)( )A、 制取二氧化硫气体
B、
制取二氧化硫气体
B、 检验溶液中是否有钾离子
C、
检验溶液中是否有钾离子
C、 验证氨气极易溶解于水
D、
验证氨气极易溶解于水
D、 加热氢氧化钠固体
4. X、Y、Z、W均为短周期主族元素且原子序数依次增大,它们的原子最外层电子数之和为13,Ⅹ的原子半径比Y的小,W与X同族,用惰性电极电解一种常见的无色无味液体可得到X和Z元素的单质。下列说法正确的是( )A、由X、Y、Z三种元素形成的化合物中只含有共价键 B、X与W可形成一种二元离子化合物 C、Y的简单氢化物的热稳定性比Z的强 D、Y、Z、W的简单离子的电子层结构相同,其中Z的离子半径最小5. 设NA为阿伏加德罗常数的值,则下列说法正确的是( )A、18gD2O和18gH2O中含有的质子数均为10NA B、0.1mol·L-1的NaCl溶液中含有的Na+的数目为0.1NA C、11.2LCO2中含有的分子数为0.5NA D、标准状况下,5.6LCO2与足量Na2O2反应转移的电子数为0.25NA6. 一种“全氢电池”的工作原理如图所示。下列说法正确的是( )
加热氢氧化钠固体
4. X、Y、Z、W均为短周期主族元素且原子序数依次增大,它们的原子最外层电子数之和为13,Ⅹ的原子半径比Y的小,W与X同族,用惰性电极电解一种常见的无色无味液体可得到X和Z元素的单质。下列说法正确的是( )A、由X、Y、Z三种元素形成的化合物中只含有共价键 B、X与W可形成一种二元离子化合物 C、Y的简单氢化物的热稳定性比Z的强 D、Y、Z、W的简单离子的电子层结构相同,其中Z的离子半径最小5. 设NA为阿伏加德罗常数的值,则下列说法正确的是( )A、18gD2O和18gH2O中含有的质子数均为10NA B、0.1mol·L-1的NaCl溶液中含有的Na+的数目为0.1NA C、11.2LCO2中含有的分子数为0.5NA D、标准状况下,5.6LCO2与足量Na2O2反应转移的电子数为0.25NA6. 一种“全氢电池”的工作原理如图所示。下列说法正确的是( )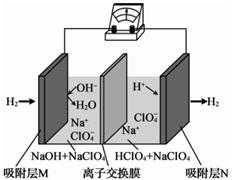 A、电流方向是从吸附层M通过导线到吸附层N B、离子交换膜可阻止左边的碱性溶液和右边的酸性溶液发生中和 C、Na+从右边穿过离子交换膜向左边移动 D、正极的电极反应是H2-2e-+2OH-=2H2O7. 下列实验设计不能达到实验目的的是( )
A、电流方向是从吸附层M通过导线到吸附层N B、离子交换膜可阻止左边的碱性溶液和右边的酸性溶液发生中和 C、Na+从右边穿过离子交换膜向左边移动 D、正极的电极反应是H2-2e-+2OH-=2H2O7. 下列实验设计不能达到实验目的的是( )实验目的
实验设计
A
比较Al2O3和Al的熔点
铝箔在酒精灯火焰上加热熔化但不滴落
B
检验NaHCO3与Na2CO3溶液
用小试管分别取少量溶液,然后滴加澄清石灰水
C
证明Na2O2与CO2是放热反应
Na2O2用棉花包裹,放入充满CO2的集气瓶中,棉花燃烧说明是放热反应
D
证明Cl2没有漂白性,HClO有漂白性
将Cl2依次通过干燥的有色布条和湿润的有色布条
A、A B、B C、C D、D二、工业流程
-
8. 氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,实验室制备少量Mg(ClO3)2·6H2O的流程如下:

已知:
①卤块的主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质
②四种化合物的溶解度(S)随温度(T)变化的曲线如图所示。
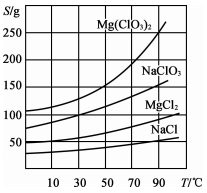
回答下列问题:
(1)、过滤所需要的主要玻璃仪器有。(2)、加入BaCl2溶液的目的是 , 加MgO后过滤所得滤渣的主要成分为(写化学式)(3)、加入NaClO3饱和溶液后发生反应的化学方程式为。再进一步制取Mg(ClO3)2·6H2O的实验步骤依次为:①蒸发结晶,② , ③将滤液冷却结晶,④过滤、洗涤。(4)、产品中Mg(ClO3)2·6H2O含量的测定[已知Mg(ClO3)2·6H2O的摩尔质量为299g·mol-1]。步骤1:准确称量3.50g产品配成100mL溶液。
步骤2:取出10.00mL溶液于锥形瓶中,加入10.00mL稀硫酸和21.00mL.1.000mol·L-1的FeSO4溶液,微热。
步骤3:冷却至室温,用0.100mol·L-1K2Cr2O7溶液滴定剩余的Fe2+至终点[发生的反应为Cr2O72-+Fe2++H+→Cr3++Fe3++H2O(未配平)]
步骤4:将步骤2、3重复两次,平均消耗K2Cr2O7溶液15.00mL
步骤2中发生反应的离子方程式为。该样品中Mg(ClO3)2·6H2O的纯度为(保留两位有效数字)。
三、综合题
-
9. 掺杂硒的纳米氧化亚铜常用作光敏材料、能源行业催化剂等。(1)、酸性溶液中Na2SO3将H2SeO3和H2SeO4还原为硒单质的反应如下:
H2SeO3(aq)+2SO2(g)+H2O(l)=Se(s)+2H2 SO4(aq) △H1
2H2SeO4(aq)+Se(s)+ H2O (l)=3H2SeO3(ag) △H2
H2SeO4(aq)+ 3SO2(g)+2H2 O(l)=Se(s)+3H2 SO4 (aq) △H3
则△H2=(用△H1和△H3表示)。
(2)、H2S与CO2在纳米Cu2O催化作用下反应可生成羰基硫(COS),羰基硫的结构式为。(3)、用铜作阳极,钛片作阴极,电解一定浓度的NaCl和NaOH的混合溶液可得到Cu2O,阳极及溶液中物质的有关转化如图1所示。
①阳极的电极反应式为。
②电解一段时间后,向电解液中补充一定量的可将溶液恢复至初始状态。
(4)、掺杂硒的纳米Cu2O催化剂可用于工业上合成甲醇:CO(g)+2H2(g) CH3OH(g) △H=akJ·mol-1。
按 的投料比将H2与CO充人VL的恒容密闭容器中,在一定条件下发生反应,测定CO的平衡转化率与温度、压强的关系如图2所示。
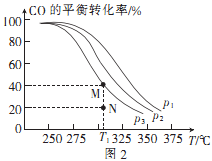
①a(填“>”或”<”)0;压强p1、p2、p 3由小到大的顺序是。
②T1℃时,若向该容器中充入2.0mol H2和2.0 mol CO发生上述反应,5min后反应达到平衡(M点),则0~5min内,v(H2)=mol·L-1·min-1 , N点对应条件下反应的平衡常数为。
10. 翡翠的主要成分为 NaAlSi2O6 , 还含有其他多种金属阳离子,其中Cr3+的含量决定其绿色的深浅。(1)、NaAlSi2O6所含元素中,第一电离能最小的元素和电负性最大的元素组成的含有两种化学键的化合物是(写化学式)(2)、基态Cr3+的核外电子排布式为。(3)、配合物K[Cr(C2O4)2(H2O)中的配体是 , C2O42-中碳原子的杂化轨道类型是 , 与H2O互为等电子体的离子是(任写一种)(4)、一种铝镍合金的晶胞结构如图所示,与其结构相似的化合物是(填标号)。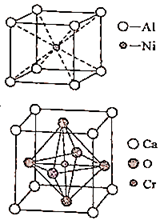
a.氟化钙
b.金刚石
c.钠
d.氯化铯
(5)、Ca、O、Gr可以形成一种具有特殊导电性的复合氧化物,晶胞结构如图所示,其中Ca2+ , O2-采用面心立方最密堆积方式。①该晶体的化学式为。
②已知钙离子、氧离子半径分别为100pm、140pm,该晶胞的参数(边长)为pm。
③阿伏加德罗常数的值为NA , 该晶体密度的计算表达式为g·cm-3;晶胞中Cr4+位于O2-所形成的正八面体的体心,该正八面体的边长为pm。
四、实验题
-
11. 亚硝酸钠(NaNO2)在漂白、电镀等方面应用广泛。以木炭浓硝酸、水和铜为原料制备亚硝酸钠的装置如图所示:
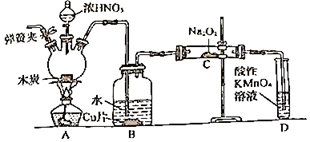
已知:
室温下,①2NO+Na2O2=2NaNO2
②3NaNO2+3HCl=3NaCl+HNO3+2NO↑+H2O
③酸性条件下,NO或NO2ˉ都能与MnO4ˉ反应生成NO3ˉ和Mn2+
回答下列问题:
(1)、检查完该装置的气密性,装入药品后,实验开始前通入一段时间N2 , 然后关闭弹簧夹,再滴加浓硝酸,加热。通入N2的作用是。(2)、装置B中观察到的主要现象为 , 发生反应离子方程式是。(3)、装置D的作用是 , 发生反应的离子方程式是。(4)、预测C中反应开始阶段,固体产物除NaNO2外,还含有的副产物有Na2CO3和(写化学式)。为避免产生这些副产物,应在装置B、C间增加干燥管,则干燥管中盛放的试剂为(写名称)。(5)、利用改进后的装置将3.12gNa2O2完全转化为NaNO2 , 理论上至少需要木炭g五、计算题
-
12. 肉桂酸甲酯在医药工业中可作为有机合成的中间体,其中一种合成路线如下:

已知:①烃A是最简单的烯烃
②醛与醛能在一定条件下反应,原理如下:

回答下列问题:
(1)、烃A的结构简式为。(2)、反应③的试剂和反应条件为;反应⑩的试剂和反应条件为;反应⑧的反应试剂(填“能”或“不能”)改用酸性高锰酸钾溶液,其原因是。(3)、反应⑦的反应类型为。(4)、H与银氨溶液反应的化学方程式为。(5)、符合下列条件的I的同分异构体共有种。①除苯环外不含有其他环状结构;②能发生水解反应和银镜反应。
其中核磁共振氢谱显示为5组峰,且峰面积比为1:1:2:2:2的是(写结构简式)
-
-