福建省三明市2018-2019学年高三上学期化学期末考试试卷
试卷更新日期:2019-12-24 类型:期末考试
一、单选题
-
1. 化学与人类生产、生活密切相关,下列说法正确的是( )A、医用酒精、次氯酸钠等消毒液均可以将病毒氧化而达到消毒的目的 B、铁粉和生石灰均可作食品袋内的脱氧剂 C、纯银器表面在空气中逐渐变暗,是发生了化学腐蚀 D、聚乙烯、聚氯乙烯塑料制品均可用于食品包装2. 晋代《抱扑子》中记载“丹砂(HgS)烧之成水银,积变又还成丹砂”。以上变化中没有涉及的反应类型是( )A、分解反应 B、置换反应 C、化合反应 D、氧化还原反应3. 下列有关实验操作的说法中正确的是( )A、用CCl4萃取碘水中的碘单质,振荡过程中需进行放气操作 B、用容量瓶配制溶液,定容时仰视刻度线,所配溶液浓度偏高 C、用碱式滴定管量取25.00mL溴水 D、用pH试纸测得氯水的pH为24. “三效催化转化器”可将汽车尾气中的有毒气体转化为无污染的气体,下图为该反应的微观示意图(末配平),其中不同符号的球代表不同种原子。下列说法错误的是( )
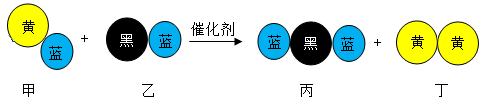 A、该反应属于氧化还原反应 B、配平后甲、乙、丙的化学计量数均为2 C、甲和丙中同种元素化合价不可能相同 D、丁物质一定是非金属单质5. 设NA为阿伏加德罗常数的值,下列说法正确的是( )A、常温常压下,16gO2和O3混合气体中含有氧原子数为NA B、标准状况下,44.8三氯甲烷含有的分子数为2NA C、0.1mol·L-1氯化铝溶液中含有Al3+数为0.1NA D、标准状况下,22.4LO2作氧化剂时转移电子数一定为4NA6. 下列有关离子检验的方法正确的是( )A、加入硝酸银溶液,产生白色沉淀,原溶液中一定含有Cl- B、加入氢氧化钠溶液立即有白色沉淀产生,原溶液中一定含有Al3+ C、加入稀盐酸,产生能使澄清石灰水变浑浊的气体,原溶液中一定含有CO32- D、加入稀盐酸无现象,再加入氯化钡溶液有白色沉淀产生,原溶液中一定含有SO42-7. 常温下,下列各组离子在指定溶液中可能大量共存的是( )A、加酚酞呈浅红色的溶液中:Ba2+、K+、HCO3-、NO3- B、由水电离出的c(H+)=1×10-13mol/L的溶液中:Ca2+、Na+、Cl-、HS- C、加入铝粉能放出氢气的溶液中:Mg2+、Fe3+、Cl-、NO3- D、无色透明的溶液中:Al3+、Cu2+、SiO32-、CH3COO-8. 氮化铝(AlN)是一种新型无机非金属材料,常温下可与烧碱溶液发生反应:AlN+NaOH+3H2O=NaAl(OH)4+NH3↑。某课题小组利用甲图所示装置测定样品中AlN的含量(杂质不反应,量气管为碱式滴定管改造)。下列说法正确的是( )
A、该反应属于氧化还原反应 B、配平后甲、乙、丙的化学计量数均为2 C、甲和丙中同种元素化合价不可能相同 D、丁物质一定是非金属单质5. 设NA为阿伏加德罗常数的值,下列说法正确的是( )A、常温常压下,16gO2和O3混合气体中含有氧原子数为NA B、标准状况下,44.8三氯甲烷含有的分子数为2NA C、0.1mol·L-1氯化铝溶液中含有Al3+数为0.1NA D、标准状况下,22.4LO2作氧化剂时转移电子数一定为4NA6. 下列有关离子检验的方法正确的是( )A、加入硝酸银溶液,产生白色沉淀,原溶液中一定含有Cl- B、加入氢氧化钠溶液立即有白色沉淀产生,原溶液中一定含有Al3+ C、加入稀盐酸,产生能使澄清石灰水变浑浊的气体,原溶液中一定含有CO32- D、加入稀盐酸无现象,再加入氯化钡溶液有白色沉淀产生,原溶液中一定含有SO42-7. 常温下,下列各组离子在指定溶液中可能大量共存的是( )A、加酚酞呈浅红色的溶液中:Ba2+、K+、HCO3-、NO3- B、由水电离出的c(H+)=1×10-13mol/L的溶液中:Ca2+、Na+、Cl-、HS- C、加入铝粉能放出氢气的溶液中:Mg2+、Fe3+、Cl-、NO3- D、无色透明的溶液中:Al3+、Cu2+、SiO32-、CH3COO-8. 氮化铝(AlN)是一种新型无机非金属材料,常温下可与烧碱溶液发生反应:AlN+NaOH+3H2O=NaAl(OH)4+NH3↑。某课题小组利用甲图所示装置测定样品中AlN的含量(杂质不反应,量气管为碱式滴定管改造)。下列说法正确的是( ) A、量气管中的液体应为水 B、用长颈漏斗代替分液漏斗,有利于控制反应速率 C、反应结束时,a、b两管液面的差值即为产生气体的体积 D、若其它操作均符合题意,实验结束时按乙图读数,测得AlN含量偏高9. 下列实验操作、现象和结论均正确的是( )
A、量气管中的液体应为水 B、用长颈漏斗代替分液漏斗,有利于控制反应速率 C、反应结束时,a、b两管液面的差值即为产生气体的体积 D、若其它操作均符合题意,实验结束时按乙图读数,测得AlN含量偏高9. 下列实验操作、现象和结论均正确的是( )实验操作
现象
结论
A
将少量某酸(HA)溶液滴入碳酸钠溶液中
无气泡
酸性:H2CO3>HA
B
将浸透石蜡油的石棉和碎瓷片放入硬质玻璃管,加强热,将生成的气体通入酸性高锰酸钾溶液
高锰酸钾溶液褪色
石蜡油裂解生成不饱和烃
C
向蔗糖溶液中加入稀硫酸并水浴加热,一段时间后再向混合液中加入新制Cu(OH)2悬浊液并煮沸
无砖红色沉淀
蔗糖未水解
D
在1mL相同浓度的碳酸钠和硫酸钠溶液中,分别滴加2滴0.1mo1/L AgNO3溶液
碳酸钠溶液中出现沉淀
Ksp(Ag2SO4)<
Ksp (Ag2CO3)
A、A B、B C、C D、D10. 下列实验装置能达到实验目的的是( ) A、用甲装置比较碳、氮和硅三种元素的非金属性强弱 B、用乙装置分离碘的四氯化碳溶液 C、用丙装置制取干燥的氨气 D、用丁装置吸收氨气,并防止倒吸11. 下列关于有机物的说法正确的是( )A、苯与溴水可发生加成反应 B、完全燃烧时,等质量的甲烷比乙烷耗氧量大 C、糖类、油脂和蛋白质都可水解 D、实验式为CH2O的有机物一定属于糖类12. 工业生产苯乙烯是利用乙苯的脱氢反应:
A、用甲装置比较碳、氮和硅三种元素的非金属性强弱 B、用乙装置分离碘的四氯化碳溶液 C、用丙装置制取干燥的氨气 D、用丁装置吸收氨气,并防止倒吸11. 下列关于有机物的说法正确的是( )A、苯与溴水可发生加成反应 B、完全燃烧时,等质量的甲烷比乙烷耗氧量大 C、糖类、油脂和蛋白质都可水解 D、实验式为CH2O的有机物一定属于糖类12. 工业生产苯乙烯是利用乙苯的脱氢反应: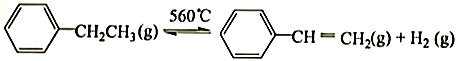
下列说法错误的是( )
A、该反应的逆反应属于还原反应 B、苯乙烯和乙苯都至少有7个碳原子共面 C、乙苯的一氯代物有3种 D、煤的干馏可以得到苯和乙苯13. 下列对三种有机物的叙述错误的是( ) A、三种有机物都是芳香族化合物 B、阿司匹林在酸中水解生成2种含羧基的物质 C、麻黄碱的分子式是C10H13NO D、芬太尼可发生取代、加成、氧化反应14. 现有W、X、Y、Z四种短周期元素,W分别与X、Y、Z结合生成甲、乙、丙三种化合物,且每个甲、乙、丙分子中均含10个电子,Y和Z化合生成丁,有关物质的转化关系如下图所示。下列说法错误的是( )
A、三种有机物都是芳香族化合物 B、阿司匹林在酸中水解生成2种含羧基的物质 C、麻黄碱的分子式是C10H13NO D、芬太尼可发生取代、加成、氧化反应14. 现有W、X、Y、Z四种短周期元素,W分别与X、Y、Z结合生成甲、乙、丙三种化合物,且每个甲、乙、丙分子中均含10个电子,Y和Z化合生成丁,有关物质的转化关系如下图所示。下列说法错误的是( ) A、原子序数由小到大的顺序是:W<Z<Y<X B、Z的最高价氧化物对应的水化物一定为强酸 C、化合物的沸点由高到低的顺序是:乙>甲>丙 D、Y与W、Z都能形成两种或两种以上的化合物15. 利用工业废碱渣(主要成分Na2CO3)吸收硫酸厂尾气中的SO2制备无水Na2SO3的流程如下:
A、原子序数由小到大的顺序是:W<Z<Y<X B、Z的最高价氧化物对应的水化物一定为强酸 C、化合物的沸点由高到低的顺序是:乙>甲>丙 D、Y与W、Z都能形成两种或两种以上的化合物15. 利用工业废碱渣(主要成分Na2CO3)吸收硫酸厂尾气中的SO2制备无水Na2SO3的流程如下: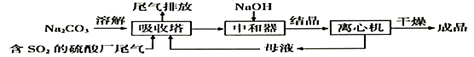
下列说法错误的是( )
A、向大气中排放SO2可能导致酸雨发生 B、中和器中发生反应的离子方程式为HSO3-+OH-=SO32-+H2O C、进入离心机的分散系是悬浊液 D、检验Na2SO3成品中是否含Na2SO4 , 可选用稀盐酸和Ba(NO3)2溶液16. 下列反应的离子方程式正确的是( )A、将SO2气体通入NaClO溶液中:SO2+2ClO-+H2O=SO32-+2HClO B、向明矾溶液中滴加Na2S溶液:2Al3++3S2-=Al2S3↓ C、向KHSO4溶液中加入Ba(OH)2溶液至中性:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O D、NH4HCO3溶液与过量NaOH溶液反应:NH4++OH-=NH3·H2O17. 在一密闭的容器中充入2molA和1molB发生反应:2A(g)+B(g) xC(g),达到平衡后,C的体积分数为w%;若维持容器的容积和温度不变,按起始物质的量A:0.6mol、B:0.3mol、C:1.4mo1充入容器,达到平衡后,C的体积分数仍为w%,则x的值为( )A、2 B、3 C、2或3 D、无法确定18. 已知:N2O4(g) 2NO2(g) △H=+QkJ/mol (Q>0),80℃时在2L密闭容器中充入0.40 mol N2O4 , 发生反应获得如下数据:时间/s
0
20
40
60
80
100
c(NO2)/mol/L
0.00
0.12
0.20
0.26
0.30
0.30
下列判断正确的是( )
A、升高温度会使混合气体的颜色变浅 B、反应达平衡时,吸收的热量为0.30Q kJ C、20~40s内,v(N2O4)=0.004mol/(L·s) D、100s时再充入0.40mo1N2O4 , 达到新平衡时N2O4的转化率增大19. 某课题组以纳米Fe2O3 作为电极材料制备锂离子电池(另一极为金属锂和石墨的复合材料),通过在室温条件下对锂离子电池进行循环充放电,成功地实现了对磁性的可逆调控(如图)。以下说法正确的是( ) A、放电时,正极的电极反应式为Fe2O3+6Li++6e-=2Fe+3Li2O B、该电池可以用水溶液做电解质溶液 C、放电时,Fe作电池的负极,Fe2O3作电池的正极 D、充电时,电池被磁铁吸引20. 下列图示与对应的叙述相符的是( )
A、放电时,正极的电极反应式为Fe2O3+6Li++6e-=2Fe+3Li2O B、该电池可以用水溶液做电解质溶液 C、放电时,Fe作电池的负极,Fe2O3作电池的正极 D、充电时,电池被磁铁吸引20. 下列图示与对应的叙述相符的是( )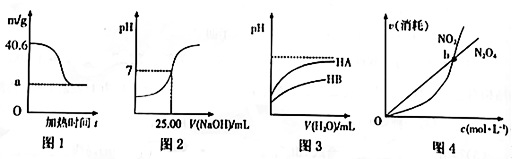 A、若图1表示0.2mo1MgCl2·6H2O在空气中充分加热时固体质量随时间的变化,则a为19.0 B、若图2表示常温下用0.1000mo1/L NaOH溶液滴定25.00mL CH3COOH溶液的滴定曲线,则c(CH3COOH)=0.1000mo1/L C、若图3表示常温下稀释HA,HB两种酸的稀溶液时,溶液pH随加水量的变化,则常温下,NaA溶液的pH小于同浓度的NaB溶液的pH D、若图4表示恒温恒容条件下,反应2NO2(g) N2O4(g)中,各物质的浓度与其消耗速率之间的关系,则b点对应的状态为化学平衡状态21. 下图是某元素的价类二维图,其中X是一种强碱,A为正盐,通常条件下Z是无色液体,D的相对分子质量比E小16,各物质转化关系如图所示。下列说法正确的是( )
A、若图1表示0.2mo1MgCl2·6H2O在空气中充分加热时固体质量随时间的变化,则a为19.0 B、若图2表示常温下用0.1000mo1/L NaOH溶液滴定25.00mL CH3COOH溶液的滴定曲线,则c(CH3COOH)=0.1000mo1/L C、若图3表示常温下稀释HA,HB两种酸的稀溶液时,溶液pH随加水量的变化,则常温下,NaA溶液的pH小于同浓度的NaB溶液的pH D、若图4表示恒温恒容条件下,反应2NO2(g) N2O4(g)中,各物质的浓度与其消耗速率之间的关系,则b点对应的状态为化学平衡状态21. 下图是某元素的价类二维图,其中X是一种强碱,A为正盐,通常条件下Z是无色液体,D的相对分子质量比E小16,各物质转化关系如图所示。下列说法正确的是( )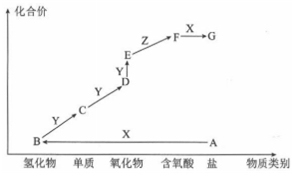 A、A是可与草木灰混合使用的肥料 B、C可用排空气法收集 C、F和B能发生复分解反应生成盐 D、B在一定条件下可直接与Y反应生成D22. 常温下,用0.1000mol/L的AgNO3溶液滴定50.00mL0.0500mol/LKCl溶液,以K2CrO4为指示剂,测得溶液中pCl=-1gc(Cl-)、pAg=-lgc(Ag+)随加入AgNO3溶液的体积变化如图所示。已知:Ksp(Ag2CrO4)=2.0×10-12 , Ksp(Ag2SO4)=1.4×10-5 , 溶液中离子浓度小于或等于1.0×10-5mol/L则沉淀完全,下列说法错误的是( )
A、A是可与草木灰混合使用的肥料 B、C可用排空气法收集 C、F和B能发生复分解反应生成盐 D、B在一定条件下可直接与Y反应生成D22. 常温下,用0.1000mol/L的AgNO3溶液滴定50.00mL0.0500mol/LKCl溶液,以K2CrO4为指示剂,测得溶液中pCl=-1gc(Cl-)、pAg=-lgc(Ag+)随加入AgNO3溶液的体积变化如图所示。已知:Ksp(Ag2CrO4)=2.0×10-12 , Ksp(Ag2SO4)=1.4×10-5 , 溶液中离子浓度小于或等于1.0×10-5mol/L则沉淀完全,下列说法错误的是( )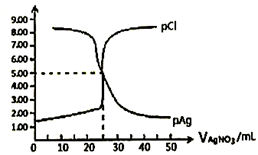 A、Ag2CrO4沉淀一定不是白色 B、AgCl的溶度积常数Ksp数量级为10-10 C、Cl-恰好完全沉淀时,指示剂的浓度应维持在2.0×10-2mol/L D、加入50 mLAgNO3溶液后再加入1mL0.01mol/LH2SO4会产生新的沉淀
A、Ag2CrO4沉淀一定不是白色 B、AgCl的溶度积常数Ksp数量级为10-10 C、Cl-恰好完全沉淀时,指示剂的浓度应维持在2.0×10-2mol/L D、加入50 mLAgNO3溶液后再加入1mL0.01mol/LH2SO4会产生新的沉淀二、综合题
-
23.(1)、I.二甲醚(CH3OCH3)被称为21世纪的新型燃料,工业上以CO和H2为原料生产二甲醚。已知:
①CO(g)+2H2(g) CH3OH(g) △H=-99kJ/mol
②2CH3OH(g) CH3OCH3(g)+H2O(g) △H=-24 kJ/mol
③CO(g)+H2O(g) H2(g)+CO2(g) △H=-41 kJ/mol
反应4H2(g)+2CO(g) CH3OCH3(g)+H2O(g)的△H=。
(2)、某温度下,将4.0molH2和4.0molCO充入容积为1L的密闭容器中,发生反应3CO(g)+3H2(g) CH3OCH3(g)+CO2(g),5min时CO2的物质的量浓度为0.5mol/L,10min后反应达到平衡状态,测得二甲醚的体积分数为25%。①5min时CO的转化率=;
②该温度下此反应的平衡常数K=;
③下列措施能提高 CH3OCH3平衡产率的有(填标号)。
A.分离出 CH3OCH3 B.升高温度 C.增大压强 D.改用高效催化剂
(3)、Ⅱ.液氨是一种良好的储氢物质已知:2NH3(g) N2(g)+3H2(g) △H=+92.4 kJ/mol
其他条件相同时,反应在不同金属催化剂作用下进行相同时间后,氨的转化率[a(NH3)]随反应温度的变化情况如图所示。
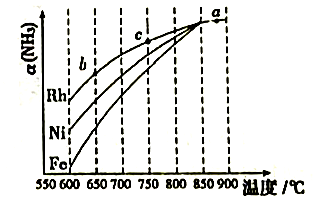
用作催化剂时,氨气分解反应的活化能最大。
(4)、a点所代表的状态(填“是”或“不是”)平衡状态。(5)、c点时NH3的转化率高于b点时NH3的转化率,原因是。24. 氮族元素在化学领域具有重要的地位。请回答下列问题:(1)、基态氮原子的价电子轨道表示式为;第二周期的元素中,第一电离能介于B和N之间的元素有种。(2)、雌黄的分子式为As2S3 , 其分子结构如图所示: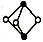 As原子的杂化类型为。 (3)、①向CuSO4溶液中加入少量氨水生成蓝色沉淀,继续加入氨水沉淀溶解,得到深蓝色透明溶液,向该溶液中加入一定量的乙醇,析出[Cu(NH3)4]SO4·H2O固体。SO42-的空间构型为;[Cu(NH3)4]SO4·H2O固体中含有的化学键有(填标号)。
As原子的杂化类型为。 (3)、①向CuSO4溶液中加入少量氨水生成蓝色沉淀,继续加入氨水沉淀溶解,得到深蓝色透明溶液,向该溶液中加入一定量的乙醇,析出[Cu(NH3)4]SO4·H2O固体。SO42-的空间构型为;[Cu(NH3)4]SO4·H2O固体中含有的化学键有(填标号)。A.离子键 B.共价键 C.氢键 D.金属键 E.配位键
若要确定[Cu(NH3)4]SO4·H2O是晶体还是非晶体,最科学的方法是进行实验。
②已知NF3与NH3分子的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,原因是。
(4)、大π键可用 表示,其中n、m分别代表参与形成大π键的原子个数和电子数,如苯分子中大π键表示为 。N2O分子中的大π键表示为。(5)、立方氮化硼晶胞如图,其密度为ρg/cm3 , 氮化硼的摩尔质量为Mg/mol,阿伏加德罗常数的值为NA , 硼原子的半径为r cm,则硼原子的空间占有率为(用含有ρ、M、NA、r的代数式表示)。 25. 3,4-二羟基肉桂酸(G)具有止血升白细胞功效,用于肿瘤患者的术后恢复,其合成路线如下:
25. 3,4-二羟基肉桂酸(G)具有止血升白细胞功效,用于肿瘤患者的术后恢复,其合成路线如下: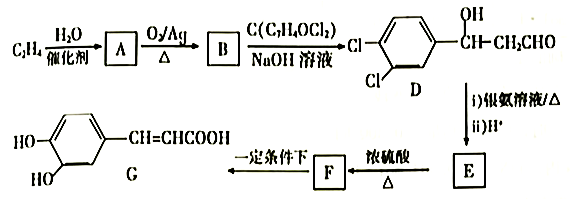
已知:
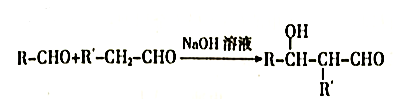
回答下列问题:
(1)、A的名称为 , F中含氧官能团的名称是。(2)、由B生成D的化学方程式为 , 生成F的反应类型为。(3)、下列说法正确的是(填标号)。a.乙烯在一定条件下与水发生取代反应生成A
b.F能使酸性高锰酸钾溶液褪色
c.1molG最多能和3 mol Br2反应
d.1个G分子中最多有9个碳原子共平面
(4)、H是G的芳香族同分异构体,1moH与足量碳酸氢钠溶液反应生成2 mol CO2 , 则H的结构有种。其中,核磁共振氢谱有4组吸收峰,且峰面积比为1:2:2:3的结构简式为(写一种即可)。(5)、写出以甲醇、B为原料合成C5H12O4(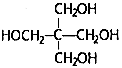 )的路线(无机试剂任选)
)的路线(无机试剂任选) 三、工业流程
-
26. 氯化亚铜(CuCl)在化工、印染、电镀等行业应用广泛。CuCl微溶于水,不溶于醇和稀酸,可溶于Cl-浓度较大的溶液,在潮湿空气中易水解氧化。以海绵铜(主要成分是Cu和少量CuO)为原料,采用硝酸铵氧化分解技术生产CuCl的工艺过程如图所示:
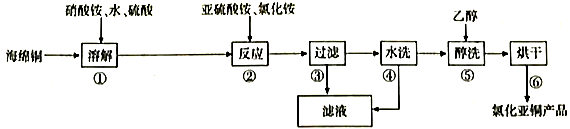
回答下列问题:
(1)、步骤①中N元素被还原为最低价,写出此反应的离子方程式。(2)、步骤②中,亚硫酸铵要略保持过量,原因是 , 滤液中可循环利用的物质是。(3)、步骤⑤中,醇洗的目的是。(4)、常用K2Cr2O7溶液测定氯化亚铜样品纯度(假设杂质不参与反应),步骤如下:准确称取所制备的氯化亚铜样品10.00g,将其置于过量的FeCl2溶液中,待样品完全溶解后,加入适量稀硫酸配成100mL溶液,取溶液10.00mL用0.1000mol·L K2Cr2O7溶液进行滴定,反应中Cr2O72-被还原成Cr3+ , 相关数据记录如下表所示:实验编号
1
2
3
消耗K2Cr2O7溶液的体积/mL
14.98
16.03
15.02
该样品中CuCl的质量分数。(保留4位有效数字)
(5)、制造印刷电路板产生的废液中含大量[Cu(NH3)4]2+等离子,利用膜电解技术对此废液进行电解,电解装置如下图所示。电解后的阴极液中加入适量盐酸并用水稀释可得到CuCl,电解时阴极的电极反应式为 , 生成CuCl的离子方程式为。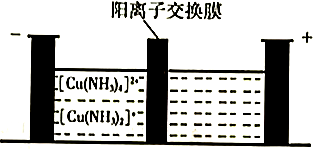
四、实验题
-
27. 某化学兴趣小组同学对于生活中流传的“吃菠菜补铁”之说产生兴趣,设计实验进行相关探究。检索文献表明,菠菜中的铁元素以草酸亚铁的形式存在,草酸亚铁是一种淡黄色难溶于水的晶体。(1)、I.菠菜中铁元素含量的测定
取100g洗净晾干的新鲜菠菜,切碎后装入中,放入烘箱烧成灰烬。
(2)、将灰烬用25mL 2mol/L硫酸溶液溶解,加热煮沸一分钟,过滤后滴加适量H2O2溶液并稀释至100mL,取2mL加入5滴KSCN溶液。H2O2用量不可过大,否则溶液将先变红后褪色,褪色的原因是。(3)、取不同浓度的[填“(NH4)2Fe(SO4)2”或“NH4Fe(SO4)2”]标准溶液各2mL,分别滴加5滴KSCN溶液,发现与步骤(2)中溶液颜色最接近的标准溶液浓度为0.4×10-3mol/L。(4)、经计算可得,每100g新鲜菠菜中含有铁元素的质量约为 mg(保留1位有效数字),按人体5%吸收率,为满足每日20mg的铁元素需求,每天需要吃菠菜kg。(5)、Ⅱ.草酸亚铁晶体(FeC2O4·nH2O)的分解实验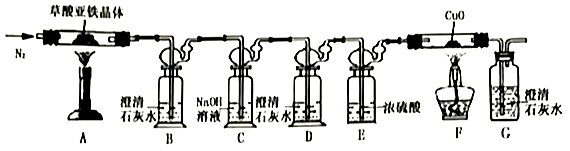
从环保角度考虑,该套实验装置的明显缺陷是。
(6)、实验开始后,装置B中出现浑浊证明分解产物中存在CO的现象是;将充分反应后的固体残余物投入经煮沸的稀硫酸中,固体完全溶解且无气体放出,取反应液加入KSCN溶液无血红色。(7)、称取7.2g草酸亚铁晶体放入装置A硬质玻璃管中,加热后(假设各步骤反应完全),测得装置A硬质玻璃管中残余固体2.88g,装置F硬质玻璃管中固体质量减轻0.64g,则草酸亚铁晶体分解的化学方程式为。
-