河北省衡水市景县2019-2020学年九年级上学期化学第二次月考试卷
试卷更新日期:2019-12-21 类型:月考试卷
一、选择题(每小题2分,共50分)
-
1. 下列物质属于合金的是( )A、铁矿石 B、不锈钢 C、铁锈 D、大理石2. 把少量生活中的物质分别放入水中,充分搅拌,可以得到溶液的是( )A、面粉 B、牛奶 C、蔗糖 D、植物油3. 下列有关燃烧和爆炸的图标中,表示“禁止烟火”的是( )A、
 B、
B、 C、
C、 D、
D、 4. 能使煤燃烧更充分的措施是()A、充分利用热能 B、煤块碾成粉末 C、减少空气通入量 D、净化处理尾气5. 下列推理正确的是( )A、点燃气体将干冷的烧杯罩在火焰上烧杯内壁有水珠则气体中一定含H2 B、将混合气体通入足量的澄清石灰水中,无浑浊现象则原气体中一定不含CO2 C、通过灼热氧化铜后的气体能使澄清石灰水变浑浊,则原气体中一定有一氧化碳 D、灼热的氧化铜中通入氢气后变成了红色,说明此反应是还原反应6. 成语“釜底抽薪"的本意包含着灭火的原理下列灭火方法也依据这个原理的是( )A、油锅中的油着火用锅盖盖灭 B、砍掉树木形成隔离带 C、消防队员用高压水枪灭火 D、用二氧化碳灭火器进行灭火7. 如图是探究燃烧条件的实验,有关该实验的说法错误的是( )
4. 能使煤燃烧更充分的措施是()A、充分利用热能 B、煤块碾成粉末 C、减少空气通入量 D、净化处理尾气5. 下列推理正确的是( )A、点燃气体将干冷的烧杯罩在火焰上烧杯内壁有水珠则气体中一定含H2 B、将混合气体通入足量的澄清石灰水中,无浑浊现象则原气体中一定不含CO2 C、通过灼热氧化铜后的气体能使澄清石灰水变浑浊,则原气体中一定有一氧化碳 D、灼热的氧化铜中通入氢气后变成了红色,说明此反应是还原反应6. 成语“釜底抽薪"的本意包含着灭火的原理下列灭火方法也依据这个原理的是( )A、油锅中的油着火用锅盖盖灭 B、砍掉树木形成隔离带 C、消防队员用高压水枪灭火 D、用二氧化碳灭火器进行灭火7. 如图是探究燃烧条件的实验,有关该实验的说法错误的是( )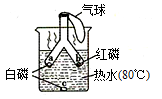 A、实验中a、c处的现象说明燃烧需要氧气参与 B、实验中a、b处的现象说明燃烧需要达到可燃物的着火点 C、a处白磷燃着后很快熄灭,原因是管内产生了二氧化碳气体 D、管口小气球的使用体现实验绿色化8. 为制得太阳能料(合成气),科学家用镍基催化剂设计了如下转化过程。下列有关说法不正确的是( )
A、实验中a、c处的现象说明燃烧需要氧气参与 B、实验中a、b处的现象说明燃烧需要达到可燃物的着火点 C、a处白磷燃着后很快熄灭,原因是管内产生了二氧化碳气体 D、管口小气球的使用体现实验绿色化8. 为制得太阳能料(合成气),科学家用镍基催化剂设计了如下转化过程。下列有关说法不正确的是( ) A、反应①的化学方程式为CH4+O2=CO2+H2O B、镍基催化剂在反应前后化学性质不变 C、太阳能代料主要成分是CO和H2 D、上述反应前后元素种类不变9. 下列有关金属材料的说法正确的是( )A、硬铝片比纯铝片硬度小 B、钢的性能优良,是很纯的铁 C、沙漠地区的铁制品锈蚀较快 D、为防止钢铁生锈要,可在其表面涂油10. 某合金与铁的物理性质比较如下熔点:某合金为250℃,铁为1535℃;密度:某合金为3.00g/cm3 , 铁为7.86g/m3;硬度(以金刚石的硬度为10作为标准):某合金为7.4,铁为4.5;导电性(以银的导电性为100作为标准)某合金为2.3,铁为17。还已知某合金耐腐蚀、强度大。根据以上信息你认为该合金适合用作( )A、导线 B、保险丝 C、飞机外壳 D、门窗框11. 被雨水淋湿的自行车,应( )A、先用布擦干,再用带油的布擦拭车链等部位 B、在自行车表面刷一层油漆 C、用布擦干即可 D、晾干后,用盐酸除去锈层12. 现有甲、乙、丙三种金属,用将其中的一种金属分别放入另外两种金属的硫酸盐溶液中的方法进行实验,得到三种金属间的转化关系(如图所示)则三种金属的活动性由强到弱的顺序是( )
A、反应①的化学方程式为CH4+O2=CO2+H2O B、镍基催化剂在反应前后化学性质不变 C、太阳能代料主要成分是CO和H2 D、上述反应前后元素种类不变9. 下列有关金属材料的说法正确的是( )A、硬铝片比纯铝片硬度小 B、钢的性能优良,是很纯的铁 C、沙漠地区的铁制品锈蚀较快 D、为防止钢铁生锈要,可在其表面涂油10. 某合金与铁的物理性质比较如下熔点:某合金为250℃,铁为1535℃;密度:某合金为3.00g/cm3 , 铁为7.86g/m3;硬度(以金刚石的硬度为10作为标准):某合金为7.4,铁为4.5;导电性(以银的导电性为100作为标准)某合金为2.3,铁为17。还已知某合金耐腐蚀、强度大。根据以上信息你认为该合金适合用作( )A、导线 B、保险丝 C、飞机外壳 D、门窗框11. 被雨水淋湿的自行车,应( )A、先用布擦干,再用带油的布擦拭车链等部位 B、在自行车表面刷一层油漆 C、用布擦干即可 D、晾干后,用盐酸除去锈层12. 现有甲、乙、丙三种金属,用将其中的一种金属分别放入另外两种金属的硫酸盐溶液中的方法进行实验,得到三种金属间的转化关系(如图所示)则三种金属的活动性由强到弱的顺序是( ) A、乙、甲、丙 B、乙、丙、甲 C、丙、甲、乙 D、丙、乙、甲13. 炼铁高炉中发生了下列反应:其中属于化合反应的是( )
A、乙、甲、丙 B、乙、丙、甲 C、丙、甲、乙 D、丙、乙、甲13. 炼铁高炉中发生了下列反应:其中属于化合反应的是( )①高温下一氧化碳将铁矿石还原为铁②高温煅烧石灰石
③灼热的焦炭和二氧化碳反应④焦炭充分燃烧
A、①和④ B、②和③ C、③和④ D、只有④14. 下列四个化学反应中,符合此漫画情景的是( ) A、Fe+CuSO4=FeSO4+Cu B、CuO+CO Cu+CO2 C、H2+CuO Cu+H2O D、Fe+H2SO4=FeSO4+H2↑15. 把铁钉放入稀硫酸中,下列叙述正确的是( )
A、Fe+CuSO4=FeSO4+Cu B、CuO+CO Cu+CO2 C、H2+CuO Cu+H2O D、Fe+H2SO4=FeSO4+H2↑15. 把铁钉放入稀硫酸中,下列叙述正确的是( )①在铁钉表面产生气泡②溶液由无色逐渐变为浅绿色③铁钉的质量增加
A、②③ B、①②③ C、①③ D、①②16. 下列物质,不能由金属单质和盐酸直接反应生成的是( )A、FeCl3 B、ZnCl2 C、MgCl2 D、AlCl317. 只用一种试剂就能一次性判断金属锌、铜、银的活动性顺序,这种试剂是( )A、氯化镁溶液 B、稀硫酸 C、硫酸铜溶液 D、硝酸银溶液18. 在CuCl2和AlCl3的混合溶液中,加入过量的锌粉,充分反应后过滤,留在滤纸上的物质是( )A、Cu B、Cu和Al C、Zn和Cu D、Cu、Al和Zn19. 下列说法或做法中,正确的是( )A、铝制品耐腐蚀,是因为它的化学性质不活泼 B、合金的用途比纯金属广泛 C、银的导电性比铜好,因此电线一般都是用银制的 D、配制波尔多液时,通常用铁制容器20. 下列关于溶液的说法正确的是( )A、溶液具有均一性、稳定性 B、长期放置后不会分层的液体一定是溶液 C、气体的溶解度随压强增大而减小 D、医用酒精是75%的乙醇溶液,乙醇作溶剂21. 在温度不变的条件下,下列欲使溶质的质量分数变为原来2倍的方法,最可行的是( )A、将20g硝酸钾饱和溶液蒸发掉10g水 B、将20g硝酸钾不饱和溶液蒸发掉10g水 C、在10g10%的硝酸钾溶液中,加入5g40%的硝酸钾溶液 D、将10g硝酸钾不饱和溶液中加入10g硝酸钾固体22. 对下列现象的解释错误的是( )A、5mL水与5mL酒精混合后总体积小于10mL,是因为分子与分子之间有间隔 B、不同的花儿香味不同,是因为不同的分子性质不同 C、打开汽水瓶盖后有大量气体从汽水中冒出,是因为气体的溶解度随压强的减小而减小 D、煤粉比煤块容易燃烧,是因为煤粉的着火点低于煤块的着火点23. 下列叙述中正确的是 ( )A、饱和溶液降温析出晶体后的溶液仍为饱和溶液 B、饱和溶液的质量比不饱和溶液的质量大 C、某同体物质的饱和溶液升高温度后一定变成不饱溶液 D、饱和溶液中所含的溶质质量一定比不饱和溶液的要多24. 常温下,对100mL氯化钠饱和溶液进图示实验。下列分析错误的是( ) A、实验1后,甲、乙中溶液的溶质质量分数相等 B、实验2后,乙中比甲中氯化钠的溶解度大 C、实验2后,甲中溶液为氯化钠的不饱和溶液 D、实验2后,甲乙中溶液所含溶质质量相等25. 如图所示,下列判断正确的是( )
A、实验1后,甲、乙中溶液的溶质质量分数相等 B、实验2后,乙中比甲中氯化钠的溶解度大 C、实验2后,甲中溶液为氯化钠的不饱和溶液 D、实验2后,甲乙中溶液所含溶质质量相等25. 如图所示,下列判断正确的是( ) A、Y的溶解度比X的溶解度大 B、t1℃时,X、Y两种饱和溶液的溶质质量分数都是20% C、若烧杯内有晶体析出,则烧杯中饱和溶液的溶质为Y D、t2℃时,若X、Y的饱和溶液质量相等,则溶液中溶质的质量X<Y
A、Y的溶解度比X的溶解度大 B、t1℃时,X、Y两种饱和溶液的溶质质量分数都是20% C、若烧杯内有晶体析出,则烧杯中饱和溶液的溶质为Y D、t2℃时,若X、Y的饱和溶液质量相等,则溶液中溶质的质量X<Y二、填空题(共23分)
-
26. 合理灭火与预防闪爆,十分重要。回答下列问题。
 (1)、火灾是燃烧最常见的危害。如图所示的“火立熄”是一种新型的家用灭火用品。“火立熄”接触到火焰3-5秒后炸开,释放的粉末覆盖在燃烧物上,同时放出不可燃气体,使火焰熄灭。其灭火原理是 (填序号)。A、清除可燃物 B、使燃烧物与氧气隔绝 C、降低燃烧物的着火点(2)、预防闪爆。下列哪些物质漂浮在空气中遇见明火不会闪爆的是 。A、天然气 B、氮气 C、酒精蒸汽 D、面粉或煤粉27. 现有干冰、甲烷、金刚石和二氧化硫四种物质,请用化学式按要求填空:(1)、可用作钻头的是(2)、可用于人工降雨的是(3)、天然气的主要成分是(4)、能引起酸雨的气体是28.
(1)、火灾是燃烧最常见的危害。如图所示的“火立熄”是一种新型的家用灭火用品。“火立熄”接触到火焰3-5秒后炸开,释放的粉末覆盖在燃烧物上,同时放出不可燃气体,使火焰熄灭。其灭火原理是 (填序号)。A、清除可燃物 B、使燃烧物与氧气隔绝 C、降低燃烧物的着火点(2)、预防闪爆。下列哪些物质漂浮在空气中遇见明火不会闪爆的是 。A、天然气 B、氮气 C、酒精蒸汽 D、面粉或煤粉27. 现有干冰、甲烷、金刚石和二氧化硫四种物质,请用化学式按要求填空:(1)、可用作钻头的是(2)、可用于人工降雨的是(3)、天然气的主要成分是(4)、能引起酸雨的气体是28.
(1)、铝是活泼金属,通常铝制品却很耐腐蚀,原因是
(2)、下图是某探究实验装置图。一段时间后,能观察到什么现象(装置气密性良好,且开始时U型管两端的红墨水液面相平) 29. X、Y、Z是三种金属固体,将X和Y浸入稀硫酸中,Y溶解并产生氢气,X无变化;将Ⅹ和Z浸入硝酸银溶液中,X表面有银析出而Z无变化。
29. X、Y、Z是三种金属固体,将X和Y浸入稀硫酸中,Y溶解并产生氢气,X无变化;将Ⅹ和Z浸入硝酸银溶液中,X表面有银析出而Z无变化。①判断X、Y、Z和银四种金属的活动性由强到弱的顺序。
②具体确定一种ⅹ后,写出ⅹ与硝酸银溶液反应的化学方程式。
30. 如图为某学习小组探究金属化学性质时所做的四个实验,仔细分析后回答下列问题: (1)、请你描述B中的实验现象;写出D中反应的化学方程式:。(2)、证明Cu、Fe、Ag的活动性顺序,至少要做哪些实验。31. 请根据如图所示a、b、c三种固体物质的溶解度曲线,回答下列问题:
(1)、请你描述B中的实验现象;写出D中反应的化学方程式:。(2)、证明Cu、Fe、Ag的活动性顺序,至少要做哪些实验。31. 请根据如图所示a、b、c三种固体物质的溶解度曲线,回答下列问题: (1)、在℃时,a、c两种物质的溶解度相等。(2)、若a物质中混有少量b物质最好采用的方法提纯a。(3)、t2℃时,a、b、c三种物质的饱和溶液各100g,所含溶剂的质量由大到小的顺序是。(4)、t1℃时将等质量三种物质的饱和溶液升温至t2℃,所得溶液的质量关系是 。(5)、在t2℃时向盛有50ga物质的烧杯中加入50g水,充分溶解后,所得溶液的质量为g。(6)、t2℃时将100g物质a的饱和溶液恒温蒸发20g水后,可析出a物质的质量为g。32. A-H都是初中化学中常见的物质,已知A、B为黑色固体,C可用作气体肥料,F为红色固体,A、D、G是单质。它们的转化关系如图所示(反应条件、部分生成物已略去),请回答:
(1)、在℃时,a、c两种物质的溶解度相等。(2)、若a物质中混有少量b物质最好采用的方法提纯a。(3)、t2℃时,a、b、c三种物质的饱和溶液各100g,所含溶剂的质量由大到小的顺序是。(4)、t1℃时将等质量三种物质的饱和溶液升温至t2℃,所得溶液的质量关系是 。(5)、在t2℃时向盛有50ga物质的烧杯中加入50g水,充分溶解后,所得溶液的质量为g。(6)、t2℃时将100g物质a的饱和溶液恒温蒸发20g水后,可析出a物质的质量为g。32. A-H都是初中化学中常见的物质,已知A、B为黑色固体,C可用作气体肥料,F为红色固体,A、D、G是单质。它们的转化关系如图所示(反应条件、部分生成物已略去),请回答: (1)、C的化学式为。(2)、写出反应①的化学方程式为:;(3)、写出反应③的化学方程式 。(4)、反应①②③④中属于置换反应的有(填序号)。
(1)、C的化学式为。(2)、写出反应①的化学方程式为:;(3)、写出反应③的化学方程式 。(4)、反应①②③④中属于置换反应的有(填序号)。三、实验与探究(共22分)
-
33. 下列是初中化学中的一些常见实验。请回答。
 (1)、A实验中,铜片上的白磷燃烧而红磷不燃烧,说明燃烧的条件之一是。(2)、B实验中,下层的蜡烛先熄灭上层的蜡烛后熄灭。说明CO2的化学性质是。34. 铜和铁是生产、生活中广泛使用的金属。(1)、工业上用一氧化碳和赤铁矿(主要成分是氧化铁)反应的化学方程式为。(2)、铁生锈的条件是;铜表面也容易生在绿色铜锈,铜锈的主要成分是碱式碳酸铜化学式为Cu2(OH)2CO3。(3)、老师用生锈的铜片、铁粉和稀硫酸进行实验,实验过程如图所示(部分生成物已略去)。
(1)、A实验中,铜片上的白磷燃烧而红磷不燃烧,说明燃烧的条件之一是。(2)、B实验中,下层的蜡烛先熄灭上层的蜡烛后熄灭。说明CO2的化学性质是。34. 铜和铁是生产、生活中广泛使用的金属。(1)、工业上用一氧化碳和赤铁矿(主要成分是氧化铁)反应的化学方程式为。(2)、铁生锈的条件是;铜表面也容易生在绿色铜锈,铜锈的主要成分是碱式碳酸铜化学式为Cu2(OH)2CO3。(3)、老师用生锈的铜片、铁粉和稀硫酸进行实验,实验过程如图所示(部分生成物已略去)。
①紫红色固体C的化学式为。
②写出Ⅱ中反应的化学方程式。
35. 配制一定溶质质量分数的面氯化钠溶液的过程如图所示: (1)、写出图中标号a仪器的名称:。(2)、配制50g质量分数为15%的氯化钠溶液,所需氯化钠和水的质量分别为:氯化钠g,水g。(3)、溶解过程中玻璃棒的作用是。(4)、对配制的溶液进行检测发现溶质质量分数偏小,其原因可能有 。(填序号)A、称量时,药品与砝码放反了 B、量取水的体积时,仰视读数 C、装瓶时,有少量溶液洒出
(1)、写出图中标号a仪器的名称:。(2)、配制50g质量分数为15%的氯化钠溶液,所需氯化钠和水的质量分别为:氯化钠g,水g。(3)、溶解过程中玻璃棒的作用是。(4)、对配制的溶液进行检测发现溶质质量分数偏小,其原因可能有 。(填序号)A、称量时,药品与砝码放反了 B、量取水的体积时,仰视读数 C、装瓶时,有少量溶液洒出四、计算题(5分)
-
36. 小刚同学想测定黄铜(铜锌合金)中铜的质量分数。他取32.5克黄铜样品,加入足量稀硫酸,反应后生成了0.4克气体,请你帮他计算该合金中铜元素的质量分数。