山西省运城市芮城县2018-2019学年高二上学期化学期末考试试卷
试卷更新日期:2019-12-18 类型:期末考试
一、单选题
-
1. 分子式为C5H11Cl且含有两个甲基的同分异构体共有(不考虑立体异构)( )A、7种 B、6种 C、5种 D、4种2. R、W、X、Y、Z五种元素在周期表的位置如图,下列说法正确的是( )
 A、第一电离能: W<Y B、微粒半径:Y < X C、最高正化合价: X = Z D、气态氢化物的稳定性:X > Y3. 下列说法错误的是( )A、3p2表示3p能级有两个电子 B、价电子数为3的原子一定属于主族元素 C、同一原子中,1s、2s、3s电子的能量不相同 D、在一个基态多电子的原子中,没有运动状态完全相同的电子4. 下列分离或除杂方法错误的是( )A、可用饱和碳酸钠溶液通过分液的方法除去乙酸乙酯中的乙酸 B、用催化加氢的方法可除去乙烷中混有的少量乙烯 C、可用蒸馏的方法分离工业乙醇 D、利用重结晶的方法可提纯粗苯甲酸5. 反应:H2(g)+ I2(g) 2HI(g) △H ﹤0 达平衡后,下列说法正确的是( )A、增加H2的量,反应放出的热量减小 B、升高温度,反应放出的热量增加 C、增大压强,反应放出的热量不变 D、加入催化剂,反应的△H减小6. 在下列装置中(都盛有0.1mol·L-1H2SO4溶液)Zn片腐蚀最快的是( )A、
A、第一电离能: W<Y B、微粒半径:Y < X C、最高正化合价: X = Z D、气态氢化物的稳定性:X > Y3. 下列说法错误的是( )A、3p2表示3p能级有两个电子 B、价电子数为3的原子一定属于主族元素 C、同一原子中,1s、2s、3s电子的能量不相同 D、在一个基态多电子的原子中,没有运动状态完全相同的电子4. 下列分离或除杂方法错误的是( )A、可用饱和碳酸钠溶液通过分液的方法除去乙酸乙酯中的乙酸 B、用催化加氢的方法可除去乙烷中混有的少量乙烯 C、可用蒸馏的方法分离工业乙醇 D、利用重结晶的方法可提纯粗苯甲酸5. 反应:H2(g)+ I2(g) 2HI(g) △H ﹤0 达平衡后,下列说法正确的是( )A、增加H2的量,反应放出的热量减小 B、升高温度,反应放出的热量增加 C、增大压强,反应放出的热量不变 D、加入催化剂,反应的△H减小6. 在下列装置中(都盛有0.1mol·L-1H2SO4溶液)Zn片腐蚀最快的是( )A、 B、
B、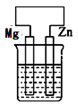 C、
C、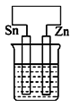 D、
D、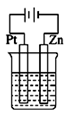 7. 下列实验事实不能用勒夏特列原理解释的是( )A、唾液可以使淀粉水解速率加快 B、红棕色的NO2气体加压后颜色先变深后变浅 C、向Fe(SCN)3溶液中加入铁粉,溶液颜色变浅或褪色 D、在AgCl的悬浊液中加Na2S溶液,生成黑色Ag2S沉淀8. 下列实验操作符合题意且能达到相应实验目的的是( )
7. 下列实验事实不能用勒夏特列原理解释的是( )A、唾液可以使淀粉水解速率加快 B、红棕色的NO2气体加压后颜色先变深后变浅 C、向Fe(SCN)3溶液中加入铁粉,溶液颜色变浅或褪色 D、在AgCl的悬浊液中加Na2S溶液,生成黑色Ag2S沉淀8. 下列实验操作符合题意且能达到相应实验目的的是( )实验目的
实验操作
A
验证Cu(OH)2的溶度积比Mg(OH)2的小
将0.1 mol·L-1MgSO4溶液滴入NaOH溶液至不再有沉淀产生,再滴加0.1 mol·L-1CuSO4溶液
B
配制FeCl3溶液
将FeCl3固体溶于适量蒸馏水
C
证明NH3·H2O是
弱电解质
室温下,用蒸馏水润湿的pH试纸测定0.1mol·L-1氨水溶液pH
D
验证铁的吸氧腐蚀
将铁钉放入试管中,用盐酸浸没
A、A B、B C、C D、D9. 下列描述中,不符合生产实际的是( )A、电解熔融的氧化铝制取金属铝 B、在镀件上电镀锌,用锌作阳极 C、电解法精炼粗铜,用纯铜作阳极 D、电解饱和食盐水制烧碱,阳极室产生氯气10. 下列说法正确的是( )A、吸热反应一定需要加热才能进行 B、已知C(石墨,s)=C(金刚石,s) ΔH >0,则金刚石比石墨稳定 C、已知C(s)+O2(g)=CO2(g) ΔH1 ; C(s)+1/2O2(g)=CO(g)ΔH2 , 则ΔH1>ΔH2 D、已知2CO2(g)=2CO(g)+O2(g)△H=+566 kJ/mol 则CO的燃烧热ΔH =-283.0kJ/mol11. 下列现象或变化与原电池无关的是( )A、银质物品久置表面变暗 B、生铁比纯铁容易生锈 C、镀锌铁表面有划损时,仍然能阻止铁被氧化 D、锌与稀硫酸反应时,加入少量CuSO4溶液可使反应加快12. 298K时,向20mL 0.01mol/LCH3COOH溶液中逐滴加入0.01mol/LKOH溶液,其pH变化曲线如图所示。下列叙述错误的是( ) A、a > 2 B、c点溶液中:c(K+)=c(CH3COO﹣)+c(CH3COOH) C、a、b、c、d四点溶液的导电性顺序:d > c> b > a D、b点溶液中:2 c(H+)+ c(CH3COOH)= c(CH3COO-)+2c(OH-)13. 室温下,下列溶液等体积混合后,所得溶液的pH一定大于7的是( )A、0.1mol/L的盐酸和0.1mol/L的氨水溶液 B、0.1mol/L的盐酸和0.1mol/L的氢氧化钠溶液 C、pH=4的醋酸溶液和pH=10的氢氧化钠溶液 D、pH=4的盐酸和pH=l0的氨水14. 准确移取20.00mL某待测盐酸溶液于锥形瓶中,用0.1000mol/LNaOH溶液滴定。下列说法正确的是( )A、滴定管用蒸馏水洗涤后,装入NaOH溶液进行滴定 B、滴定前滴定管内无气泡,终点读数时有气泡,则所测盐酸浓度偏小 C、用酚酞作指示剂,当锥形瓶中溶液由红色变无色,且半分钟不变色时,停止滴定 D、移取盐酸前需用盐酸溶液润洗锥形瓶以减小实验误差15. 截至2016年年底,中国光伏发电新增装机容量达到34.54GW,光伏发电累计装机容量达到77.42GW,图1为光伏并网发电装置。图2为电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极)。下列叙述中正确的是( )
A、a > 2 B、c点溶液中:c(K+)=c(CH3COO﹣)+c(CH3COOH) C、a、b、c、d四点溶液的导电性顺序:d > c> b > a D、b点溶液中:2 c(H+)+ c(CH3COOH)= c(CH3COO-)+2c(OH-)13. 室温下,下列溶液等体积混合后,所得溶液的pH一定大于7的是( )A、0.1mol/L的盐酸和0.1mol/L的氨水溶液 B、0.1mol/L的盐酸和0.1mol/L的氢氧化钠溶液 C、pH=4的醋酸溶液和pH=10的氢氧化钠溶液 D、pH=4的盐酸和pH=l0的氨水14. 准确移取20.00mL某待测盐酸溶液于锥形瓶中,用0.1000mol/LNaOH溶液滴定。下列说法正确的是( )A、滴定管用蒸馏水洗涤后,装入NaOH溶液进行滴定 B、滴定前滴定管内无气泡,终点读数时有气泡,则所测盐酸浓度偏小 C、用酚酞作指示剂,当锥形瓶中溶液由红色变无色,且半分钟不变色时,停止滴定 D、移取盐酸前需用盐酸溶液润洗锥形瓶以减小实验误差15. 截至2016年年底,中国光伏发电新增装机容量达到34.54GW,光伏发电累计装机容量达到77.42GW,图1为光伏并网发电装置。图2为电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极)。下列叙述中正确的是( ) A、图1中N型半导体为正极,P型半导体为负极 B、图2溶液中电子流向:从B极流向A极 C、X2为氧气 D、工作时,A极的电极反应式为CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O16. 一定条件下,体积为2L的密闭容器中,2mol X和3mol Y进行反应:X(g)+Y(g) Z(g),经12s达到平衡,生成0.6molZ。下列说法正确的是( )A、以X浓度变化表示的反应速率为0.05 mol/(L•s) B、其他条件不变,增大X的浓度,平衡右移,X的转化率增大 C、其他条件不变,12s后将容器体积扩大为10L,Z的平衡浓度变为0.06mol/L D、其他条件不变,若移走1molX和1.5molY,再达平衡时Z的物质的量小于0.3mol17. 熔融碳酸盐燃料电池简称MCFC ,具有高发电效率,工作原理示意图如图。下列有关说法正确的是( )
A、图1中N型半导体为正极,P型半导体为负极 B、图2溶液中电子流向:从B极流向A极 C、X2为氧气 D、工作时,A极的电极反应式为CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O16. 一定条件下,体积为2L的密闭容器中,2mol X和3mol Y进行反应:X(g)+Y(g) Z(g),经12s达到平衡,生成0.6molZ。下列说法正确的是( )A、以X浓度变化表示的反应速率为0.05 mol/(L•s) B、其他条件不变,增大X的浓度,平衡右移,X的转化率增大 C、其他条件不变,12s后将容器体积扩大为10L,Z的平衡浓度变为0.06mol/L D、其他条件不变,若移走1molX和1.5molY,再达平衡时Z的物质的量小于0.3mol17. 熔融碳酸盐燃料电池简称MCFC ,具有高发电效率,工作原理示意图如图。下列有关说法正确的是( ) A、电极M为负极,K+、Na+移向M B、电池工作时,熔融盐中CO32-物质的量增大 C、A 为CO2 , 正极的电极反应为:O 2+4e -+2CO2 = 2CO32 - D、若用MCFC给铅蓄电池充电,电极N接Pb极18. 已知AgCl和AgBr的溶解度分别为1.5×10-4g、8.4×10-6g,将AgCl与AgBr的饱和溶液等体积混合,再加入足量AgNO3溶液,发生的反应为( )A、只有AgBr沉淀生成 B、AgCl和AgBr沉淀等量生成 C、AgCl沉淀多于AgBr沉淀 D、AgCl沉淀少于AgBr沉淀19. 已知298K时,Fe(OH)2和Cu(OH)2的饱和溶液中,金属阳离子的物质的量浓度的负对数[-lgC(M2+)]与溶液pH的变化关系如a、b所示,已知该温度下,Ksp[Cu(OH)2]<Ksp[Fe(OH)2],正确的是( )
A、电极M为负极,K+、Na+移向M B、电池工作时,熔融盐中CO32-物质的量增大 C、A 为CO2 , 正极的电极反应为:O 2+4e -+2CO2 = 2CO32 - D、若用MCFC给铅蓄电池充电,电极N接Pb极18. 已知AgCl和AgBr的溶解度分别为1.5×10-4g、8.4×10-6g,将AgCl与AgBr的饱和溶液等体积混合,再加入足量AgNO3溶液,发生的反应为( )A、只有AgBr沉淀生成 B、AgCl和AgBr沉淀等量生成 C、AgCl沉淀多于AgBr沉淀 D、AgCl沉淀少于AgBr沉淀19. 已知298K时,Fe(OH)2和Cu(OH)2的饱和溶液中,金属阳离子的物质的量浓度的负对数[-lgC(M2+)]与溶液pH的变化关系如a、b所示,已知该温度下,Ksp[Cu(OH)2]<Ksp[Fe(OH)2],正确的是( ) A、a线表示Fe(OH)2饱和溶液中的变化关系 B、除去CuSO4溶液中少量的Fe2+ , 可加入适量CuO C、向X点对应的饱和溶液中加入少量NaOH,可转化为Y点对应的溶液 D、当Fe(OH)2和Cu(OH)2沉淀共存时,溶液中:c(Fe2+):c(Cu2+)=104.6:120. 用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,阴、阳两极均收集到5.6L气体时(标准状况),电解过程中转移的电子为( )A、0.5mol B、1mol C、1.5mol D、2mol
A、a线表示Fe(OH)2饱和溶液中的变化关系 B、除去CuSO4溶液中少量的Fe2+ , 可加入适量CuO C、向X点对应的饱和溶液中加入少量NaOH,可转化为Y点对应的溶液 D、当Fe(OH)2和Cu(OH)2沉淀共存时,溶液中:c(Fe2+):c(Cu2+)=104.6:120. 用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,阴、阳两极均收集到5.6L气体时(标准状况),电解过程中转移的电子为( )A、0.5mol B、1mol C、1.5mol D、2mol二、综合题
-
21. “低碳经济”已成为全世界科学家研究的重要课题,其综合利用具有重要意义。回答下列问题:(1)、CO2与CH4经催化重整,制得合成气:CH4(g)+ CO2(g) 2CO (g)+ 2H2(g)
①已知上述反应中相关的化学键键能数据如下:
化学键
C—H
C=O
H—H
C
 O(CO)
O(CO)键能/kJ·mol−1
413
745
436
1075
则该反应的ΔH=。有利于提高CH4平衡转化率的条件是(填标号)。
A.高温低压 B.低温高压 C.高温高压 D.低温低压
②某温度下,在体积为2 L的容器中加入2 mol CH4、1 mol CO2以及催化剂进行重整反应,达到平衡时CO2的转化率是50%,其平衡常数为mol2·L-2。
(2)、CO2可以被NaOH溶液捕获。若所得溶液c(HCO3−)∶c(CO32 -)=2∶1,溶液pH=。(室温下,H2CO3的K1=4×10-7;K2=5×10-11),0.1mol·L-1 NaHCO3溶液中阴离子的浓度由大到小的顺序为(3)、研究证实,CO2也可在酸性水溶液中通过电解生成甲醇,则生成甲醇的反应发生在极,该电极反应式是三、实验题
-
22. 原电池是将化学能转化为电能的装置。分析甲、乙两原电池装置,回答下列问题:

 (1)、甲、乙两装置中铜电极都有红色物质析出,则Zn电极是极,Cu电极表面发生反应的电极反应式为;与甲装置相比,乙装置的优点是 , 原因是。(2)、把甲池中的物质进行替换后变成丙装置,用以探究牺牲阳极的阴极保护法。一段时间后往Fe电极区滴入2滴铁氰化钾溶液,烧杯中的溶液颜色(填“有”或“无)变化,若把Zn换成Cu后,继续反应一段时间后现象为。
(1)、甲、乙两装置中铜电极都有红色物质析出,则Zn电极是极,Cu电极表面发生反应的电极反应式为;与甲装置相比,乙装置的优点是 , 原因是。(2)、把甲池中的物质进行替换后变成丙装置,用以探究牺牲阳极的阴极保护法。一段时间后往Fe电极区滴入2滴铁氰化钾溶液,烧杯中的溶液颜色(填“有”或“无)变化,若把Zn换成Cu后,继续反应一段时间后现象为。四、填空题
-
23.(1)、已知Ksp(AgCl)=1.8×10-10 , 若向50mL0.018mol·L-1的AgNO3溶液中加入50mL0.020 mol·L-1的盐酸,混合后溶液中Ag+的浓度为mol·L-1(2)、某原电池装置如下图所示,电池总反应为2Ag+Cl2=2AgCl。负极电极反应式为 , 当电路中转移2mole- 时,交换膜左侧溶液中约减少mol离子。
 24. 根据原子结构与性质的相关知识,请回答下列问题:(1)、基态S原子电子占据最高能层的符号是 , 最高能级的电子云轮廓图为形。(2)、下列Li原子电子排布图表示的状态中,能量最低和最高的分别为、(填标号)。
24. 根据原子结构与性质的相关知识,请回答下列问题:(1)、基态S原子电子占据最高能层的符号是 , 最高能级的电子云轮廓图为形。(2)、下列Li原子电子排布图表示的状态中,能量最低和最高的分别为、(填标号)。 (3)、Fe3+基态核外电子排布式为(4)、根据元素周期律,原子半径As Se,电负性As Se (填“大于”或“小于”)(5)、元素铜与镍的第二电离能分别为:ICu=1958kJ·mol-1、INi=1753kJ·mol-1 , ICu>INi的原因是25. 根据有机化学基础,请回答下列问题:(1)、如图是含C、H、O三种元素的某有机分子模型(图中球与球之间的连线代表单键、双键等化学键),其所含官能团的名称为
(3)、Fe3+基态核外电子排布式为(4)、根据元素周期律,原子半径As Se,电负性As Se (填“大于”或“小于”)(5)、元素铜与镍的第二电离能分别为:ICu=1958kJ·mol-1、INi=1753kJ·mol-1 , ICu>INi的原因是25. 根据有机化学基础,请回答下列问题:(1)、如图是含C、H、O三种元素的某有机分子模型(图中球与球之间的连线代表单键、双键等化学键),其所含官能团的名称为 (2)、
(2)、 的名称(系统命名)
的名称(系统命名)  的分子式为 (3)、分子式为C5H10 , 且属于烯的同分异构体有种(不考虑立体异构)(4)、某有机化合物A经李比希法测得其中含碳为72.0%、含氢为6.67%,其余为氧。现用下列方法测定该有机化合物的相对分子质量和分子结构。
的分子式为 (3)、分子式为C5H10 , 且属于烯的同分异构体有种(不考虑立体异构)(4)、某有机化合物A经李比希法测得其中含碳为72.0%、含氢为6.67%,其余为氧。现用下列方法测定该有机化合物的相对分子质量和分子结构。
方法一:用质谱法分析得知A的相对分子质量为150。
方法二:核磁共振仪测出A的核磁共振氢谱有5个峰,其面积之比为1:2:2:2:3,如图甲所示。
方法三:利用红外光谱仪测得A分子的红外光谱如图乙所示。
则A的分子式为 , 写出符合条件的A的一种结构简式
五、工业流程
-
26. 下图是以闪锌矿(ZnS,含有SiO2和少量FeS、CdS、PbS杂质)为原料制备金属锌的流程图:

溶浸液中金属离子[c0(Mn+)=0.1 mol·L-1]形成氢氧化物沉淀的pH范围如下:
金属离子
Fe3+
Fe2+
Zn2+
Cd2+
开始沉淀的pH
1.5
6.3
6.2
7.4
沉淀完全的pH
2.8
8.3
8.2
9.4
回答下列问题:
(1)、为提高溶浸速率,除适当增加硫酸浓度外,还可采取的措施有(写一条)。(2)、滤渣1的主要成分除SiO2外还有。(3)、氧化除杂工序中若不通入氧气,其后果是 , 加入X的作用是调节pH值,X可以是。A.NaOH B.ZnO C.ZnCl2 D.ZnCO3
(4)、还原除杂工序得到的金属为。(5)、电解硫酸锌溶液制备单质锌时,阴极的电极反应式为;沉积锌后的电解液可返回工序继续使用。
-
-